名校
解题方法
1 . (1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___ 。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。

①b点时,平衡体系中C、N原子个数之比接近___ ;
②a、b、c三点CO的转化率从大到小的顺序为___ ;a、c、d三点的平衡常数从大到小的顺序为___ 。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__ 。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____ (填化学式);A电极的电极反应式为____ ;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___ 。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____ ,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___ (填“酸性”“碱性”或“中性”)。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
2019-10-31更新
|
229次组卷
|
2卷引用:吉林省吉林市2020届高三第三次调研测试(4月) 理综化学试题
名校
2 . 某化学兴趣小组进行了实验:向2支试管中分别加入0.5gNa2CO3固体和0.5gNaHCO3固体,再分别加入30mL0.3mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论:CO (aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO
(aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO (aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
(aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?_______ (填“甲”或“乙”),理由是_______ 。
(2)查阅资料:
反应I :CO (aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;
反应II :HCO (aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1
(aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1
①则反应III:CO (aq)+ H+ (aq)=HCO
(aq)+ H+ (aq)=HCO (aq) ΔH3=
(aq) ΔH3= _______ kJ·mol-1。
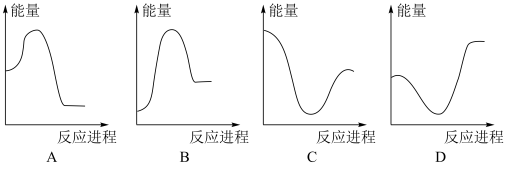
②向V mLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是_______ (填标号)。
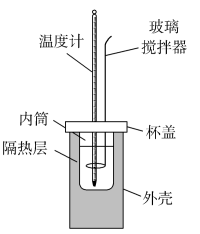
(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______ 。
②表格二对应实验得出的结论是_______ 。
③反应IV:Na2CO3(s)+2H+(aq)=2Na+(aq)+H2O(l)+CO2(g) ΔH4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(l)+CO2(g) ΔH5
则ΔH1_______ (填“>”、“<”或“=”,下同)ΔH4,ΔH2_______ ΔH5。
 (aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO
(aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO (aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
(aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?
(2)查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1
(aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1①则反应III:CO
 (aq)+ H+ (aq)=HCO
(aq)+ H+ (aq)=HCO (aq) ΔH3=
(aq) ΔH3= ②向V mLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是

(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格一:
| 试剂1 | 试剂2混合前温度/°C | 混合后温度/°C |
| 0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
| 0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
| 试剂1 | 试剂2混合前温度/°C | 溶解后温度/°C | 静置后的温度/°C | 试剂3混合前温度/°C | 混合后温度/°C |
| 0.5gNa2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLH2O19.0 | 19.0 |
| 0.5gNaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLH2O19.0 | 19.0 |
| 试剂1 | 试剂2混合前温度/°C | 溶解后温度/°C | 静置后的温度/°C | 试剂3混合前温度/°C | 混合后温度/°C |
| 0.5gNa2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLHCl19.0 | 20.5 |
| 0.5gNaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLHCl19.0 | 18.3 |
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应IV:Na2CO3(s)+2H+(aq)=2Na+(aq)+H2O(l)+CO2(g) ΔH4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(l)+CO2(g) ΔH5
则ΔH1
您最近一年使用:0次
2021-11-12更新
|
225次组卷
|
6卷引用:吉林省长春市实验中学2023-2024学年高一上学期期中化学试题
3 . 硒(Se)元素位于元素周期表第四周期第VIA族。请回答下列问题:
I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
(1)写出“混合气体用水吸收”时发生反应的化学方程式_______ 。
(2)下列说法正确的是_______ (填字母)。
A.SeO2可以氧化H2S,但遇到强氧化剂时可能表现还原性
B.热稳定性:H2Se>H2S
C.“焙烧”时的主要反应为:CuSe+4H2SO4(浓) CuSO4+SeO2↑+3SO2↑+4H2O
CuSO4+SeO2↑+3SO2↑+4H2O
II.硒及其氢化物H2Se在新型光伏太阳能电池和金属硒化物方面有重要应用。
(3)已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=_______ kJ•mol−1(用含m、n、p的代数式表示)。
(4)已知常温H2Se的电离平衡常数K1=1.3×10−4,K2=5.0×10−11,则NaHSe溶液的离子浓度由大到小的顺序为_______ 。Ag2SO4在一定条件下可以制备Ag2SeO4已知该条件下Ag2SeO4的Ksp=5.7×10−8,Ag2SO4的的Ksp=1.4×10−5,则反应Ag2SO4(s)+SeO (aq)⇌Ag2SeO4(s)+SO
(aq)⇌Ag2SeO4(s)+SO (aq)的化学平衡常数K=
(aq)的化学平衡常数K=_______ (保留两位有效数字)。
III.研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(5)用惰性电极电解弱电解质亚硒酸(H2SeO3)溶液可制得强酸H2SeO4,电解过程中阳极生成2mol产物时,阴极析出标准状态下的气体_______ L。
(6)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。制备纳米零价铁时,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600℃,保持2小时,该过程中木炭的作用有吸附和_______ 。木炭包覆纳米零价铁在碱性含硒废水中形成许多微电池,加速SeO 的还原过程。已知SeO
的还原过程。已知SeO 转化为单质Se,写出其对应的电极反应式
转化为单质Se,写出其对应的电极反应式_______ 。
I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
(1)写出“混合气体用水吸收”时发生反应的化学方程式
(2)下列说法正确的是
A.SeO2可以氧化H2S,但遇到强氧化剂时可能表现还原性
B.热稳定性:H2Se>H2S
C.“焙烧”时的主要反应为:CuSe+4H2SO4(浓)
 CuSO4+SeO2↑+3SO2↑+4H2O
CuSO4+SeO2↑+3SO2↑+4H2OII.硒及其氢化物H2Se在新型光伏太阳能电池和金属硒化物方面有重要应用。
(3)已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=
(4)已知常温H2Se的电离平衡常数K1=1.3×10−4,K2=5.0×10−11,则NaHSe溶液的离子浓度由大到小的顺序为
 (aq)⇌Ag2SeO4(s)+SO
(aq)⇌Ag2SeO4(s)+SO (aq)的化学平衡常数K=
(aq)的化学平衡常数K=III.研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(5)用惰性电极电解弱电解质亚硒酸(H2SeO3)溶液可制得强酸H2SeO4,电解过程中阳极生成2mol产物时,阴极析出标准状态下的气体
(6)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。制备纳米零价铁时,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600℃,保持2小时,该过程中木炭的作用有吸附和
 的还原过程。已知SeO
的还原过程。已知SeO 转化为单质Se,写出其对应的电极反应式
转化为单质Se,写出其对应的电极反应式
您最近一年使用:0次
4 . 完成下列问题。
(1)已知:①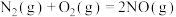
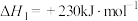
②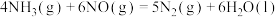
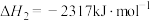
则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(2)已知几种化学键的键能和热化学方程式如下:

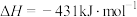 ,则
,则 =
=___________ 。
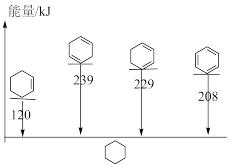
(3)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷( )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应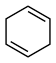 (l)=
(l)=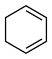 (l)的
(l)的 =
=___________ 。
(4)Fe和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:___________ ,若两个最近的 原子间的距离为
原子间的距离为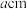 ,则该晶体的密度是
,则该晶体的密度是___________  。
。

(1)已知:①
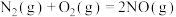
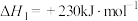
②
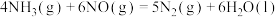
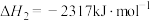
则表示氨气燃烧热的热化学方程式为
(2)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 |  | 432 |

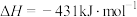 ,则
,则 =
=(3)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应 (l)=
(l)= (l)的
(l)的 =
=
(4)Fe和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
 原子间的距离为
原子间的距离为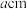 ,则该晶体的密度是
,则该晶体的密度是 。
。
您最近一年使用:0次
名校
解题方法
5 . 含氮物质的过量排放会污染大气,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)O3氧化性强于 O2,工业烟气中的 NO 经 O3处理后再用碱液吸收而实现脱除。
① 已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284.2 kJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=___________ kJ·mol-1。
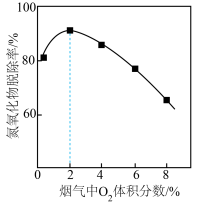
② 保持烟气气流速率一定、其他条件相同,NO 脱除率随反应温度变化如图所示。温度超过 150 ℃时,温度升高,NO 脱除率下降,可能的原因是___________ 。

(2)铁元素与EDTA的配合物中,只有亚铁配合物[Fe(Ⅱ)EDTA]能吸附氮氧化物, Fe(Ⅱ)EDTA吸附NO生成Fe(Ⅱ)EDTA•NO,连二亚硫酸钠(Na2S2O4)与吸附后的溶液反应可以实现吸附剂再生,同时生成(NH4)2SO3。
① EDTA的化学名为乙二胺四乙酸,结构简式如下图所示。在Fe(Ⅱ)EDTA中,乙二胺四乙酸根和 Fe2+形成六配位离子。其中配位键的形成方式是___________ 。

② 写出吸附剂再生反应的离子方程式:___________ 。
③ Fe(Ⅱ)EDTA吸收烟气中氮氧化物,其他条件相同时,烟气中O2含量对氮氧化物去除率的影响如图所示。在O2含量2 %前后,氮氧化物脱除率先升高后降低的原因是___________ 。
(1)O3氧化性强于 O2,工业烟气中的 NO 经 O3处理后再用碱液吸收而实现脱除。
① 已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284.2 kJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=
② 保持烟气气流速率一定、其他条件相同,NO 脱除率随反应温度变化如图所示。温度超过 150 ℃时,温度升高,NO 脱除率下降,可能的原因是

(2)铁元素与EDTA的配合物中,只有亚铁配合物[Fe(Ⅱ)EDTA]能吸附氮氧化物, Fe(Ⅱ)EDTA吸附NO生成Fe(Ⅱ)EDTA•NO,连二亚硫酸钠(Na2S2O4)与吸附后的溶液反应可以实现吸附剂再生,同时生成(NH4)2SO3。
① EDTA的化学名为乙二胺四乙酸,结构简式如下图所示。在Fe(Ⅱ)EDTA中,乙二胺四乙酸根和 Fe2+形成六配位离子。其中配位键的形成方式是

② 写出吸附剂再生反应的离子方程式:
③ Fe(Ⅱ)EDTA吸收烟气中氮氧化物,其他条件相同时,烟气中O2含量对氮氧化物去除率的影响如图所示。在O2含量2 %前后,氮氧化物脱除率先升高后降低的原因是

您最近一年使用:0次
2023-10-05更新
|
77次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期11月期中化学试题
名校
解题方法
6 . 一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)McMorris 测定和计算了在136-180℃范围内下列反应的平衡常数 :
:
2NO(g)+2ICl(g)=2NOCl(g)+I2(g) KP1
Cl2(g)+2NO(g)=2NOCl Kp2
则反应 的
的
___________ (用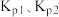 表示)。
表示)。
(2)Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率 光的照射下机理为:
光的照射下机理为:

其中 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。可知,分解10 mol的NOCl需要吸收
表示NOCl的激发态。可知,分解10 mol的NOCl需要吸收___________ mol的光子。
(3)已知反应Cl2(g)+I2(g)=2ICl(g)某温度下的的平衡常数 250,反应
250,反应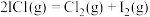 的正反应速率为v正=k正c2(ICl),逆反应速率为v逆=k逆c(Cl2)∙c(I2),其中
的正反应速率为v正=k正c2(ICl),逆反应速率为v逆=k逆c(Cl2)∙c(I2),其中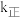 、
、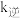 为速率常数,则该温度下
为速率常数,则该温度下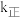 与
与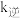 的比值为
的比值为___________ 。
(4)氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2,376.8℃时平衡常数Kp’=100(kPa)2,在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在376.8℃,碘蒸气初始压强为20.0 kPa.376.8℃平衡时,测得烧瓶中压强为32.5 kPa,则 =
=___________ kPa,反应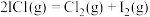 的平衡常数K=
的平衡常数K=___________ (用平衡分压代替平衡浓度计算)。
(1)McMorris 测定和计算了在136-180℃范围内下列反应的平衡常数
 :
:2NO(g)+2ICl(g)=2NOCl(g)+I2(g) KP1
Cl2(g)+2NO(g)=2NOCl Kp2
则反应
 的
的
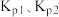 表示)。
表示)。(2)Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率
 光的照射下机理为:
光的照射下机理为:

其中
 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。可知,分解10 mol的NOCl需要吸收
表示NOCl的激发态。可知,分解10 mol的NOCl需要吸收(3)已知反应Cl2(g)+I2(g)=2ICl(g)某温度下的的平衡常数
 250,反应
250,反应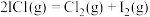 的正反应速率为v正=k正c2(ICl),逆反应速率为v逆=k逆c(Cl2)∙c(I2),其中
的正反应速率为v正=k正c2(ICl),逆反应速率为v逆=k逆c(Cl2)∙c(I2),其中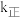 、
、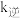 为速率常数,则该温度下
为速率常数,则该温度下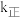 与
与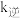 的比值为
的比值为(4)氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2,376.8℃时平衡常数Kp’=100(kPa)2,在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在376.8℃,碘蒸气初始压强为20.0 kPa.376.8℃平衡时,测得烧瓶中压强为32.5 kPa,则
 =
=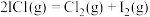 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
名校
解题方法
7 . 碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式__ 。
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g) 2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
①升高温度K值___ (增大、减小),T温度时化学平衡常数K=___ mol-1·L
②从0~2s该反应的平均速率v(NO2)=___ 。
③对可逆反应2NO(g)+O2(g) 2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___ 。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.氧气的转化率不再变化
D.N2、O2、NO的物质的量之比为1:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
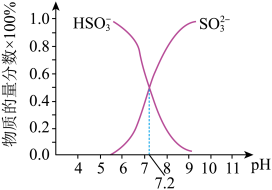
①已知Na2SO3水溶液显碱性,原因是___ (写出主要反应的离子方程式),该溶液中,c(Na+)___ 2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=____ 。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)
 2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①升高温度K值
②从0~2s该反应的平均速率v(NO2)=
③对可逆反应2NO(g)+O2(g)
 2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.氧气的转化率不再变化
D.N2、O2、NO的物质的量之比为1:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=

您最近一年使用:0次
2020-04-30更新
|
73次组卷
|
2卷引用:吉林省长春市第二十九中学2020届高三上学期期末考试化学试题
解题方法
8 . 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较硫与氯元素非金属性强弱的是____________ (填标号)。
A.将Cl2通入Na2S溶液中,有黄色浑浊出现 B.比较次氯酸和硫酸的酸性强弱
C.氯气与铁反应生成氯化铁,硫和铁反应生成硫化亚铁 D.还原性:H2S>HCl
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制备氢气的热化学方程式分别为___________ 、_______ ,制得等量H2所需能量较少的是_______ 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=______ %,反应平衡常数K=_____ 。(可用分数表示)
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2_________ α1,该反应的△H___ 0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是____________ (填标号)
A.H2S B.CO2 C.COS D.N2
(1)下列事实中,不能比较硫与氯元素非金属性强弱的是
A.将Cl2通入Na2S溶液中,有黄色浑浊出现 B.比较次氯酸和硫酸的酸性强弱
C.氯气与铁反应生成氯化铁,硫和铁反应生成硫化亚铁 D.还原性:H2S>HCl
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制备氢气的热化学方程式分别为
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率α1=
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2
③向反应器中再分别充入下列气体,能使H2S转化率增大的是
A.H2S B.CO2 C.COS D.N2
您最近一年使用:0次
解题方法
9 . H2S是存在于燃气中的一种有害气体,脱除H2S的方法有很多。
(1)国内有学者设计了“Cu2+一沉淀氧化”法脱除H2S。该法包括生成CuS沉淀,氧化CuS(Cu2++CuS+4Cl—=S+2CuCl2—)及空气氧化CuCl2—再生Cu2+。
①反应H2S(aq)+Cu2+(aq)⇌CuS(s)+2H+(aq)的K=__________
②再生Cu2+反应的离子方程式为____________ 。
(2)采用生物脱硫技术时,H2S与碱反应转化为HS-,在脱氮硫杆菌参与下,HS-被NO3-氧化为SO42—、NO3—被还原为N2。当33.6 m3(标准状况)某燃气(H2S的含量为0.2%)脱硫时,消耗NO3—的物质的量为___ mol。
(3)已知下列热化学方程式:
Ⅰ.H2(g)+ O2(g)=H2O(l) ∆H1=-285.8kJ∙mol-1
O2(g)=H2O(l) ∆H1=-285.8kJ∙mol-1
Ⅱ. H2(g)+S(s)=H2S(g) ∆H2=-20.6kJ∙mol-1
Ⅲ.S(s)+O2(g)=SO2(g) ∆H3=-296.8kJ∙mol-1
则以Claus法脱除H2S的反应:2H2S(g)+SO2 (g)=3S(s)+2H2O(1) △H=________ kJ/mol。
(4)101 kPa下,H2S分解:2H2S(g) ⇌ 2H2(g)+S2(g)。保持压强不变,反应达到平衡时,气体的体积分数(φ)随温度的变化曲线如图:
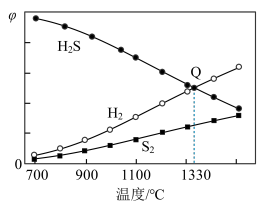
①在密闭容器中,关于反应2H2S(g) ⇌ 2H2(g)+S2 (g)的说法正确的是____ (填字母)。
A.Kp随温度的升高而增大
B.低压有利于提高HpS的平衡分解率
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,则v(正)<v(逆)
D.在恒容密闭容器中进行反应,当气体密度不再变化时,反应达到平衡状态
②图中Q点:H2S的平衡转化率为____ ;S2(g)的分压为____ kPa;1330℃时,反应2H2S(g) ⇌ 2H2(g)+S2(g)的Kp=_____ (Kp为以分压表示的平衡常数)。
(1)国内有学者设计了“Cu2+一沉淀氧化”法脱除H2S。该法包括生成CuS沉淀,氧化CuS(Cu2++CuS+4Cl—=S+2CuCl2—)及空气氧化CuCl2—再生Cu2+。
①反应H2S(aq)+Cu2+(aq)⇌CuS(s)+2H+(aq)的K=
②再生Cu2+反应的离子方程式为
(2)采用生物脱硫技术时,H2S与碱反应转化为HS-,在脱氮硫杆菌参与下,HS-被NO3-氧化为SO42—、NO3—被还原为N2。当33.6 m3(标准状况)某燃气(H2S的含量为0.2%)脱硫时,消耗NO3—的物质的量为
(3)已知下列热化学方程式:
Ⅰ.H2(g)+
 O2(g)=H2O(l) ∆H1=-285.8kJ∙mol-1
O2(g)=H2O(l) ∆H1=-285.8kJ∙mol-1Ⅱ. H2(g)+S(s)=H2S(g) ∆H2=-20.6kJ∙mol-1
Ⅲ.S(s)+O2(g)=SO2(g) ∆H3=-296.8kJ∙mol-1
则以Claus法脱除H2S的反应:2H2S(g)+SO2 (g)=3S(s)+2H2O(1) △H=
(4)101 kPa下,H2S分解:2H2S(g) ⇌ 2H2(g)+S2(g)。保持压强不变,反应达到平衡时,气体的体积分数(φ)随温度的变化曲线如图:

①在密闭容器中,关于反应2H2S(g) ⇌ 2H2(g)+S2 (g)的说法正确的是
A.Kp随温度的升高而增大
B.低压有利于提高HpS的平衡分解率
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,则v(正)<v(逆)
D.在恒容密闭容器中进行反应,当气体密度不再变化时,反应达到平衡状态
②图中Q点:H2S的平衡转化率为
您最近一年使用:0次
2020-01-31更新
|
336次组卷
|
3卷引用:吉林省白山市2020届高三上学期期末联考化学试题
10 . 氨和肼(N2H4)都是氮元素的重要氢化物,在工农业生产、生活中有广泛应用。
(1)工业中常用以下反应合成氨:N2+3H2 2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:

装置③仅有一个反应条件与①不同,该条件为_______________ ,实验②平衡时H2的转化率为_____________ ;
(2)肼是一种具有强还原性的无色油状液体,可用作燃料。
①在火箭推进器中装有胼(N2H4)和液态H2O2,已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量。该反应的热化学方程式为_____________________________________________________ 。
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。已知肼在101kPa、25℃条件下的燃烧热为624kJ·mol-1,如果此燃料电池的能量转化率为50%,当消耗空气2.24L(已折算为标准状况下体积)时,则此电池产生的电能约为_________ kJ。(假设空气中氧气的体积含量为20%,产物为液态水)
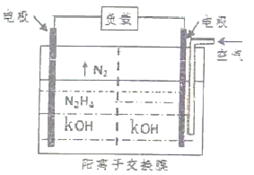
(3)肼又称“联氨”,为二元弱碱,在水中的电离方程式与氨相似,肼第一步电离反应的平衡常数值为____________ .(已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)
N2H5+的K=8.7×107;KW=1.0×10-14)
(1)工业中常用以下反应合成氨:N2+3H2
 2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
装置③仅有一个反应条件与①不同,该条件为
(2)肼是一种具有强还原性的无色油状液体,可用作燃料。
①在火箭推进器中装有胼(N2H4)和液态H2O2,已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量。该反应的热化学方程式为
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。已知肼在101kPa、25℃条件下的燃烧热为624kJ·mol-1,如果此燃料电池的能量转化率为50%,当消耗空气2.24L(已折算为标准状况下体积)时,则此电池产生的电能约为

(3)肼又称“联氨”,为二元弱碱,在水中的电离方程式与氨相似,肼第一步电离反应的平衡常数值为
 N2H5+的K=8.7×107;KW=1.0×10-14)
N2H5+的K=8.7×107;KW=1.0×10-14)
您最近一年使用:0次



