名校
1 . 氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______ kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________ 。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________ ;为抑制肼的分解,可采取的合理措施有________ (任写一种)。
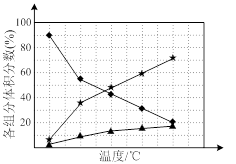
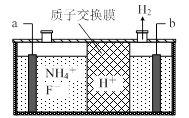
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________ 。
② a电极为电解池的_____________ (填“阴”或“阳”)极,写出该电极的电极反应式:________________ ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________ 。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:


图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为
② a电极为电解池的
您最近一年使用:0次
2016-01-21更新
|
369次组卷
|
3卷引用:2015届江苏省南通、扬州、连云港高三第二次调研测试化学试卷
解题方法
2 . 碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1
反应Ⅱ:HI(aq)= H2(g)+
H2(g)+ I2(aq) ΔH2
I2(aq) ΔH2
反应Ⅲ:2H2SO4(aq)=2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)=H2SO4(aq)+H2(g)的ΔH=___ (用ΔH1、ΔH2表示)。
②分析上述反应,下列判断正确的是___
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2同时产生1molH2
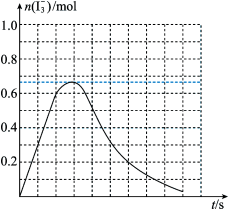
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq) I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是___ 。
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:___ 。
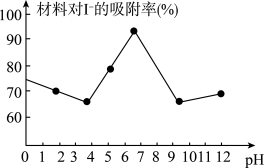
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附___ (填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s) AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=___ [用c(Cl-)、Ksp(AgCl)和Ksq(AgI)表示]。该方法去除碘离子的原理是___ 。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1
反应Ⅱ:HI(aq)=
 H2(g)+
H2(g)+ I2(aq) ΔH2
I2(aq) ΔH2反应Ⅲ:2H2SO4(aq)=2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)=H2SO4(aq)+H2(g)的ΔH=
②分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2同时产生1molH2
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)
 I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附

(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
您最近一年使用:0次
3 . 肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
①工业上合成氨的反应N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=____ kJ·mol-1
②合成氨反应的活化能很大,能加快反应速率但不改变反应活化能的方法是____ 。
(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出肼作火箭燃料时反应的热化学方程式____ 。
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;
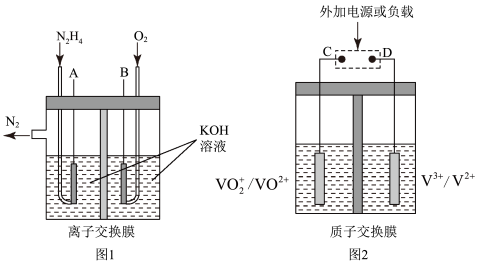
①肼-空气燃料电池的负极反应式为____ 。
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式____ 。
(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是____ 。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
| 化学键 | H—H | N≡N | N—H |
| 键能/kJ·molˉ1 | a | b | c |
 2NH3(g) ΔH=
2NH3(g) ΔH=②合成氨反应的活化能很大,能加快反应速率但不改变反应活化能的方法是
(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出肼作火箭燃料时反应的热化学方程式
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;

①肼-空气燃料电池的负极反应式为
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式
(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是
您最近一年使用:0次
名校
4 . 燃煤烟气中含有大量的二氧化硫,进行脱硫处理可以减少环境污染,变废为宝。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_______ 。
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=_______ 。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为______ g。
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式______ ;若用甲烷燃料电池作电源(电解质溶液呈碱性),负极的反应式为_______ 。

(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式

您最近一年使用:0次
2019-11-20更新
|
122次组卷
|
3卷引用:江苏省南通市2019~2020学年高二上学期期中质量调研化学(选修)试题
5 . 如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是

MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g),ΔH=-117kJ·mol-1

MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g),ΔH=-117kJ·mol-1
| A.由MgCl2制取Mg是放热过程 |
| B.热稳定性:MgI2<MgBr2<MgCl2<MgF2 |
| C.常温下氧化性:F2<Cl2<Br2<I2 |
| D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g),ΔH=-117kJ·mol-1, |
您最近一年使用:0次
6 . 黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义。
(1)工业上煅烧黄铁矿可制取SO2。已知下列热化学方程式
4FeS2(s)+l1O2(g)=2Fe2O3(s)+8SO2(g)△H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
则 4Fe(s)+3O2(g)=2Fe2O3(s) △H=_______ kJ/mol
(2)—种酸性条件下催化氧化黄铁矿的物质转化关系如图I所示。

①写出如图中Fe3+与FeS2反应的离子方程式:_____________________ 。
②硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是______________ 。
(3)控制Fe2+的浓度,溶液体积和通入O2的速率一定,图II所示为改变其他条件时Fe2+被氧化的转化率,随时间的变化。
① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反应则转移电子的数目为______ mol。
② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。解释图II中该条件下能进一步提高单位时间内Fe2+转化率的原因:______________ 。
(4)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生粒子的含量与时间、电压(U)的关系如图III所示。
① 写出t1至t2间FeS2所发生的电极反应式:__________ 。
②当电压的值介于3U~4U之间,FeS2放电所得主要粒子为___________ 。
(1)工业上煅烧黄铁矿可制取SO2。已知下列热化学方程式
4FeS2(s)+l1O2(g)=2Fe2O3(s)+8SO2(g)△H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
则 4Fe(s)+3O2(g)=2Fe2O3(s) △H=
(2)—种酸性条件下催化氧化黄铁矿的物质转化关系如图I所示。

①写出如图中Fe3+与FeS2反应的离子方程式:
②硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是
(3)控制Fe2+的浓度,溶液体积和通入O2的速率一定,图II所示为改变其他条件时Fe2+被氧化的转化率,随时间的变化。
① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反应则转移电子的数目为
② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。解释图II中该条件下能进一步提高单位时间内Fe2+转化率的原因:
(4)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生粒子的含量与时间、电压(U)的关系如图III所示。
① 写出t1至t2间FeS2所发生的电极反应式:
②当电压的值介于3U~4U之间,FeS2放电所得主要粒子为
您最近一年使用:0次
2017-05-06更新
|
485次组卷
|
2卷引用:江苏省南通、扬州、泰州市2017届高三第三次模拟考试化学试题



