名校
1 .  是环境污染物。
是环境污染物。
(1)消除 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为_______ 。
(2)以氨气为原料脱硝除去 。
。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知: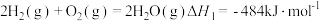
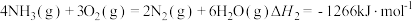
则 的
的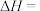
_______  。
。
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为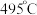 时,
时, 的温度为
的温度为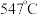 ,而
,而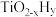 的温度为
的温度为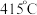 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是_______ 。 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。_______ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为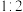 ,则反应的化学方程式为
,则反应的化学方程式为_______ 。
(4)以 为原料脱硝除去
为原料脱硝除去 。
。
烟气中的 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为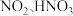 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示:_______ 。
②化学式为 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
 是环境污染物。
是环境污染物。(1)消除
 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为(2)以氨气为原料脱硝除去
 。
。①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
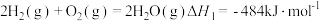
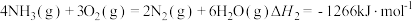
则
 的
的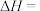
 。
。②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为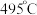 时,
时, 的温度为
的温度为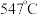 ,而
,而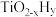 的温度为
的温度为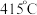 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是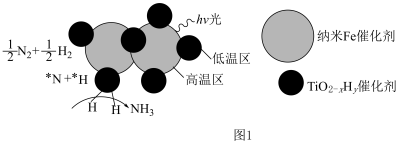
 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。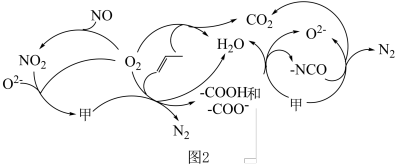
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为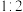 ,则反应的化学方程式为
,则反应的化学方程式为(4)以
 为原料脱硝除去
为原料脱硝除去 。
。烟气中的
 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为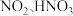 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示: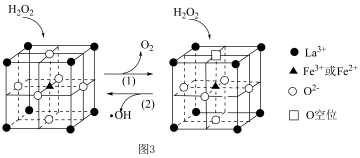
②化学式为
 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
2 . 氨及其盐都是重要的化工原料,有广泛的用途。
(1)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。
2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。

①比较:p1____ p2(填“>”、“<”或“=”,下同)。
②当压强为p2时,在y点的v(正)____ v(逆)。
(2)研发氨燃料电池是当前科研的一个热点,如图所示。
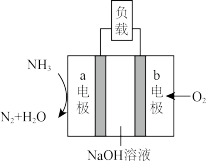
①该电池负极的电极反应式为____ 。
②当有6mol发生转移时,消耗NH3的质量为____ 。
③若该电池用于金属表面镀银,____ (填“a”或“b”)电极连接镀件(待镀金属)。
(3)传统工业以CO2与NH3为原料合成尿素的反应在进行时
分为如下两步:
第一步:2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ•mol-1
第二步:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ•mol-1
①写出以CO2与NH3为原料合成尿素的热化学方程式____ 。
②为模拟工业合成尿素,某同学向体积为0.5L密闭容器中投入4molNH3和1molCO2,测得反应中各组分物质的量随时间的变化如图所示。反应进行到____ min时到达平衡。

(1)已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。
2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。
①比较:p1
②当压强为p2时,在y点的v(正)
(2)研发氨燃料电池是当前科研的一个热点,如图所示。

①该电池负极的电极反应式为
②当有6mol发生转移时,消耗NH3的质量为
③若该电池用于金属表面镀银,
(3)传统工业以CO2与NH3为原料合成尿素的反应在进行时
分为如下两步:
第一步:2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ•mol-1
第二步:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ•mol-1
①写出以CO2与NH3为原料合成尿素的热化学方程式
②为模拟工业合成尿素,某同学向体积为0.5L密闭容器中投入4molNH3和1molCO2,测得反应中各组分物质的量随时间的变化如图所示。反应进行到

您最近一年使用:0次
3 . 铅及其化合物在工业生产及日常生活中有非常广泛的用途。
(1)工业上可用PbS与PbSO4反应制备粗铅,反应为PbS+PbSO4 2Pb+2SO2↑。
2Pb+2SO2↑。
已知下列反应的热化学方程式:
Ⅰ.2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
Ⅱ.PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2= b kJ·mol-1
Ⅲ.PbS(s)+2O2(g)=PbSO4(s) ΔH3=c kJ·mol-1
①反应PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=_______ (用含a,b,c的代数式表示)。
②反应Ⅲ在一定条件下能自发进行的原因是_______ 。
(2)工业上可通过电解将粗铅精炼,电解液为H2SiF6和PbSiF6的混合溶液。电解时,当c(H2SiF6)过大时,铅产率减小的原因可能是_______ 。(已知:H2SiF6和PbSiF6均为易溶子水的强电解质。)
(3)铅易造成环境污染,水溶液中铅的存在形态与pH关系如图1所示。
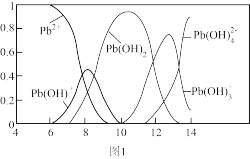
①常温下,向pH=10的含Pb(II)废水滴加氨水至pH=11时,所发生反应的离子方程式为_______ 。
②某工业含有Pb2+的废水,经处理后c(Pb2+)=2×l0-6 mol·L-1,达到排放标准,此溶液的pH不低于_______ 。(已知室温下:Ksp[Pb(OH)2]=2×10-l5)
(4)我国科学家在一种铅的卤化物光电材料中引入稀土铕(Eu3+)盐,可以提升太阳能电池的效率和使用寿命,其作用原理如图2所示。该过程可描述为_______ 。

(1)工业上可用PbS与PbSO4反应制备粗铅,反应为PbS+PbSO4
 2Pb+2SO2↑。
2Pb+2SO2↑。已知下列反应的热化学方程式:
Ⅰ.2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
Ⅱ.PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2= b kJ·mol-1
Ⅲ.PbS(s)+2O2(g)=PbSO4(s) ΔH3=c kJ·mol-1
①反应PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=
②反应Ⅲ在一定条件下能自发进行的原因是
(2)工业上可通过电解将粗铅精炼,电解液为H2SiF6和PbSiF6的混合溶液。电解时,当c(H2SiF6)过大时,铅产率减小的原因可能是
(3)铅易造成环境污染,水溶液中铅的存在形态与pH关系如图1所示。

①常温下,向pH=10的含Pb(II)废水滴加氨水至pH=11时,所发生反应的离子方程式为
②某工业含有Pb2+的废水,经处理后c(Pb2+)=2×l0-6 mol·L-1,达到排放标准,此溶液的pH不低于
(4)我国科学家在一种铅的卤化物光电材料中引入稀土铕(Eu3+)盐,可以提升太阳能电池的效率和使用寿命,其作用原理如图2所示。该过程可描述为

您最近一年使用:0次
解题方法
4 . 金属镁是一种活泼的常见金属,用途广泛。在25℃,101kPa条件下。有关物质的能量如下表所示(X2表示任意卤素单质):
回答下列问题:
(1)镁与卤素单质的反应属于_______ (“放热”或“吸热”)反应。
(2)镁与卤素单质反应的生成物中,热稳定性最差的是_________ 。
(3)镁与液溴反应的热化学方程式为________ 。
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=_______ kJ·mol-1。
物质 | Mg | X2 | MgF2 | MgCl2 | MgBr2 | MgI2 |
能量/kJ‧mol-1 | 0 | 0 | -1124 | -641.3 | -524 | -364 |
回答下列问题:
(1)镁与卤素单质的反应属于
(2)镁与卤素单质反应的生成物中,热稳定性最差的是
(3)镁与液溴反应的热化学方程式为
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=
您最近一年使用:0次
2020-07-31更新
|
65次组卷
|
2卷引用:江苏省南通市海安县2020-2021学年高二上学期第一次月考化学试题
5 . 锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=﹣930kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJ•mol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJ•mol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=____ kJ•mol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___ 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为:T1___ T2(填“>”、“<”或“=”);
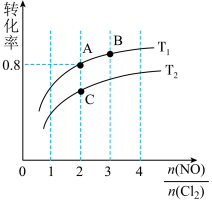
②图中纵坐标为物质___ 的转化率;
③图中A、B、C三点对应的NOCl体积分数最大的是____ (填“A”、“B”、或“C”);
④若容器容积为2L,则B点的平衡常数的值为____ 。
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJ•mol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJ•mol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g)
 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:①图中T1、T2的关系为:T1

②图中纵坐标为物质
③图中A、B、C三点对应的NOCl体积分数最大的是
④若容器容积为2L,则B点的平衡常数的值为
您最近一年使用:0次
名校
6 . 锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H3=198 kJ·mol-1
H3=198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的 H4=
H4=________ kJ·mol-1。反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
该反应在一定条件下能自发进行的原因是_______ ;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是________ 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。

①写出700℃~980℃时发生反应的化学方程式:______________________________________________ , 物质B的化学式是________________ 。
② 硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式:_____________________________________________ ;循环II中电解过程阳极反应式是_________________________________________ 。

2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g)
 H1=-930 kJ·mol-1
H1=-930 kJ·mol-12C(s) + O2(g) = 2CO(g)
 H2=-221 kJ·mol-1
H2=-221 kJ·mol-1ZnO(s) + CO(g) = Zn(g) + CO2(g)
 H3=198 kJ·mol-1
H3=198 kJ·mol-1(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的
 H4=
H4=
该反应在一定条件下能自发进行的原因是
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。

①写出700℃~980℃时发生反应的化学方程式:
② 硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式:

您最近一年使用:0次
2018-01-15更新
|
232次组卷
|
2卷引用:2016届江苏省南通市高三下学期第一次调研测试化学试卷
解题方法
7 . 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=a kJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=_____ kJ·mol-1。
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是_______ 。
⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数 K=____ 。 [已知Ksp(CaCO3)=2.9×10-9,Ksp(CaSO4)=9.1×10-6 ]
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________ 。
②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:_____________ 。
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:___________ 。
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=a kJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是

⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数 K=
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为

②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:
您最近一年使用:0次
2017-03-28更新
|
156次组卷
|
3卷引用:2016届江苏省南通市高三下学期第三次教学调研化学试卷
8 . I.还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g) ΔH=_____ kJ·mol-1。
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。
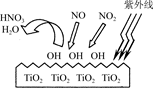
写出OH与NO反应的化学方程式:_____________ 。
Ⅱ.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有
CH3OH(g),则可用来判断该反应达到平衡状态的标志有___ (填字母)。
A.H2百分含量保持不变
B.容器中气体的压强保持不变
C.容器中混合气体的密度保持不变
D.2v(H2)正= v(CH3OH )逆
(4)CO(g)+2H2(g) CH3OH(g) 其平衡常数表达式为K=
CH3OH(g) 其平衡常数表达式为K=___________ 。该反应的平衡常数K 随温度T 的变化如图所示,

则该反应的 △H___ 0。(填“>”、“<”或“=”)。已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将___ (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
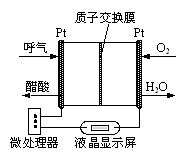
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为_________ 。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g) ΔH=
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。

写出OH与NO反应的化学方程式:
Ⅱ.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g)
 CH3OH(g),则可用来判断该反应达到平衡状态的标志有
CH3OH(g),则可用来判断该反应达到平衡状态的标志有A.H2百分含量保持不变
B.容器中气体的压强保持不变
C.容器中混合气体的密度保持不变
D.2v(H2)正= v(CH3OH )逆
(4)CO(g)+2H2(g)
 CH3OH(g) 其平衡常数表达式为K=
CH3OH(g) 其平衡常数表达式为K=
则该反应的 △H
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为

您最近一年使用:0次



