燃煤烟气中含有大量的二氧化硫,进行脱硫处理可以减少环境污染,变废为宝。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_______ 。
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=_______ 。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为______ g。
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式______ ;若用甲烷燃料电池作电源(电解质溶液呈碱性),负极的反应式为_______ 。

(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式

更新时间:2019-11-20 15:33:55
|
相似题推荐
【推荐1】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1 857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
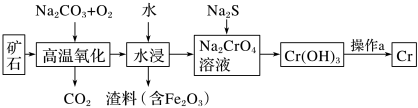
①Fe(CrO2)2中各元素化合价均为整数,则铬为__ 价。
②高温氧化时反应的化学方程式为________ 。
③操作a由两种均发生了化学反应的过程构成,其内容分别是___ 、铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式______ 、______ 。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出CrO 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:_______ 。
②若处理含1 mol CrO (不考虑其他含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为_______ 。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

①Fe(CrO2)2中各元素化合价均为整数,则铬为
②高温氧化时反应的化学方程式为
③操作a由两种均发生了化学反应的过程构成,其内容分别是
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO
 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出CrO
 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:②若处理含1 mol CrO
 (不考虑其他含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3 + H2SO4= Na2SO4 + SO2+ S↓ + H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
①表中,a为________________________ ,b为________________ 。
②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为_________________________ 。
(2)硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O + 4S2O32- + H2O 2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因
2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
(3)工业上常用空气催化氧化法除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4·2H2O),其中的物质转化过程如下图所示。

①过程I、Ⅱ中,起催化剂作用的物质是_______________ 。
②过程Ⅱ中,反应的离子方程式为_________ 。
③根据物质转化过程,若将10 L上清液中的S2-转化为SO42-(S2-浓度为320 mg/L),理论上共需要标准状况下的O2的体积为___________ L。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3 + H2SO4= Na2SO4 + SO2+ S↓ + H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
| 实验 序号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
| 浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
| I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
| Ⅱ | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
| Ⅲ | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为
②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为
(2)硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O + 4S2O32- + H2O
 2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因
2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因(3)工业上常用空气催化氧化法除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4·2H2O),其中的物质转化过程如下图所示。

①过程I、Ⅱ中,起催化剂作用的物质是
②过程Ⅱ中,反应的离子方程式为
③根据物质转化过程,若将10 L上清液中的S2-转化为SO42-(S2-浓度为320 mg/L),理论上共需要标准状况下的O2的体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】三氧化二砷,俗称砒霜,分子式 ,是最古老的毒物之一,某含砷元素(
,是最古老的毒物之一,某含砷元素( )的工业废水经如图所示流程转化为粗
)的工业废水经如图所示流程转化为粗 。
。
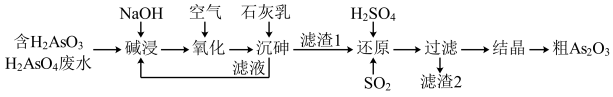
(1)“碱浸”时发生的反应有: ;
; 。其目的是将废水中的
。其目的是将废水中的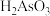 和
和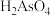 转化为盐,其中
转化为盐,其中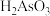 的化学名称为
的化学名称为___________________ 。
(2)“通入空气氧化”时,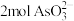 转化为
转化为 时反应转移的电子数为
时反应转移的电子数为______ NA。
(3)“沉砷”是将元素转化为 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:
a.
b.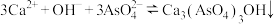
“沉砷”时加入少量稀盐酸,________ (填“有利于”或“不利于”)砷元素转化为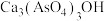 沉淀,简述原因:
沉淀,简述原因:__________________________________ 。
(4)“还原”过程中 转化为
转化为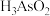 ,反应的化学方程式是
,反应的化学方程式是_________________________ 。
(5)“还原”后过滤所得滤渣2为__________ (填化学式), 在低温下微溶于水,加热溶于水后生成
在低温下微溶于水,加热溶于水后生成 溶液,将硫化氢气体通入
溶液,将硫化氢气体通入 ,溶液中制备
,溶液中制备 溶胶,写出制取
溶胶,写出制取 溶胶的化学方程式:
溶胶的化学方程式:_____________________________________ 。已知: 对其聚沉能力较强,
对其聚沉能力较强, 对其聚沉能力较弱,则
对其聚沉能力较弱,则 胶粒带
胶粒带__________ (填“正电荷”或“负电荷”)。
(6)确定物质中是否含有砒霜,常用马氏试砷法。其原理是在含砒霜的物质中加入 和稀
和稀 ,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:
,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:____________________ 。
 ,是最古老的毒物之一,某含砷元素(
,是最古老的毒物之一,某含砷元素( )的工业废水经如图所示流程转化为粗
)的工业废水经如图所示流程转化为粗 。
。
(1)“碱浸”时发生的反应有:
 ;
; 。其目的是将废水中的
。其目的是将废水中的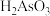 和
和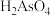 转化为盐,其中
转化为盐,其中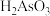 的化学名称为
的化学名称为(2)“通入空气氧化”时,
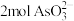 转化为
转化为 时反应转移的电子数为
时反应转移的电子数为(3)“沉砷”是将元素转化为
 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:a.

b.
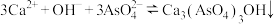
“沉砷”时加入少量稀盐酸,
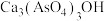 沉淀,简述原因:
沉淀,简述原因:(4)“还原”过程中
 转化为
转化为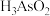 ,反应的化学方程式是
,反应的化学方程式是(5)“还原”后过滤所得滤渣2为
 在低温下微溶于水,加热溶于水后生成
在低温下微溶于水,加热溶于水后生成 溶液,将硫化氢气体通入
溶液,将硫化氢气体通入 ,溶液中制备
,溶液中制备 溶胶,写出制取
溶胶,写出制取 溶胶的化学方程式:
溶胶的化学方程式: 对其聚沉能力较强,
对其聚沉能力较强, 对其聚沉能力较弱,则
对其聚沉能力较弱,则 胶粒带
胶粒带(6)确定物质中是否含有砒霜,常用马氏试砷法。其原理是在含砒霜的物质中加入
 和稀
和稀 ,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:
,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__ C+__ K2Cr2O7+__ →__ CO2↑+__ K2SO4+__ Cr2(SO4)3+_ H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=-116 kJ⋅mol-1
CH3OH(g) △H1=-116 kJ⋅mol-1
①下列措施中有利于增大该反应的反应速率的是___ ;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+ O2(g)=CO2(g) △H2=-283 kJ⋅mol-1;
O2(g)=CO2(g) △H2=-283 kJ⋅mol-1;
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ⋅mol-1
O2(g)=H2O(g) △H3=-242 kJ⋅mol-1
则表示1 mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___ ;
③在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。

请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是______ ;
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___ 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___ 。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)
 CH3OH(g) △H1=-116 kJ⋅mol-1
CH3OH(g) △H1=-116 kJ⋅mol-1①下列措施中有利于增大该反应的反应速率的是
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+
 O2(g)=CO2(g) △H2=-283 kJ⋅mol-1;
O2(g)=CO2(g) △H2=-283 kJ⋅mol-1;H2(g)+
 O2(g)=H2O(g) △H3=-242 kJ⋅mol-1
O2(g)=H2O(g) △H3=-242 kJ⋅mol-1则表示1 mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
③在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。

请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)工业上利用甲酸的能量关系转换图如下:
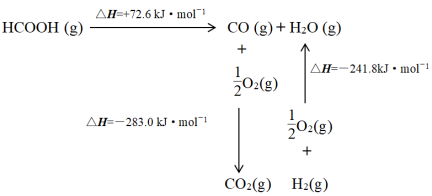
反应HCOOH(g) CO2 (g) + H2(g) 的焓变△H =
CO2 (g) + H2(g) 的焓变△H =__________________ kJ·mol-1。
(2)某科学小组研究不同压强条件对反应CO2(g) + H2(g) HCOOH(g) 的影响。t℃下,在一个容积可变的密闭容器中,充入一定量的CO2和H2,测得不同压强下,平衡时容器内气体的浓度如下表:
HCOOH(g) 的影响。t℃下,在一个容积可变的密闭容器中,充入一定量的CO2和H2,测得不同压强下,平衡时容器内气体的浓度如下表:
试回答以下问题:
①平衡时,实验1的正反应速率______ (填“>”、“<”或“=”)实验3的逆反应速率。
②由实验1的数据可计算t℃时,该反应的平衡常数K=________________ 。
③ a=___________ mol·L-1
(3)经研究发现采用电还原法也可将CO2转化为甲酸根,同时还能提高CO2的转换效率。其电解原理如图所示,下列叙述正确的是__________ 。

A.Sn极的电极方程式为CO2 + 2e﹣+ HCO3﹣=HCOO﹣+ CO32﹣
B.电解过程中K+向Pt极移动
C.Pt极发生还原反应并有气体逸出
D.电解过程中HCO3﹣浓度逐渐减小
(4)甲酸的用途之一是用于配制“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,能保持溶液pH相对稳定。(已知甲酸的电离平衡常数Ka=1.8×10-4)
①现将等浓度甲酸与甲酸钠溶液混合,配成0.1 mol·L-1的HCOOH-HCOONa溶液。用离子方程式表示将少量强碱加入HCOOH-HCOONa缓冲溶液中,pH变化不大的原因_______________ 。
②若用100mL 0.2mol·L-1HCOOH溶液配制pH为4的缓冲溶液,需加入_________ (答案保留一位小数)mL 0.2mol· L-1NaOH溶液。
(1)工业上利用甲酸的能量关系转换图如下:

反应HCOOH(g)
 CO2 (g) + H2(g) 的焓变△H =
CO2 (g) + H2(g) 的焓变△H =(2)某科学小组研究不同压强条件对反应CO2(g) + H2(g)
 HCOOH(g) 的影响。t℃下,在一个容积可变的密闭容器中,充入一定量的CO2和H2,测得不同压强下,平衡时容器内气体的浓度如下表:
HCOOH(g) 的影响。t℃下,在一个容积可变的密闭容器中,充入一定量的CO2和H2,测得不同压强下,平衡时容器内气体的浓度如下表:| 实验编号 | 反应压强 | 物质浓度(mol·L-1) | ||
| CO2 | H2 | HCOOH | ||
| 1 | p1 | 0.3 | 0.3 | 0.9 |
| 2 | p2 | a | a | 0.4 |
| 3 | p3 | 0.4 | 0.4 | b |
试回答以下问题:
①平衡时,实验1的正反应速率
②由实验1的数据可计算t℃时,该反应的平衡常数K=
③ a=
(3)经研究发现采用电还原法也可将CO2转化为甲酸根,同时还能提高CO2的转换效率。其电解原理如图所示,下列叙述正确的是

A.Sn极的电极方程式为CO2 + 2e﹣+ HCO3﹣=HCOO﹣+ CO32﹣
B.电解过程中K+向Pt极移动
C.Pt极发生还原反应并有气体逸出
D.电解过程中HCO3﹣浓度逐渐减小
(4)甲酸的用途之一是用于配制“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,能保持溶液pH相对稳定。(已知甲酸的电离平衡常数Ka=1.8×10-4)
①现将等浓度甲酸与甲酸钠溶液混合,配成0.1 mol·L-1的HCOOH-HCOONa溶液。用离子方程式表示将少量强碱加入HCOOH-HCOONa缓冲溶液中,pH变化不大的原因
②若用100mL 0.2mol·L-1HCOOH溶液配制pH为4的缓冲溶液,需加入
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】目前我国分别在治理大气污染和新能源使用上都取得长足的进步。
(1)在大气污染治理上,目前我国计划在“十二五”期间用甲烷还原氮氧化物(NOx),使其排放量减少10%。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为___________
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源。该反应为:CH4(g) + H2O(g) CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
①假设100 ℃时若按甲投料反应达到平衡所需的时间为5 min,则用甲烷表示该反应的平均反应速率为___________ 。
②在不改变其他外界条件下α1、α2、α3的相对大小顺序为:___________ 。
③欲提高CH4转化率且不改变该反应的平衡常数的方法是___________ (填字母序号)。
A.c(CH4)增大 B.分离出产品CH3OH
C.升高温度 D.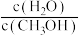 比值增大 E.容器体积缩小一半
比值增大 E.容器体积缩小一半
④下列图象对该反应表达正确的是:___________ 。
A. B.
B. C.
C. D.
D.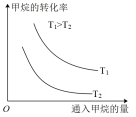
(1)在大气污染治理上,目前我国计划在“十二五”期间用甲烷还原氮氧化物(NOx),使其排放量减少10%。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源。该反应为:CH4(g) + H2O(g)
 CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(CH4)/ mol | 5 | 4 | 10 |
| n(H2O)/ mol | 10 | 8 | 10 | |
| CH4的平衡转化率 / % | α1=50% | α2 | α3 | |
②在不改变其他外界条件下α1、α2、α3的相对大小顺序为:
③欲提高CH4转化率且不改变该反应的平衡常数的方法是
A.c(CH4)增大 B.分离出产品CH3OH
C.升高温度 D.
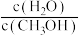 比值增大 E.容器体积缩小一半
比值增大 E.容器体积缩小一半④下列图象对该反应表达正确的是:
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
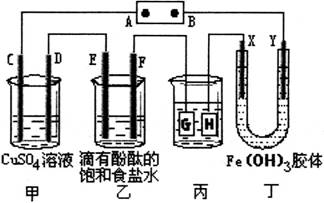
【推荐1】如下图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深。请回答:
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为__________。
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀。他测得溶液的pH=5,则此时溶液中c(Fe3+)=__________mol/L。(已知Ksp[Fe(OH)3]=1×10-36)。
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL。当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为:__________。
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为__________。
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀。他测得溶液的pH=5,则此时溶液中c(Fe3+)=__________mol/L。(已知Ksp[Fe(OH)3]=1×10-36)。
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL。当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为:__________。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学反应原理对化学反应的研究具有指导意义。
(1)目前城市机动车废气的排放已成为城市大气污染的重要来源。气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g)
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,可能的原因是___________ 。
②可用NH3催化还原NO消除污染,写出该反应的化学方程式___________ 。
(2)由金红石TiO2)制取单质Ti,涉及到的步骤为:
TiO2 TiCl4
TiCl4 Ti
Ti
已知:① C(s)+O2(g)=CO2(g); ∆H= -393.5 kJ·mol1
② 2CO(g)+O2(g)=2CO2(g); ∆H= -566 kJ·mol1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); ∆H=+141 kJ·mol1
则TiO2(s)+2Cl2(g)+2Cs)=TiCl4(s)+2CO(g)的∆H=___________ 。
(3)用Pt作电极,甲醇(CH3OH)-KOH(aq)-空气可制成甲醇燃料电池,电池负极电极反应式为___________ ,用该电池作电源、石墨作电极电解CuSO4溶液,电解过程中阳极电极反应式为___________ ,当电解池阴极增重3.84g时,理论上参加反应的甲醇质量___________ g。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:i.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.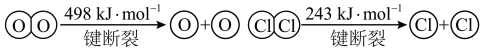
①写出该条件下,反应A的热化学反应方程式___________ 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为___________ kJ。
(1)目前城市机动车废气的排放已成为城市大气污染的重要来源。气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)
2NO(g)①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,可能的原因是
②可用NH3催化还原NO消除污染,写出该反应的化学方程式
(2)由金红石TiO2)制取单质Ti,涉及到的步骤为:
TiO2
 TiCl4
TiCl4 Ti
Ti已知:① C(s)+O2(g)=CO2(g); ∆H= -393.5 kJ·mol1
② 2CO(g)+O2(g)=2CO2(g); ∆H= -566 kJ·mol1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); ∆H=+141 kJ·mol1
则TiO2(s)+2Cl2(g)+2Cs)=TiCl4(s)+2CO(g)的∆H=
(3)用Pt作电极,甲醇(CH3OH)-KOH(aq)-空气可制成甲醇燃料电池,电池负极电极反应式为
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2
 2Cl2+2H2O
2Cl2+2H2O已知:i.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ii.
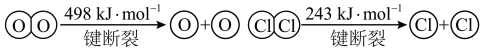
①写出该条件下,反应A的热化学反应方程式
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业上采用的一种污水处理方法如下:保持污水的pH在5.0 ~ 6.0之间,通过电解生成Fe(OH)3。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置示意图如图所示。
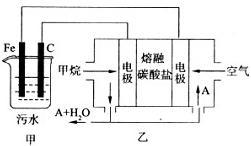
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时应向污水中加入适量的______
a.HCl b.CH3CH2OH c.Na2SO4 d. NaOH
(2)电解池阳极实际发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是I.______ ;
II.______
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。正极的电极反应式______ ;
(4)已知燃料电池中有1.6 g CH4参加反应,则C电极理论上生成气体______ L (标准状况)。
(5)若将装置中的甲部分换为如图所示的装置。

电解至CuSO4完全反应,继续电解后加入______ 可能恢复至原浓度。

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时应向污水中加入适量的
a.HCl b.CH3CH2OH c.Na2SO4 d. NaOH
(2)电解池阳极实际发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是I.
II.
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。正极的电极反应式
(4)已知燃料电池中有1.6 g CH4参加反应,则C电极理论上生成气体
(5)若将装置中的甲部分换为如图所示的装置。

电解至CuSO4完全反应,继续电解后加入
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某课外活动小组的同学在学习了电化学相关知识后,用如图装置进行实验,请回答下列问题:

(1)实验一:将开关K与a连接,则乙为________ 极,电极反应式为____________________ 。
(2)实验二:开关K与b连接,则乙________ 极,总反应的离子方程式为_____________________ 。
(3)对于实验二,下列说法正确的是________ (填字母编号)。
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.相同条件下,电解一段时间后,甲电极和乙电极上收集到的气体体积一定相等
(4)该研究小组的同学在进行实验二结束的溶液中滴加酚酞溶液,发现________ (填“甲”或“乙”)极附近变红。若标准状况下乙电极产生22.4mL气体,剩余溶液体积为200mL,则该溶液的pH为_____ 。

(1)实验一:将开关K与a连接,则乙为
(2)实验二:开关K与b连接,则乙
(3)对于实验二,下列说法正确的是
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.相同条件下,电解一段时间后,甲电极和乙电极上收集到的气体体积一定相等
(4)该研究小组的同学在进行实验二结束的溶液中滴加酚酞溶液,发现
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】按要求回答下列问题:
(1)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:_______ 。
(2)电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:_______ 。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是:_______ 。
(4)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为:_______ 。
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为:_______ 。
(1)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:
(2)电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是:
(4)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为:
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 减排能有效降低温室效应,同时,
减排能有效降低温室效应,同时, 也是一种重要的资源,因此研究
也是一种重要的资源,因此研究 捕集与转化对实现“碳中和”目标具有重要意义而备受关注。
捕集与转化对实现“碳中和”目标具有重要意义而备受关注。
(1)某研究机构成功合成了氮掺杂多孔有机聚合物DLU-1吸附剂,用于烟道气(主要是 和
和 )和天然气中
)和天然气中 的捕集。为考查样品对单组分气体的吸附性能,测定在1bar,273和298K下的单组分气体吸附等温线如图,请阐述DLU-1吸附剂能做捕获剂的理由:
的捕集。为考查样品对单组分气体的吸附性能,测定在1bar,273和298K下的单组分气体吸附等温线如图,请阐述DLU-1吸附剂能做捕获剂的理由:_____________ 。 和
和 反应合成二甲醚,
反应合成二甲醚,
 )
)
①恒温恒容下,充入等物质的量的 和
和 充分反应,以下叙述能说明该反应达到平衡状态的
充分反应,以下叙述能说明该反应达到平衡状态的_____________ (填序号)。
A. 的物质的量分数保持不变
的物质的量分数保持不变
B.容器中混合气体的密度保持不变
C.容器中混合气体的平均摩尔质量保持不变
D.断裂 键的同时断裂
键的同时断裂 键
键
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时, 的平衡转化率如图所示,则
的平衡转化率如图所示,则
_____________  (填“>”或“<”)。
(填“>”或“<”)。 温度下,将
温度下,将 和
和 充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率
充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率
_____________ 。
(3)工业上可以利用二氧化碳合成甲醇,已知
①
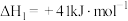
②

a.若③ 正反应的活化能为
正反应的活化能为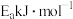 ,则逆反应的活化能为
,则逆反应的活化能为_____________  (用含Ea的式子表示)
(用含Ea的式子表示)
b.某一刚性容器中充入 和
和 ,起始压强为
,起始压强为 ,在催化剂存在条件下发生上述三个反应,测得温度与平衡转化率、产物选择性的关系如图所示。已知:选择性
,在催化剂存在条件下发生上述三个反应,测得温度与平衡转化率、产物选择性的关系如图所示。已知:选择性 。240℃平衡时,反应③的压强平衡常数
。240℃平衡时,反应③的压强平衡常数 为
为_____________ 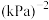 (用含p的式子列出计算式,不用化简)
(用含p的式子列出计算式,不用化简) 为原料,电解法制取乙烯、乙烷的装置如图,生成乙烯的电极反应式为:
为原料,电解法制取乙烯、乙烷的装置如图,生成乙烯的电极反应式为:_____________ .
 减排能有效降低温室效应,同时,
减排能有效降低温室效应,同时, 也是一种重要的资源,因此研究
也是一种重要的资源,因此研究 捕集与转化对实现“碳中和”目标具有重要意义而备受关注。
捕集与转化对实现“碳中和”目标具有重要意义而备受关注。(1)某研究机构成功合成了氮掺杂多孔有机聚合物DLU-1吸附剂,用于烟道气(主要是
 和
和 )和天然气中
)和天然气中 的捕集。为考查样品对单组分气体的吸附性能,测定在1bar,273和298K下的单组分气体吸附等温线如图,请阐述DLU-1吸附剂能做捕获剂的理由:
的捕集。为考查样品对单组分气体的吸附性能,测定在1bar,273和298K下的单组分气体吸附等温线如图,请阐述DLU-1吸附剂能做捕获剂的理由:
 和
和 反应合成二甲醚,
反应合成二甲醚,
 )
)①恒温恒容下,充入等物质的量的
 和
和 充分反应,以下叙述能说明该反应达到平衡状态的
充分反应,以下叙述能说明该反应达到平衡状态的A.
 的物质的量分数保持不变
的物质的量分数保持不变B.容器中混合气体的密度保持不变
C.容器中混合气体的平均摩尔质量保持不变
D.断裂
 键的同时断裂
键的同时断裂 键
键②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,
 的平衡转化率如图所示,则
的平衡转化率如图所示,则
 (填“>”或“<”)。
(填“>”或“<”)。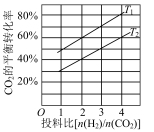
 温度下,将
温度下,将 和
和 充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率
充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率
(3)工业上可以利用二氧化碳合成甲醇,已知
①

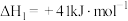
②


a.若③
 正反应的活化能为
正反应的活化能为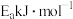 ,则逆反应的活化能为
,则逆反应的活化能为 (用含Ea的式子表示)
(用含Ea的式子表示)b.某一刚性容器中充入
 和
和 ,起始压强为
,起始压强为 ,在催化剂存在条件下发生上述三个反应,测得温度与平衡转化率、产物选择性的关系如图所示。已知:选择性
,在催化剂存在条件下发生上述三个反应,测得温度与平衡转化率、产物选择性的关系如图所示。已知:选择性 。240℃平衡时,反应③的压强平衡常数
。240℃平衡时,反应③的压强平衡常数 为
为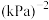 (用含p的式子列出计算式,不用化简)
(用含p的式子列出计算式,不用化简)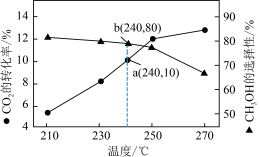
 为原料,电解法制取乙烯、乙烷的装置如图,生成乙烯的电极反应式为:
为原料,电解法制取乙烯、乙烷的装置如图,生成乙烯的电极反应式为: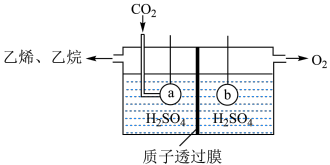
您最近一年使用:0次



