欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__ C+__ K2Cr2O7+__ →__ CO2↑+__ K2SO4+__ Cr2(SO4)3+_ H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=-116 kJ⋅mol-1
CH3OH(g) △H1=-116 kJ⋅mol-1
①下列措施中有利于增大该反应的反应速率的是___ ;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+ O2(g)=CO2(g) △H2=-283 kJ⋅mol-1;
O2(g)=CO2(g) △H2=-283 kJ⋅mol-1;
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ⋅mol-1
O2(g)=H2O(g) △H3=-242 kJ⋅mol-1
则表示1 mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___ ;
③在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。

请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是______ ;
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___ 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___ 。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)
 CH3OH(g) △H1=-116 kJ⋅mol-1
CH3OH(g) △H1=-116 kJ⋅mol-1①下列措施中有利于增大该反应的反应速率的是
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+
 O2(g)=CO2(g) △H2=-283 kJ⋅mol-1;
O2(g)=CO2(g) △H2=-283 kJ⋅mol-1;H2(g)+
 O2(g)=H2O(g) △H3=-242 kJ⋅mol-1
O2(g)=H2O(g) △H3=-242 kJ⋅mol-1则表示1 mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
③在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。

请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
更新时间:2020-02-13 17:42:58
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】SO2是高中化学重点学习的气体,是常见的大气污染物,同时也是重要的工业原料,探究其性质和转化具有重要意义。请回答下列问题。
Ⅰ.如图是实验室制取SO2并验证SO2某些性质的装置图:
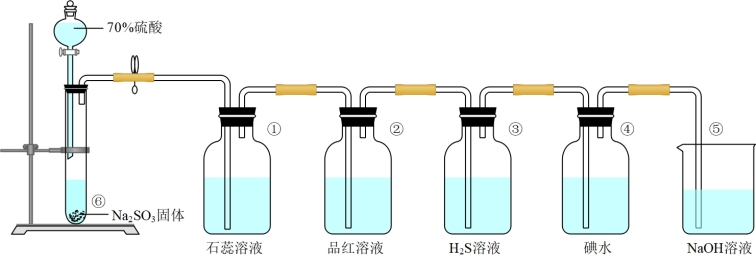
(1)⑥中发生反应的化学方程式为_______ 。
(2)①、②、③三个装置分别先后验证了SO2的哪些性质_______(填字母)。
(3)⑤中发生反应的离子方程式为_______ 。
Ⅱ.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
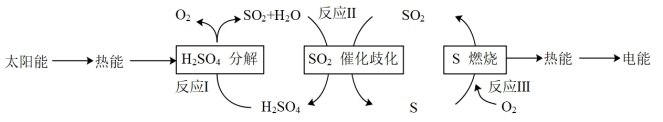
(4)反应Ⅱ的化学方程式:_______ 。
(5)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整_______ 。
i.SO2 + 4I- + 4H+=S↓+ 2I2 + 2H2O
ii.I2 + 2H2O + _______=_______ + _______+ 2I-
Ⅰ.如图是实验室制取SO2并验证SO2某些性质的装置图:

(1)⑥中发生反应的化学方程式为
(2)①、②、③三个装置分别先后验证了SO2的哪些性质_______(填字母)。
| A.酸性、吸附性、还原性 | B.酸性、漂白性、氧化性 |
| C.漂白性、漂白性、氧化性 | D.漂白性、酸性、还原性 |
Ⅱ.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(4)反应Ⅱ的化学方程式:
(5)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整
i.SO2 + 4I- + 4H+=S↓+ 2I2 + 2H2O
ii.I2 + 2H2O + _______=_______ + _______+ 2I-
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】金属钛(Ti)广泛应用于航空、军工、医疗等领域。以钛铁矿(主要含有FeTiO3及少量SiO2、FeO、Fe2O3、CaO)制备金属Ti的工艺流程如下:
(1)“酸浸”前钛铁矿需要粉碎研磨,其目的是_______ 。
(2)FeTiO3中Ti的化合价为_______ ,“滤渣”中主要含有SiO2和_______ (填化学式)。
(3)“酸浸”中发生主要反应的化学方程式为_______ 。
(4)试剂X为_______ (填化学式),其作用是_______ 。
(5)“高温冶炼”过程需在氩气气氛中进行,其原因是_______ 。
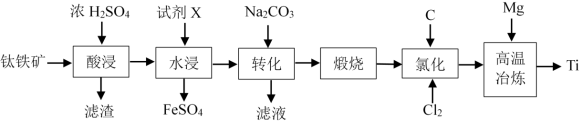
(1)“酸浸”前钛铁矿需要粉碎研磨,其目的是
(2)FeTiO3中Ti的化合价为
(3)“酸浸”中发生主要反应的化学方程式为
(4)试剂X为
(5)“高温冶炼”过程需在氩气气氛中进行,其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】太阳能光伏产业蓬勃发展,推动了高纯硅的生产和应用。工业上以硅石 为原料制备高纯硅的工业流程如图所示。
为原料制备高纯硅的工业流程如图所示。
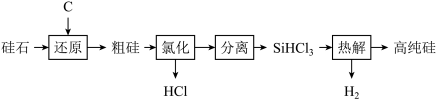
已知: 是常温下易挥发、遇水迅速生成其他物质的无色液体。
是常温下易挥发、遇水迅速生成其他物质的无色液体。
(1)Si在元素周期表中的位置是_______ 。
(2)“还原”需在高温条件下进行,该反应的化学方程式是_______ 。
(3)“氯化”时的还原产物是_______ (填化学式)。
(4)“氯化”、“分离”和“热解”的过程必须在无水、无氧条件下进行,理由是_______ 。
(5)该流程中能循环利用的物质是_______ (填两种)。
(6)高纯硅中常含有微量杂质,比如铁,对其进行测定的方法如下。
准确称取0.300g高纯硅样品用氢氟酸和稀硝酸溶解处理,配成100mL溶液,用羟胺 ,难电离)将
,难电离)将 还原为
还原为 后,加入邻菲啰啉形成橘红色络合物,再利用吸光度法测得吸光度为0.5(吸光度与
后,加入邻菲啰啉形成橘红色络合物,再利用吸光度法测得吸光度为0.5(吸光度与 浓度的对应关系如图)。
浓度的对应关系如图)。

①氢氟酸不能用玻璃试剂瓶保存的原因是_______ 。
②酸性条件下,羟胺与 反应生成无污染气体的反应的离子方程式为
反应生成无污染气体的反应的离子方程式为_______ 。
③高纯硅样品中铁的质量为_______ 。
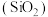 为原料制备高纯硅的工业流程如图所示。
为原料制备高纯硅的工业流程如图所示。
已知:
 是常温下易挥发、遇水迅速生成其他物质的无色液体。
是常温下易挥发、遇水迅速生成其他物质的无色液体。(1)Si在元素周期表中的位置是
(2)“还原”需在高温条件下进行,该反应的化学方程式是
(3)“氯化”时的还原产物是
(4)“氯化”、“分离”和“热解”的过程必须在无水、无氧条件下进行,理由是
(5)该流程中能循环利用的物质是
(6)高纯硅中常含有微量杂质,比如铁,对其进行测定的方法如下。
准确称取0.300g高纯硅样品用氢氟酸和稀硝酸溶解处理,配成100mL溶液,用羟胺
 ,难电离)将
,难电离)将 还原为
还原为 后,加入邻菲啰啉形成橘红色络合物,再利用吸光度法测得吸光度为0.5(吸光度与
后,加入邻菲啰啉形成橘红色络合物,再利用吸光度法测得吸光度为0.5(吸光度与 浓度的对应关系如图)。
浓度的对应关系如图)。
①氢氟酸不能用玻璃试剂瓶保存的原因是
②酸性条件下,羟胺与
 反应生成无污染气体的反应的离子方程式为
反应生成无污染气体的反应的离子方程式为③高纯硅样品中铁的质量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氨是一种重要的化工原料,工业合成氨对农业、化工和国防意义重大。合成氨反应为: N2(g) +
N2(g) + H2(g)⇌NH3(g),回答下列问题:
H2(g)⇌NH3(g),回答下列问题:
(1)化学键键能数据如下:
上述反应的△H=____________ ;若正反应的活化能为Ea正(kJ/mol'),则逆反应的活化能Ea逆= kJ/mol (用含Ea正的代数式表示)。
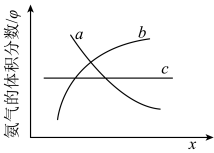
(2)在合成氨的反应中,外界条件会对平衡发生移动产生影响。如图表示随外界条件改变,氨气的体积分数(φ)的变化趋势。若横坐标x表示压强,则变化趋势正确的是__________ , (填曲线字母标号,下同);若x为温度,则变化趋势正确的是__________ 。
(3) p(N2)、p(H2)、p( NH3)分别代表N2、H2、NH3的分压,上述反应的压力平衡常数表达式Kp=_________ (用平衡时的分压代替平衡时的浓度表示);已知:一定条件下,V正、V逆分别与k正、k逆成正比,其中k正、k逆为速率常数,随温度升高而增大,温度一定时,k正 :k逆为常数。若合成氨反应达到平衡后,再升高温度时,理论上活化分子百分数_______ ,(填“增大”“减小”或“不变”,下同),k正 :k逆与升高温度前比较将_____________ 。
(4)工业上,合成氨反应在高压条件下进行,实际上Kp值不仅与温度有关,还与压力和气体组成有关。一定条件下,上述合成氨反应接近平衡时,遵循如下方程: 。其中r( NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,该条件下,实验测得a=0.5,则反应达到平衡时,k正 、k逆、kp三者的关系式为
。其中r( NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,该条件下,实验测得a=0.5,则反应达到平衡时,k正 、k逆、kp三者的关系式为____________________ 。
 N2(g) +
N2(g) + H2(g)⇌NH3(g),回答下列问题:
H2(g)⇌NH3(g),回答下列问题:(1)化学键键能数据如下:
| 化学键 | H-H | N N N | N-H |
| E/kJ▪mol-1 | 436 | 946 | 391 |
上述反应的△H=
(2)在合成氨的反应中,外界条件会对平衡发生移动产生影响。如图表示随外界条件改变,氨气的体积分数(φ)的变化趋势。若横坐标x表示压强,则变化趋势正确的是

(3) p(N2)、p(H2)、p( NH3)分别代表N2、H2、NH3的分压,上述反应的压力平衡常数表达式Kp=
(4)工业上,合成氨反应在高压条件下进行,实际上Kp值不仅与温度有关,还与压力和气体组成有关。一定条件下,上述合成氨反应接近平衡时,遵循如下方程:
 。其中r( NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,该条件下,实验测得a=0.5,则反应达到平衡时,k正 、k逆、kp三者的关系式为
。其中r( NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,该条件下,实验测得a=0.5,则反应达到平衡时,k正 、k逆、kp三者的关系式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】请根据化学能和热能、电能相关的知识,问答下列问题:
(1)下列变化中,属于吸热反应的是_______ (填序号)。
①液态水汽化②Ba(OH)2·8H2O与固体NH4Cl混合③浓H2SO4稀释④高锰酸钾分解制O2⑤生石灰跟水反应生成熟石灰⑥将胆矾加热变为白色粉末⑦CO2+C 2CO⑧CaCO3高温分解⑨N2+3H2
2CO⑧CaCO3高温分解⑨N2+3H2  2NH3⑩C+H2O(g)
2NH3⑩C+H2O(g)  CO+H2
CO+H2
(2)①2H2(g)+О2(g)= 2Н2О(g) ∆Н1
②3H2(g)+Fe2O3(s)= 2Fe(s)+3H2O(g) ∆H2
③2Fe(s)+ O2(g)= Fe2O3(s) ∆H3
O2(g)= Fe2O3(s) ∆H3
则∆H1、∆H2、∆H3之间的关系是_______ 。
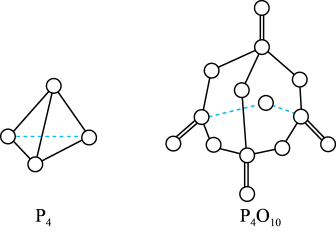
(3)已知化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量。
现查知:P-P键能为a kJ·mol-1、P-O键能为b kJ·mol-1、P=O键能为c kJ·mol-1、O=O键能为d kJ·mol-1。又知白磷和P4O10的分子结构如图所示,若生成1mol P4O10,则反应P4(白磷)+5O2 = P4O10中的反应热∆H=_______ kJ·mol-1(用a、b、c、d表示)。
(4)航天技术上使用的氢-氧燃料电池原理如图,则:
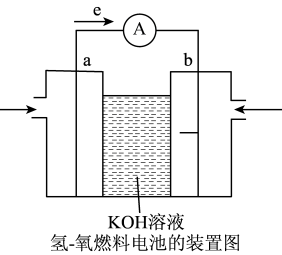
①a极为电池的_______ (填“正极”或“负极”);溶液中OH—移向_______ 电极(填“a”或“b”)
②如把H2改为乙醇蒸汽(C2H5OH),则负极电极反应式为:_______ 。
(1)下列变化中,属于吸热反应的是
①液态水汽化②Ba(OH)2·8H2O与固体NH4Cl混合③浓H2SO4稀释④高锰酸钾分解制O2⑤生石灰跟水反应生成熟石灰⑥将胆矾加热变为白色粉末⑦CO2+C
 2CO⑧CaCO3高温分解⑨N2+3H2
2CO⑧CaCO3高温分解⑨N2+3H2  2NH3⑩C+H2O(g)
2NH3⑩C+H2O(g)  CO+H2
CO+H2(2)①2H2(g)+О2(g)= 2Н2О(g) ∆Н1
②3H2(g)+Fe2O3(s)= 2Fe(s)+3H2O(g) ∆H2
③2Fe(s)+
 O2(g)= Fe2O3(s) ∆H3
O2(g)= Fe2O3(s) ∆H3则∆H1、∆H2、∆H3之间的关系是
(3)已知化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量。
现查知:P-P键能为a kJ·mol-1、P-O键能为b kJ·mol-1、P=O键能为c kJ·mol-1、O=O键能为d kJ·mol-1。又知白磷和P4O10的分子结构如图所示,若生成1mol P4O10,则反应P4(白磷)+5O2 = P4O10中的反应热∆H=

(4)航天技术上使用的氢-氧燃料电池原理如图,则:

①a极为电池的
②如把H2改为乙醇蒸汽(C2H5OH),则负极电极反应式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】研究废气、废水中污染物处理的有效措施是环保领域的重要课题。
Ⅰ、 是空气的主要污染物之一,有效去除大气中的
是空气的主要污染物之一,有效去除大气中的 可以保护大气环境。
可以保护大气环境。
(1)空气中污染物NO可在催化剂作用下用 还原。
还原。
已知: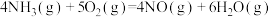
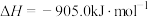
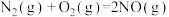

有氧条件下, 与NO反应生成
与NO反应生成 ,相关热化学方程式为
,相关热化学方程式为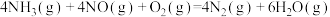

___________ 
(2)工业上含氮污染物处理以 、
、 、熔融
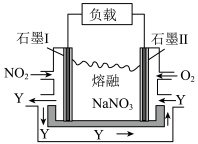
、熔融 组成的燃料电池装置如题图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为
组成的燃料电池装置如题图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为___________ 。
Ⅱ、在水溶液中,Cr(Ⅲ)以 形态存在;Cr(Ⅵ)主要以
形态存在;Cr(Ⅵ)主要以 和形态存在,其毒性是Cr(Ⅲ)的100倍。处理含Cr废水的常用方法是先将其转化为Cr(Ⅲ),再进一步将
和形态存在,其毒性是Cr(Ⅲ)的100倍。处理含Cr废水的常用方法是先将其转化为Cr(Ⅲ),再进一步将 转化为
转化为 沉淀,减少水体中总铬含量。
沉淀,减少水体中总铬含量。
(3)Cr(Ⅵ)在水溶液中常有 和
和 两种存在形式,加酸可以使
两种存在形式,加酸可以使 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(4) 可用于直接还原去除废水中的
可用于直接还原去除废水中的 ,反应时消耗大量
,反应时消耗大量 。废水的初始pH对去除溶液中的Cr(Ⅵ)和总Cr的影响关系如题图所示:
。废水的初始pH对去除溶液中的Cr(Ⅵ)和总Cr的影响关系如题图所示:

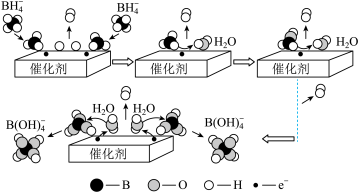
①废水初始pH=2时,Cr(Ⅵ)的去除率达到100%,总Cr的去除率为0%,其原因是___________ 。
②氢化铝锂( )、硼氢化钠(
)、硼氢化钠( )在有机合成中应用广泛。还原能力(单位质量转移电子数):
)在有机合成中应用广泛。还原能力(单位质量转移电子数):
___________  (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
③ 是一种应用广泛的强还原剂,在热水中生成硼酸钠和氢气,反应如下:
是一种应用广泛的强还原剂,在热水中生成硼酸钠和氢气,反应如下:
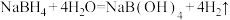 。
。 在催化剂作用下与水反应获得
在催化剂作用下与水反应获得 的微观过程如题图所示,若将
的微观过程如题图所示,若将 中的H全部用D(重氢原子)代替,请根据上图结合相关方程式描述生成
中的H全部用D(重氢原子)代替,请根据上图结合相关方程式描述生成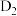 气体这一步的微观过程:
气体这一步的微观过程:___________ 。
Ⅰ、
 是空气的主要污染物之一,有效去除大气中的
是空气的主要污染物之一,有效去除大气中的 可以保护大气环境。
可以保护大气环境。(1)空气中污染物NO可在催化剂作用下用
 还原。
还原。已知:
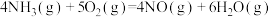
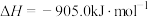
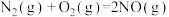

有氧条件下,
 与NO反应生成
与NO反应生成 ,相关热化学方程式为
,相关热化学方程式为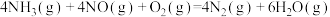


(2)工业上含氮污染物处理以
 、
、 、熔融
、熔融 组成的燃料电池装置如题图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为
组成的燃料电池装置如题图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为
Ⅱ、在水溶液中,Cr(Ⅲ)以
 形态存在;Cr(Ⅵ)主要以
形态存在;Cr(Ⅵ)主要以 和形态存在,其毒性是Cr(Ⅲ)的100倍。处理含Cr废水的常用方法是先将其转化为Cr(Ⅲ),再进一步将
和形态存在,其毒性是Cr(Ⅲ)的100倍。处理含Cr废水的常用方法是先将其转化为Cr(Ⅲ),再进一步将 转化为
转化为 沉淀,减少水体中总铬含量。
沉淀,减少水体中总铬含量。(3)Cr(Ⅵ)在水溶液中常有
 和
和 两种存在形式,加酸可以使
两种存在形式,加酸可以使 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(4)
 可用于直接还原去除废水中的
可用于直接还原去除废水中的 ,反应时消耗大量
,反应时消耗大量 。废水的初始pH对去除溶液中的Cr(Ⅵ)和总Cr的影响关系如题图所示:
。废水的初始pH对去除溶液中的Cr(Ⅵ)和总Cr的影响关系如题图所示:
①废水初始pH=2时,Cr(Ⅵ)的去除率达到100%,总Cr的去除率为0%,其原因是
②氢化铝锂(
 )、硼氢化钠(
)、硼氢化钠( )在有机合成中应用广泛。还原能力(单位质量转移电子数):
)在有机合成中应用广泛。还原能力(单位质量转移电子数):
 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)③
 是一种应用广泛的强还原剂,在热水中生成硼酸钠和氢气,反应如下:
是一种应用广泛的强还原剂,在热水中生成硼酸钠和氢气,反应如下: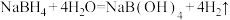 。
。 在催化剂作用下与水反应获得
在催化剂作用下与水反应获得 的微观过程如题图所示,若将
的微观过程如题图所示,若将 中的H全部用D(重氢原子)代替,请根据上图结合相关方程式描述生成
中的H全部用D(重氢原子)代替,请根据上图结合相关方程式描述生成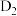 气体这一步的微观过程:
气体这一步的微观过程:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】市某企业对高砷高锡铅阳极泥进行脱砷处理,分离出锡铅废渣的同时制备了砷酸钠晶体(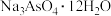 )。其工艺流程如下:
)。其工艺流程如下:
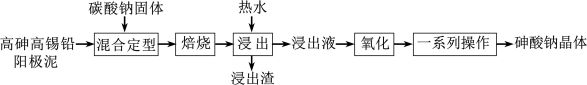
已知:i.砷在高砷高锡铅阳极泥中以单质形式存在;
ii.砷酸钠晶体有毒性;
iii.“浸出液”呈碱性,其主要成分为 和
和 。
。
请回答下列问题:
(1)储存砷酸钠晶体时应张贴的危险品标志为__________ (填选项字母)。
A B
B C
C D
D
(2)焙烧前需要将阳极泥与碳酸钠固体充分混合,其目的是_____________ 。
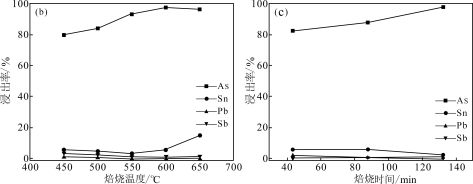
(3)用控制变量法探究焙烧温度和焙烧时间对砷的浸出率影响如图,则应选择的最佳焙烧温度和时间分别为____________________ 。
(4)“焙烧”时生成 的化学方程式为
的化学方程式为_____________________ 。
(5)“氧化”过程中若使用 作氧化剂,则发生反应的离子方程式为
作氧化剂,则发生反应的离子方程式为______________ 。
(6)“一系列操作”具体为________ 、_______ 、过滤﹑洗涤、干燥。
(7)若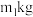 的阳极泥(砷百分含量为
的阳极泥(砷百分含量为 )经过上述工艺流程最后制得
)经过上述工艺流程最后制得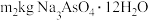 晶体,则砷酸钠晶体的产率为
晶体,则砷酸钠晶体的产率为______________ %。(用含有 、
、 的式子表示,产率
的式子表示,产率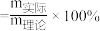 )
)
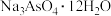 )。其工艺流程如下:
)。其工艺流程如下:
已知:i.砷在高砷高锡铅阳极泥中以单质形式存在;
ii.砷酸钠晶体有毒性;
iii.“浸出液”呈碱性,其主要成分为
 和
和 。
。请回答下列问题:
(1)储存砷酸钠晶体时应张贴的危险品标志为
A
 B
B C
C D
D
(2)焙烧前需要将阳极泥与碳酸钠固体充分混合,其目的是
(3)用控制变量法探究焙烧温度和焙烧时间对砷的浸出率影响如图,则应选择的最佳焙烧温度和时间分别为

(4)“焙烧”时生成
 的化学方程式为
的化学方程式为(5)“氧化”过程中若使用
 作氧化剂,则发生反应的离子方程式为
作氧化剂,则发生反应的离子方程式为(6)“一系列操作”具体为
(7)若
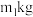 的阳极泥(砷百分含量为
的阳极泥(砷百分含量为 )经过上述工艺流程最后制得
)经过上述工艺流程最后制得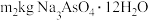 晶体,则砷酸钠晶体的产率为
晶体,则砷酸钠晶体的产率为 、
、 的式子表示,产率
的式子表示,产率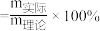 )
)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某厂用闪锌矿制备锌及颜料A(红棕色固体)的工艺流程如图所示。(闪锌矿的主要成分为ZnS,同时含有10%的FeS及少量CuS)。
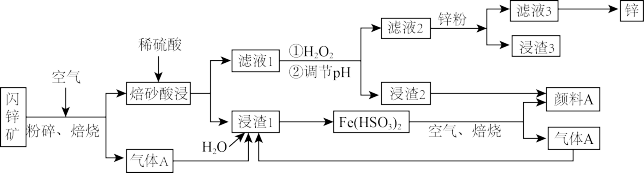
已知:①闪锌矿在焙烧时会生成副产物ZnFeO4,ZnFeO4不溶于水及硫酸。Fe(HSO3)2难溶于水。
②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是___ ,写出闪锌矿焙烧时发生的主要的化学方程式____ 。
(2)“滤液1”中选用足量的H2O2,理由是___ 。常温下,假设“②调节pH"前,滤液1中c(Fe3+)=1mol・L-1,则Fe3+完全沉淀时的pH至少为____ 。(离子浓度≤10-6mol·L-1规为完全除去)。
(3)“滤渣3”的成分为___ (写化学式)。
(4)设计一种检验“颜料A”中是否含有Fe2+的实验方案___ 。
(5)“气体A”与“浸渣1”反应的化学方程式为___ 。

已知:①闪锌矿在焙烧时会生成副产物ZnFeO4,ZnFeO4不溶于水及硫酸。Fe(HSO3)2难溶于水。
②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是
(2)“滤液1”中选用足量的H2O2,理由是
(3)“滤渣3”的成分为
(4)设计一种检验“颜料A”中是否含有Fe2+的实验方案
(5)“气体A”与“浸渣1”反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程为CH4(g)+H2O(g) CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802kJ·mol—1
CO(g)+ O2(g)=CO2(g) ΔH2=-283kJ·mol—1
O2(g)=CO2(g) ΔH2=-283kJ·mol—1
H2(g)+ O2(g) =H2O(g) ΔH3=-242kJ·mol—1
O2(g) =H2O(g) ΔH3=-242kJ·mol—1
则甲烷水蒸气重整反应的ΔH=___________ kJ·mol—1。
(2)该反应的逆反应速率表达式为:v=kc(CO)c3(H2),k为速率常数,在某温度下,测得实验数据如下表:
由上述数据可得该温度下,上述反应的逆反应速率常数k为___________ L3·mol-3·
min-1。
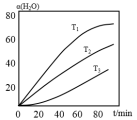
(3)CH4和H2O (g)的体积相同,不同温度下,H2O的转化率随时间的变化α(H2O)—t曲线如图所示。温度T1、T2、T3的大小关系是___________ ,判断依据是___________ 。
(4)据模拟实验可知,压强为0.1MPa、温度为900℃,水碳(CH4)比为1.0时,达平衡时H2的物质的量分数为0.6,则CH4的转化率为___________ 。
(5)天然气中还含有CO2、H2S等。Jo De Vrieze等设计了利用膜电解法脱除天然气中的CO2和H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图所示。

阳极室逸出CO2和___________ (填化学式):H2S在阳极上转化为SO 而除去,其电极反应式为
而除去,其电极反应式为___________ 。
 CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802kJ·mol—1
CO(g)+
 O2(g)=CO2(g) ΔH2=-283kJ·mol—1
O2(g)=CO2(g) ΔH2=-283kJ·mol—1H2(g)+
 O2(g) =H2O(g) ΔH3=-242kJ·mol—1
O2(g) =H2O(g) ΔH3=-242kJ·mol—1则甲烷水蒸气重整反应的ΔH=
(2)该反应的逆反应速率表达式为:v=kc(CO)c3(H2),k为速率常数,在某温度下,测得实验数据如下表:
| CO浓度(mol·L—1) | H2浓度(mol·L—1) | 逆反应速率(mol·L—1·min—1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
由上述数据可得该温度下,上述反应的逆反应速率常数k为
min-1。
(3)CH4和H2O (g)的体积相同,不同温度下,H2O的转化率随时间的变化α(H2O)—t曲线如图所示。温度T1、T2、T3的大小关系是

(4)据模拟实验可知,压强为0.1MPa、温度为900℃,水碳(CH4)比为1.0时,达平衡时H2的物质的量分数为0.6,则CH4的转化率为
(5)天然气中还含有CO2、H2S等。Jo De Vrieze等设计了利用膜电解法脱除天然气中的CO2和H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图所示。

阳极室逸出CO2和
 而除去,其电极反应式为
而除去,其电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】次磷酸钠( )是具有珍珠光泽的晶体或白色结晶性粉末,易溶于水、乙醇、甘油,微溶于氨水,不溶于乙醚。次磷酸钠(
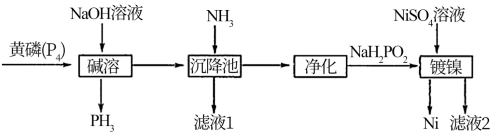
)是具有珍珠光泽的晶体或白色结晶性粉末,易溶于水、乙醇、甘油,微溶于氨水,不溶于乙醚。次磷酸钠( )广泛应用于化学镀镍,其制备与镀镍过程如下图所示:
)广泛应用于化学镀镍,其制备与镀镍过程如下图所示:
据此回答下列问题:
(1)基态Ni原子的核外电子排布式为___________ ,PH3的分子空间构型为___________ 。
(2)“碱溶”过程中,发生反应化学方程式为___________ 。次磷酸(H3PO2)的结构为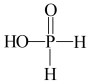 ,则
,则 溶液中离子浓度大小关系为
溶液中离子浓度大小关系为___________ 。
(3)“沉降池”中通入氨气的目的是___________ 。“净化”操作需要过滤、洗涤、干燥,洗涤时,选用的洗涤剂为___________ 。
(4)“滤液2”经分离提纯可以得 ,写出“镀镍”过程发生的离子反应方程式
,写出“镀镍”过程发生的离子反应方程式___________ ,充分反应后,向“滤液2”中,加入适量 悬浊液,生成
悬浊液,生成 和
和 ,混合沉淀,此时
,混合沉淀,此时
___________ [已知:
 )是具有珍珠光泽的晶体或白色结晶性粉末,易溶于水、乙醇、甘油,微溶于氨水,不溶于乙醚。次磷酸钠(
)是具有珍珠光泽的晶体或白色结晶性粉末,易溶于水、乙醇、甘油,微溶于氨水,不溶于乙醚。次磷酸钠( )广泛应用于化学镀镍,其制备与镀镍过程如下图所示:
)广泛应用于化学镀镍,其制备与镀镍过程如下图所示:
据此回答下列问题:
(1)基态Ni原子的核外电子排布式为
(2)“碱溶”过程中,发生反应化学方程式为
 ,则
,则 溶液中离子浓度大小关系为
溶液中离子浓度大小关系为(3)“沉降池”中通入氨气的目的是
(4)“滤液2”经分离提纯可以得
 ,写出“镀镍”过程发生的离子反应方程式
,写出“镀镍”过程发生的离子反应方程式 悬浊液,生成
悬浊液,生成 和
和 ,混合沉淀,此时
,混合沉淀,此时

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钨酸(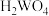 )是一种重要的化工原料,用作媒染剂催化剂,制造防火材料等。一种以黑钨矿(主要成分是
)是一种重要的化工原料,用作媒染剂催化剂,制造防火材料等。一种以黑钨矿(主要成分是 和
和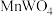 ,还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如下图所示。
,还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如下图所示。
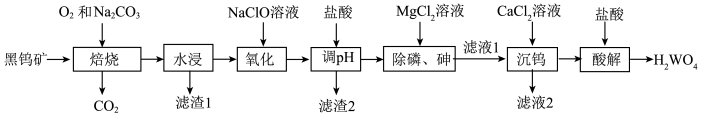
已知:①“滤渣1”的成分是 和
和 。
。
②“水浸”后滤液中主要阴离子为 、
、 、
、 、
、 和
和 。
。
③ 。
。
回答下列问题:
(1)基态Mn原子中未成对的电子数为___________ 。
(2) 发生“焙烧"时的化学反应方程式为
发生“焙烧"时的化学反应方程式为___________ 。
(3)“滤渣2”的主要成分是___________ ,加入盐酸“调节pH”要在加热煮沸条件下进行,煮沸的目的是___________ 。
(4)“除磷、砷”过程中P、As元素以 和
和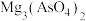 形式沉淀,则“氧化”过程中加入NaClO溶液的目的是
形式沉淀,则“氧化”过程中加入NaClO溶液的目的是___________ 。
(5)当“滤液1”中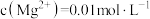 时,此时
时,此时 是否沉淀完全。列式计算说明
是否沉淀完全。列式计算说明___________ 。
(6)“沉钨”后需要过滤、洗涤,则洗涤的具体操作为___________ 。
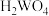 )是一种重要的化工原料,用作媒染剂催化剂,制造防火材料等。一种以黑钨矿(主要成分是
)是一种重要的化工原料,用作媒染剂催化剂,制造防火材料等。一种以黑钨矿(主要成分是 和
和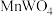 ,还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如下图所示。
,还含有Si、P、As等元素的杂质)为原料制备钨酸的工业流程如下图所示。
已知:①“滤渣1”的成分是
 和
和 。
。②“水浸”后滤液中主要阴离子为
 、
、 、
、 、
、 和
和 。
。③
 。
。回答下列问题:
(1)基态Mn原子中未成对的电子数为
(2)
 发生“焙烧"时的化学反应方程式为
发生“焙烧"时的化学反应方程式为(3)“滤渣2”的主要成分是
(4)“除磷、砷”过程中P、As元素以
 和
和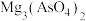 形式沉淀,则“氧化”过程中加入NaClO溶液的目的是
形式沉淀,则“氧化”过程中加入NaClO溶液的目的是(5)当“滤液1”中
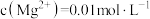 时,此时
时,此时 是否沉淀完全。列式计算说明
是否沉淀完全。列式计算说明(6)“沉钨”后需要过滤、洗涤,则洗涤的具体操作为
您最近一年使用:0次
【推荐3】Na2Cr2O7·2H2O常用作制革工业的鞣革剂,工业上以铬铁矿(主要成分为FeCr2O4,含Al 、Si氧化物等杂质)为主要原料制备Na2Cr2O7·2H2O的工艺流程如图。回答下列问题:
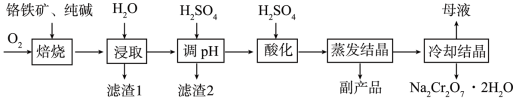
(1)铬铁矿“焙烧”前,为提高焙烧效率,可采取的措施有___________ (任写一点)。
(2)“焙烧”的目的是将FeCr2O4转化为Na2Cr2O4和铁红,写出“焙烧”时生成Na2Cr2O4的化学方程式:___________ 。
(3)“滤渣1”的主要成分为Fe2O3等难溶于水的物质,则“滤渣2”的主要成分为___________ (填化学式)。
(4)已知各离子浓度的对数lgc与pH的关系如图甲所示。当溶液中某种粒子浓度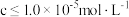 时,可认为该离子已除尽,则“调pH”时pH的理论范围为“酸化”的目的是
时,可认为该离子已除尽,则“调pH”时pH的理论范围为“酸化”的目的是___________ 。
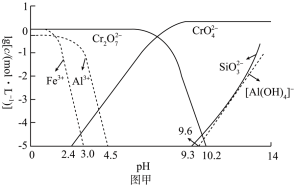
(5)利用膜电解技术,以Na2Cr2O4为主要原料制备Na2Cr2O7的工作原理如图乙所示(a、b电极材料均为石墨):a极与电源的___________ 极相连,制备1 mol Na2Cr2O7时,理论上左侧溶液总质量增重___________ g。

(6)为了测定Na2Cr2O7产品的纯度,可采用FeSO4标准溶液通过氧化还原反应滴定Na2Cr2O7溶液。下列关于滴定分析的操作,正确的是___________(填标号)。

(1)铬铁矿“焙烧”前,为提高焙烧效率,可采取的措施有
(2)“焙烧”的目的是将FeCr2O4转化为Na2Cr2O4和铁红,写出“焙烧”时生成Na2Cr2O4的化学方程式:
(3)“滤渣1”的主要成分为Fe2O3等难溶于水的物质,则“滤渣2”的主要成分为
(4)已知各离子浓度的对数lgc与pH的关系如图甲所示。当溶液中某种粒子浓度
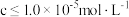 时,可认为该离子已除尽,则“调pH”时pH的理论范围为“酸化”的目的是
时,可认为该离子已除尽,则“调pH”时pH的理论范围为“酸化”的目的是
(5)利用膜电解技术,以Na2Cr2O4为主要原料制备Na2Cr2O7的工作原理如图乙所示(a、b电极材料均为石墨):a极与电源的

(6)为了测定Na2Cr2O7产品的纯度,可采用FeSO4标准溶液通过氧化还原反应滴定Na2Cr2O7溶液。下列关于滴定分析的操作,正确的是___________(填标号)。
| A.用移液管量取25.00 mL待测液转移至锥形瓶中 |
| B.滴定开始时可以让液体成线状快速流下,接近滴定终点时减慢滴加速率,必要时采用半滴操作 |
| C.排气泡时应使管尖弯曲向上,用右手挤压玻璃珠上方,使液体充满管尖 |
| D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直 |
您最近一年使用:0次



