名校
1 . 氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______ kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________ 。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________ ;为抑制肼的分解,可采取的合理措施有________ (任写一种)。
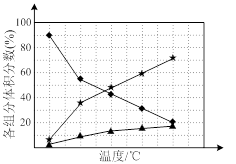
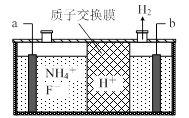
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________ 。
② a电极为电解池的_____________ (填“阴”或“阳”)极,写出该电极的电极反应式:________________ ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________ 。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:


图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为
② a电极为电解池的
您最近一年使用:0次
2016-01-21更新
|
369次组卷
|
3卷引用:2015届江苏省南通、扬州、连云港高三第二次调研测试化学试卷
2 . 煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s) + CO2(g)△H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)⇌CaSO4(s)△H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g)△H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g)△H4= +218.92kJ/mol
(1)△H3=________ kJ/mol。
(2)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:_________ 。
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。

(3)阳极的电极反应式为____ 。
(4)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:___ ;
___FeS2+____·OH=________Fe3++ ______SO + _____H2O +
+ _____H2O +
(5)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;__ 。

I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s) + CO2(g)△H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)⇌CaSO4(s)△H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g)△H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g)△H4= +218.92kJ/mol
(1)△H3=
(2)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。

(3)阳极的电极反应式为
(4)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:
___FeS2+____·OH=________Fe3++ ______SO
 + _____H2O +
+ _____H2O +(5)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;

您最近一年使用:0次
解题方法
3 . 碘及其化合物在生活中应用广泛。含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列两个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1
反应Ⅱ:HI(aq)=1/2H2(g)+1/2I2(aq) △H2
①反应:SO2(g)+2H2O(1)=H2SO4(aq)+H2(g)的△H=_________ (用△H1、△H2表示)。
②反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq) I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________ 。
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子,写出氯气与碘单质反应的离子方程式:____________ 。
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同PH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附____ (填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________ [用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示]。该方法去除碘离子的原理是________________ 。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列两个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1
反应Ⅱ:HI(aq)=1/2H2(g)+1/2I2(aq) △H2
①反应:SO2(g)+2H2O(1)=H2SO4(aq)+H2(g)的△H=
②反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)
 I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是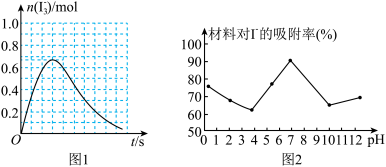
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子,写出氯气与碘单质反应的离子方程式:
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同PH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
您最近一年使用:0次
4 . 我国提出“碳达峰”目标是在2030年前达到最高值,2060年前达到“碳中和”。因此,二氧化碳的综合利用尤为重要。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚( )也有广泛的应用。
)也有广泛的应用。
反应Ⅰ:
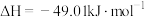
反应Ⅱ:
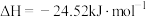
反应Ⅲ:
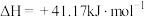
①结合计算分析反应 的自发性:
的自发性:___________ 。
②恒压、投料比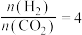 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
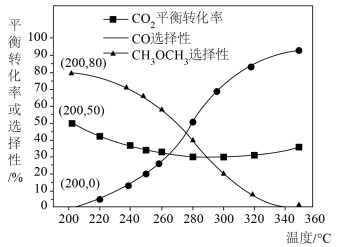
当温度超过 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是___________ 。
③工业实际设计温度一般在 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是___________ 。
(2)研究表明,在电解质水溶液中, 气体可被电化学还原。
气体可被电化学还原。
① 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(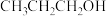 )的电极反应方程式为
)的电极反应方程式为___________ 。
②在电解质水溶液中,三种不同催化剂( 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
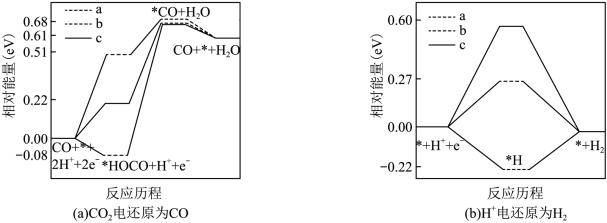
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为___________ (用 、
、 、
、 字母排序)。
字母排序)。
(3) 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷,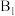 、
、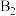 位点带部分负电荷)。
位点带部分负电荷)。

图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为___________ 。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(
 )也有广泛的应用。
)也有广泛的应用。反应Ⅰ:

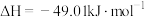
反应Ⅱ:

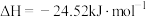
反应Ⅲ:

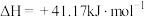
①结合计算分析反应
 的自发性:
的自发性:②恒压、投料比
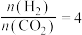 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
当温度超过
 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是③工业实际设计温度一般在
 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是(2)研究表明,在电解质水溶液中,
 气体可被电化学还原。
气体可被电化学还原。①
 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(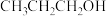 )的电极反应方程式为
)的电极反应方程式为②在电解质水溶液中,三种不同催化剂(
 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为 、
、 、
、 字母排序)。
字母排序)。
(3)
 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷,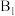 、
、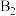 位点带部分负电荷)。
位点带部分负电荷)。
图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为
您最近一年使用:0次
解题方法
5 . 工业废水和废渣中会产生含硫(-2价)污染物,需经处理后排放。
Ⅰ.含硫废水(硫元素的主要存在形式为 ),需要回收处理并加以利用。
),需要回收处理并加以利用。
(1)用 、
、 处理含硫废水有关反应如下:
处理含硫废水有关反应如下:






则 热分解反应
热分解反应 的△H=
的△H=_______ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)用 处理含硫废水,硫元素易被氧化为S或
处理含硫废水,硫元素易被氧化为S或 。已知:
。已知: 溶液中含硫微粒的物质的量分数随pH变化情况如图所示。
溶液中含硫微粒的物质的量分数随pH变化情况如图所示。
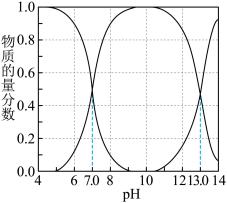
①向含硫废水中加入稀 调节溶液的pH为6,废水中
调节溶液的pH为6,废水中
_______ 。
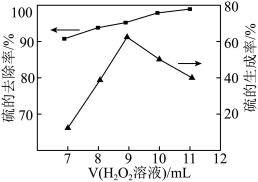
②向含硫废水中加入 溶液,其他条件一定,测得硫(-2价)的去除率、硫(单质)的生成率与加入
溶液,其他条件一定,测得硫(-2价)的去除率、硫(单质)的生成率与加入 溶液体积的关系如图所示。当加入
溶液体积的关系如图所示。当加入 溶液体积大于9mL时,硫的生成率随
溶液体积大于9mL时,硫的生成率随 溶液加入而降低,可能的原因是
溶液加入而降低,可能的原因是_______ 。
(3)催化氧化法。 可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如图所示。
可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如图所示。
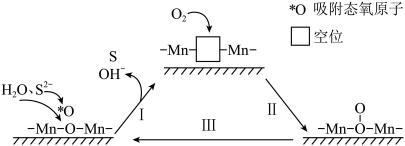
①该反应过程Ⅰ、Ⅱ可描述为_______ 。
②催化剂使用一段时间后催化效率会下降,处理的方法是用氯仿(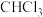 )浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是
)浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是_______ 。
Ⅱ.含硫废渣(硫元素的主要存在形式为 ),可以回收处理并加以利用。
),可以回收处理并加以利用。
(4)沉积物-微生物燃料电池可以将沉积物中的化学能直接转化为电能,同时加速沉积物中污染物的去除,燃料电池处理含硫废水的工作原理如图所示。
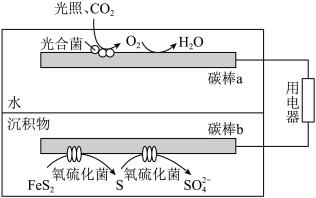
①碳棒b处S生成 的电极反应式为
的电极反应式为_______ 。
②工作一段时间后,电池效率降低的可能原因为_______ 。
Ⅰ.含硫废水(硫元素的主要存在形式为
 ),需要回收处理并加以利用。
),需要回收处理并加以利用。(1)用
 、
、 处理含硫废水有关反应如下:
处理含硫废水有关反应如下:





则
 热分解反应
热分解反应 的△H=
的△H= 、
、 、
、 的式子表示)。
的式子表示)。(2)用
 处理含硫废水,硫元素易被氧化为S或
处理含硫废水,硫元素易被氧化为S或 。已知:
。已知: 溶液中含硫微粒的物质的量分数随pH变化情况如图所示。
溶液中含硫微粒的物质的量分数随pH变化情况如图所示。
①向含硫废水中加入稀
 调节溶液的pH为6,废水中
调节溶液的pH为6,废水中
②向含硫废水中加入
 溶液,其他条件一定,测得硫(-2价)的去除率、硫(单质)的生成率与加入
溶液,其他条件一定,测得硫(-2价)的去除率、硫(单质)的生成率与加入 溶液体积的关系如图所示。当加入
溶液体积的关系如图所示。当加入 溶液体积大于9mL时,硫的生成率随
溶液体积大于9mL时,硫的生成率随 溶液加入而降低,可能的原因是
溶液加入而降低,可能的原因是
(3)催化氧化法。
 可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如图所示。
可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如图所示。
①该反应过程Ⅰ、Ⅱ可描述为
②催化剂使用一段时间后催化效率会下降,处理的方法是用氯仿(
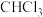 )浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是
)浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是Ⅱ.含硫废渣(硫元素的主要存在形式为
 ),可以回收处理并加以利用。
),可以回收处理并加以利用。(4)沉积物-微生物燃料电池可以将沉积物中的化学能直接转化为电能,同时加速沉积物中污染物的去除,燃料电池处理含硫废水的工作原理如图所示。

①碳棒b处S生成
 的电极反应式为
的电极反应式为②工作一段时间后,电池效率降低的可能原因为
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP)。固体NH4I在一定条件下首先分解达到平衡:
①NH4I(s)⇌NH3(g)+HI(g),然后缓缓进行反应:
②2HI(g)⇌H2(g)+I2(g)亦达到平衡。
它们的平衡常数分别为Kp1和Kp2,下面所述的p指的是平衡时气体的分压。
(1)当反应②刚开始进行时,恒容密闭体系中的变化情况是p(HI)___________ ,p总___________ (不变、增大、减小)
(2)平衡时,若p(NH3)=d,p(H2)=f,则p(HI)=___________ 。
(3)用Kp1和Kp2表示NH3的平衡分压,则p(NH3)=___________ 。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g),ΔH=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),ΔH=-1135.7kJ/mol
(4)下列说法正确的是___________
Ⅲ.铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(5)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:___________ 。
(6)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。

①A点时剩余固体的成分是___________ (填化学式)。
②从开始加热到750K时总反应方程式为___________ 。
(7)CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O 发生反应,生成的Fe3+和Cr3+在阴极区与OH﹣结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10﹣38,KspCr(OH)3=6.0×10﹣31]。
发生反应,生成的Fe3+和Cr3+在阴极区与OH﹣结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10﹣38,KspCr(OH)3=6.0×10﹣31]。
①电解过程中NaCl的作用是___________ 。
②已知电解后的溶液中c(Fe3+)为2.0×10﹣13mol•L﹣1,则溶液中c(Cr3+)为___________ mol•L﹣1.
①NH4I(s)⇌NH3(g)+HI(g),然后缓缓进行反应:
②2HI(g)⇌H2(g)+I2(g)亦达到平衡。
它们的平衡常数分别为Kp1和Kp2,下面所述的p指的是平衡时气体的分压。
(1)当反应②刚开始进行时,恒容密闭体系中的变化情况是p(HI)
(2)平衡时,若p(NH3)=d,p(H2)=f,则p(HI)=
(3)用Kp1和Kp2表示NH3的平衡分压,则p(NH3)=
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g),ΔH=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),ΔH=-1135.7kJ/mol
(4)下列说法正确的是___________
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-1068kJ/mol |
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H +OH﹣ +OH﹣ |
| C.铂做电极,以KOH溶液为电解质溶液的肼空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼-空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
Ⅲ.铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(5)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
(6)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。

①A点时剩余固体的成分是
②从开始加热到750K时总反应方程式为
(7)CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O
 发生反应,生成的Fe3+和Cr3+在阴极区与OH﹣结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10﹣38,KspCr(OH)3=6.0×10﹣31]。
发生反应,生成的Fe3+和Cr3+在阴极区与OH﹣结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10﹣38,KspCr(OH)3=6.0×10﹣31]。①电解过程中NaCl的作用是
②已知电解后的溶液中c(Fe3+)为2.0×10﹣13mol•L﹣1,则溶液中c(Cr3+)为
您最近一年使用:0次
名校
7 . 苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,常用乙苯为原料合成。
(1)逆水煤气变换耦合反应:CO2和乙苯为原料制备苯乙烯的机理如下:
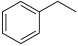 (g)
(g) H2(g) +
H2(g) +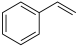 (g) ΔH= +117.6 kJ/mol
(g) ΔH= +117.6 kJ/mol
CO2(g)+H2(g) = CO(g)+ H2O(g) ΔH= +41.2 kJ/mol
则 CO2(g)+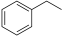 (g)
(g)
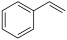 (g)+CO(g)+H2O(g) 的ΔH为
(g)+CO(g)+H2O(g) 的ΔH为_______ 。
(2)乙苯直接脱氢制苯乙烯,反应原理如下:
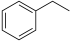 (g)
(g) H2(g) +
H2(g) +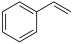 (g) ΔH= +123.5 kJ/mol
(g) ΔH= +123.5 kJ/mol
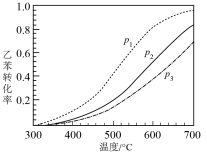
反应在不同压强下进行,实验测得乙苯的平衡转化率随温度(T)的变化关系如图所示,压强(p1、p2、p3)由大到小的顺序为_______ ,理由是_______ 。
(3)乙苯脱氢耦合二氧化碳转化。Ar气氛下,高价态的钒镁氧化物晶体(V)作为的催化活性中心进行乙苯脱氢,耦合CO2转化为CO,实现晶格氧再生和二氧化碳转化,反应机理如图所示:

用简要的文字描述乙苯脱氢耦合二氧化碳转化过程_______ 。
(4)含苯乙烯的废水的排放会对环境造成严重的污染,现采用电解法进行处理,其工作原理如下图(电解液是含苯乙烯和硫酸的废水,pH=6.2), 已知:·OH(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成CO2和H2O。

①M连接电源的_______ (“正极”或“负极”)。
②苯乙烯被·OH氧化的化学反应方程式为_______ 。
(1)逆水煤气变换耦合反应:CO2和乙苯为原料制备苯乙烯的机理如下:
 (g)
(g) H2(g) +
H2(g) + (g) ΔH= +117.6 kJ/mol
(g) ΔH= +117.6 kJ/molCO2(g)+H2(g) = CO(g)+ H2O(g) ΔH= +41.2 kJ/mol
则 CO2(g)+
 (g)
(g)
 (g)+CO(g)+H2O(g) 的ΔH为
(g)+CO(g)+H2O(g) 的ΔH为(2)乙苯直接脱氢制苯乙烯,反应原理如下:
 (g)
(g) H2(g) +
H2(g) + (g) ΔH= +123.5 kJ/mol
(g) ΔH= +123.5 kJ/mol反应在不同压强下进行,实验测得乙苯的平衡转化率随温度(T)的变化关系如图所示,压强(p1、p2、p3)由大到小的顺序为

(3)乙苯脱氢耦合二氧化碳转化。Ar气氛下,高价态的钒镁氧化物晶体(V)作为的催化活性中心进行乙苯脱氢,耦合CO2转化为CO,实现晶格氧再生和二氧化碳转化,反应机理如图所示:

用简要的文字描述乙苯脱氢耦合二氧化碳转化过程
(4)含苯乙烯的废水的排放会对环境造成严重的污染,现采用电解法进行处理,其工作原理如下图(电解液是含苯乙烯和硫酸的废水,pH=6.2), 已知:·OH(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成CO2和H2O。

①M连接电源的
②苯乙烯被·OH氧化的化学反应方程式为
您最近一年使用:0次
8 . 低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:
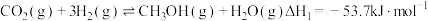
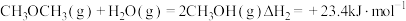
则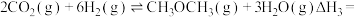
_______ kJ∙mol-1。
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: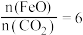 ,则
,则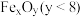 的化学式为
的化学式为_______ ,“热分解系统”中每转移 电子,需消耗
电子,需消耗
_______  。
。
(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子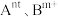 和负离子
和负离子 组成,该物质
组成,该物质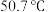 以上形成无序结构(高温相),
以上形成无序结构(高温相),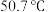 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示:_______ 。
ii.“高温相”具有良好的离子导电性,其主要原因是_______ 。
(4)铜基催化剂 (
( 为
为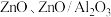 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 上发生反应的总化学方程式
上发生反应的总化学方程式_______ 。
(5)利用电解法在碱性或酸性条件下将 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: 和法拉第效率(
和法拉第效率(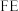 )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下:
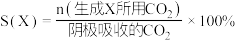

①实验测得,碱性条件生成 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是_______ 。
②实验测得,酸性条件生成 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是_______ 。
(1)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: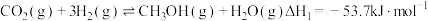
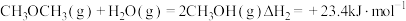
则
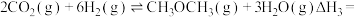
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由
 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: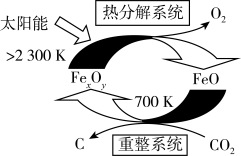
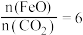 ,则
,则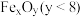 的化学式为
的化学式为 电子,需消耗
电子,需消耗
 。
。(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子
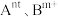 和负离子
和负离子 组成,该物质
组成,该物质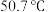 以上形成无序结构(高温相),
以上形成无序结构(高温相),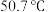 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示: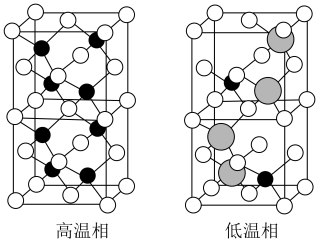
说明:图中,○球为负离子;高温相中的●深色球为正离子或空位;低温相中的 球为
球为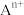 离子,●球为
离子,●球为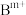 离子。
离子。
ii.“高温相”具有良好的离子导电性,其主要原因是
(4)铜基催化剂
 (
( 为
为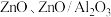 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 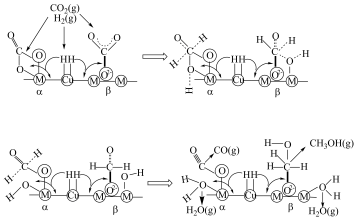
 上发生反应的总化学方程式
上发生反应的总化学方程式(5)利用电解法在碱性或酸性条件下将
 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: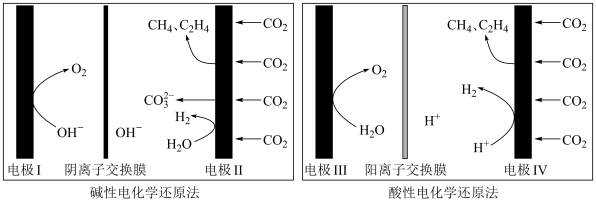
 和法拉第效率(
和法拉第效率( )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下:

①实验测得,碱性条件生成
 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是②实验测得,酸性条件生成
 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是
您最近一年使用:0次
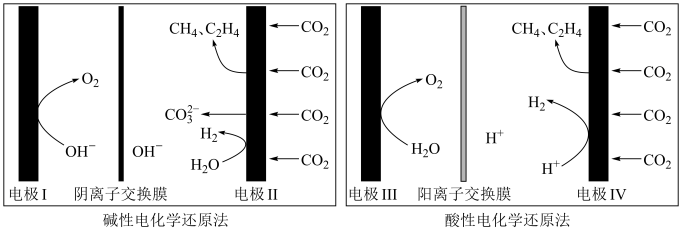
9 . 研发二氧化碳的利用技术具有重要意义。
(1) 还原
还原 是实现“双碳”经济的有效途径之一,相关反应有:
是实现“双碳”经济的有效途径之一,相关反应有:
反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


则反应 的
的
___________ 。
(2)利用电解法在碱性或酸性条件下将 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示:
已知:选择性(S)和法拉第效率(FE)的定义(X代表 或
或 )如下:
)如下:
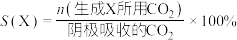
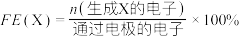
①写出碱性条件下 生成
生成 的电极反应式:
的电极反应式:___________ 。
②实验测得,碱性条件生成 、
、 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是___________ 。
③实验测得,酸性条件生成 、
、 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是___________ 。
④碱性条件下反应一段时间,实验测得 、
、 的选择性及
的选择性及 的法拉第效率如下表所示。则
的法拉第效率如下表所示。则 的法拉第效率
的法拉第效率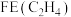 为
为___________ 。
(1)
 还原
还原 是实现“双碳”经济的有效途径之一,相关反应有:
是实现“双碳”经济的有效途径之一,相关反应有:反应Ⅰ:



反应Ⅱ:



反应Ⅲ:



则反应
 的
的
(2)利用电解法在碱性或酸性条件下将
 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示:
已知:选择性(S)和法拉第效率(FE)的定义(X代表
 或
或 )如下:
)如下: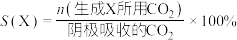
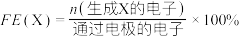
①写出碱性条件下
 生成
生成 的电极反应式:
的电极反应式:②实验测得,碱性条件生成
 、
、 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是③实验测得,酸性条件生成
 、
、 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是④碱性条件下反应一段时间,实验测得
 、
、 的选择性及
的选择性及 的法拉第效率如下表所示。则
的法拉第效率如下表所示。则 的法拉第效率
的法拉第效率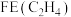 为
为 |  | |
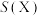 | 2% | 8% |
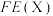 | 12.5% |
您最近一年使用:0次
2024-02-24更新
|
258次组卷
|
2卷引用:江苏省 徐州市第七中学2023-2024学年高三上学期12月月考化学试题
10 . 回答下列问题:
I.页岩气的主要成分为 ,还含有少量的
,还含有少量的 等气体,工业上可采用下列方法除去其中的
等气体,工业上可采用下列方法除去其中的 。
。
(1) 和
和 重整可制得合成气(CO、
重整可制得合成气(CO、 )。已知下列热化学反应方程式:
)。已知下列热化学反应方程式:
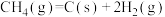 ;
;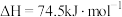
 ;
;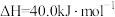
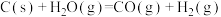 ;
;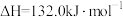
反应 的
的
___________  。
。
(2)利用电解转化法从烟气中分离 的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:
的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:___________ 。
Ⅱ. 是实验室中常用试剂,也是工业原料。
是实验室中常用试剂,也是工业原料。
(3)工业上常用纯碱法富集从海水中提取的溴。第一步,用纯碱溶液吸收空气吹出的溴蒸气,生成NaBr和 ,第二步,向吸收液中加入稀硫酸生成
,第二步,向吸收液中加入稀硫酸生成 。第二步的离子方程式为
。第二步的离子方程式为___________ 。
(4)利用溴化铜制备溴: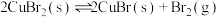 。在密闭容器中加入足量的
。在密闭容器中加入足量的 固体,发生上述反应。在温度为T℃时达到平衡,测得
固体,发生上述反应。在温度为T℃时达到平衡,测得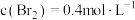 。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。
。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。
①在下图所示的坐标系中补充4min~10min之间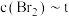 关系曲线
关系曲线___________ 。
②下列固体物质的物理量不变时,能表示该反应已达到平衡状态的是___________ (填字母)。
a.总质量 b.总物质的量 c.平均摩尔质量
(5)已知:拟卤素,如 、
、 等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
①由此推知, 、
、 、
、 的氧化性强弱排序为
的氧化性强弱排序为___________ 。写出B试管中发生反应的离子方程式:___________ 。
②向含淀粉的KI溶液中滴加 溶液,可观察到现象是
溶液,可观察到现象是___________ 。
(6)T℃时,HBr(g)催化氧化反应为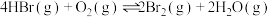 。在体积为VL的恒容密闭容器中充入4molHBr(g)和
。在体积为VL的恒容密闭容器中充入4molHBr(g)和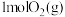 ,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=
,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=___________ 。
I.页岩气的主要成分为
 ,还含有少量的
,还含有少量的 等气体,工业上可采用下列方法除去其中的
等气体,工业上可采用下列方法除去其中的 。
。(1)
 和
和 重整可制得合成气(CO、
重整可制得合成气(CO、 )。已知下列热化学反应方程式:
)。已知下列热化学反应方程式: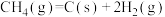 ;
;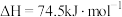
 ;
;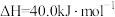
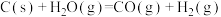 ;
;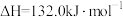
反应
 的
的
 。
。(2)利用电解转化法从烟气中分离
 的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:
的原理如图所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式:
Ⅱ.
 是实验室中常用试剂,也是工业原料。
是实验室中常用试剂,也是工业原料。(3)工业上常用纯碱法富集从海水中提取的溴。第一步,用纯碱溶液吸收空气吹出的溴蒸气,生成NaBr和
 ,第二步,向吸收液中加入稀硫酸生成
,第二步,向吸收液中加入稀硫酸生成 。第二步的离子方程式为
。第二步的离子方程式为(4)利用溴化铜制备溴:
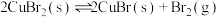 。在密闭容器中加入足量的
。在密闭容器中加入足量的 固体,发生上述反应。在温度为T℃时达到平衡,测得
固体,发生上述反应。在温度为T℃时达到平衡,测得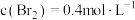 。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。
。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到平衡。①在下图所示的坐标系中补充4min~10min之间
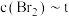 关系曲线
关系曲线
②下列固体物质的物理量不变时,能表示该反应已达到平衡状态的是
a.总质量 b.总物质的量 c.平均摩尔质量
(5)已知:拟卤素,如
 、
、 等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,向A试管中滴加足量的KOCN溶液、向B试管中滴加足量的KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。①由此推知,
 、
、 、
、 的氧化性强弱排序为
的氧化性强弱排序为②向含淀粉的KI溶液中滴加
 溶液,可观察到现象是
溶液,可观察到现象是(6)T℃时,HBr(g)催化氧化反应为
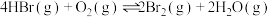 。在体积为VL的恒容密闭容器中充入4molHBr(g)和
。在体积为VL的恒容密闭容器中充入4molHBr(g)和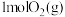 ,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=
,发生上述反应,达到平衡时容器内压强与反应前压强之比为9∶10。该温度下,上述反应平衡常数K=
您最近一年使用:0次



