1 . 煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s) + CO2(g)△H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)⇌CaSO4(s)△H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g)△H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g)△H4= +218.92kJ/mol
(1)△H3=________ kJ/mol。
(2)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:_________ 。
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。

(3)阳极的电极反应式为____ 。
(4)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:___ ;
___FeS2+____·OH=________Fe3++ ______SO + _____H2O +
+ _____H2O +
(5)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;__ 。

I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s) + CO2(g)△H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)⇌CaSO4(s)△H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g)△H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g)△H4= +218.92kJ/mol
(1)△H3=
(2)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。

(3)阳极的电极反应式为
(4)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:
___FeS2+____·OH=________Fe3++ ______SO
 + _____H2O +
+ _____H2O +(5)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;

您最近一年使用:0次
名校
解题方法
2 . 重铬酸钠晶体(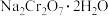 )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含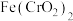 ,还含少量
,还含少量 、
、 、
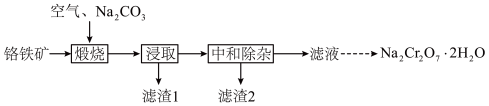
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
已知:① 在水溶液中常以
在水溶液中常以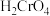 、
、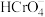 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。
②酸性条件下, 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成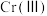 。
。
请回答下列问题:
(1)“煅烧”时,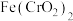 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式_______ 。
(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液 约为7。
约为7。
①加热至接近沸腾的目的为_______ 。
②若持续加热较长时间,可以通过生成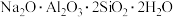 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式_______ 。
(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



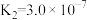
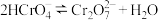
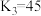
室温下,反应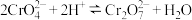 的平衡常数
的平衡常数
_______ ;酸化 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是_______ 。
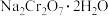 )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含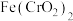 ,还含少量
,还含少量 、
、 、
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
已知:①
 在水溶液中常以
在水溶液中常以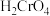 、
、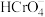 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。②酸性条件下,
 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成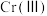 。
。请回答下列问题:
(1)“煅烧”时,
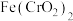 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液
 约为7。
约为7。①加热至接近沸腾的目的为
②若持续加热较长时间,可以通过生成
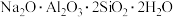 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



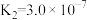
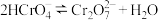
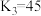
室温下,反应
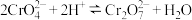 的平衡常数
的平衡常数
 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是
您最近一年使用:0次
2021-09-20更新
|
350次组卷
|
3卷引用:江苏省泰州中学2022届高三上学期期初检测化学试题
3 . 零价纳米铁在环境修复中具有广泛应用,可用来处理地下水中的铼酸根离子( )。
)。
资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。
(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式___ 。
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑
①氮气作用下烘干的目的是___ 。
②每生成1molFe,转移电子数为___ 。
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。
①写出反应的离子方程式___ 。
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是___ 。
③研究表明pH过高或过低会使 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是___ 。
 )。
)。资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO
 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2
 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑①氮气作用下烘干的目的是
②每生成1molFe,转移电子数为
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、
 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。①写出反应的离子方程式
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是
③研究表明pH过高或过低会使
 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是
您最近一年使用:0次
2021-01-22更新
|
331次组卷
|
2卷引用:江苏省徐州市第一中学2021届高三上学期期末考试化学试题
4 . 肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
①工业上合成氨的反应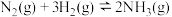

_______ 
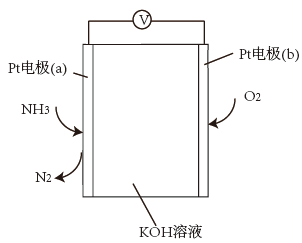
②合成肼的NH3可用电化学气敏传感器监测,原理如图。负极的电极反应为_______ ,假设有16.8L(标准状况)氨气进入传感器,另一极需要通入标准状况下O2的体积为_______ L。
(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
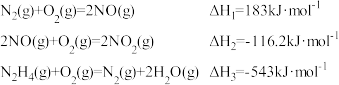
写出肼作火箭燃料时反应的热化学方程式_______ 。
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;
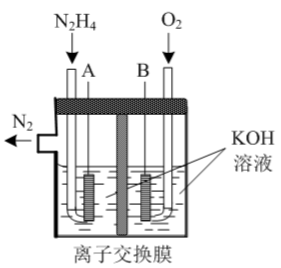
①肼-空气燃料电池的负极反应式为_______ 。
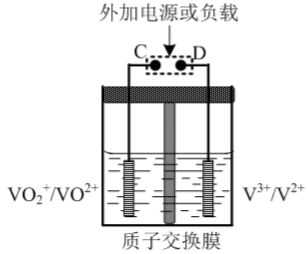
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式_______ 。
(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是_______ 。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
| 化学键 |  |  |  |
键能/ | a | b | c |
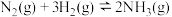


②合成肼的NH3可用电化学气敏传感器监测,原理如图。负极的电极反应为

(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
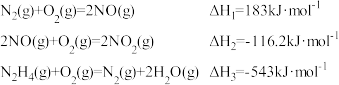
写出肼作火箭燃料时反应的热化学方程式
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;

①肼-空气燃料电池的负极反应式为
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式

(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)实验测得16 g甲醇气体(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.5 kJ的热量,试写出甲醇标准燃烧热的热化学方程式:_______ 。
(2)已知:
已知反应:N2(g)+3H2(g)⇌2NH3(g) ΔH=a kJ·mol-1。试根据表中所列键能数据估算a的值为_______ 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时2C(s,石墨) + H2(g)= C2H2(g) ΔH=_______ kJ·mol-1
(4)电化学技术是有效解决 CO、SO2、NOx等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

①电解质溶液中SO 向
向_______ (填“A极”或“B极” )移动。
②请写出负极反应式:_______ 。
③用该原电池做电源,石墨做电极电解2L AgNO3溶液,写出阳极的电极反应式:_______ 。通电一段时间,两极均产生2.24 L(标准状况)气体,则电解过程中共转移电子_______ mol。
(5)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。2Mn(OH)2 + O2=2MnO(OH)2
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O +I2=2I-+S4O
+I2=2I-+S4O )。
)。
回答下列问题:
①固氧后的水样酸化时发生反应的离子方程式为_______ 。
②取100.00 mL水样经固氧、酸化后,用a mol·L-1 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为_______ ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_______ mg·L-1。
(1)实验测得16 g甲醇气体(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.5 kJ的热量,试写出甲醇标准燃烧热的热化学方程式:
(2)已知:
| 化学键 | H—H | N—H | N≡N |
| 键能/(kJ·mol-1) | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时2C(s,石墨) + H2(g)= C2H2(g) ΔH=
(4)电化学技术是有效解决 CO、SO2、NOx等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

①电解质溶液中SO
 向
向②请写出负极反应式:
③用该原电池做电源,石墨做电极电解2L AgNO3溶液,写出阳极的电极反应式:
(5)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。2Mn(OH)2 + O2=2MnO(OH)2
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O
 +I2=2I-+S4O
+I2=2I-+S4O )。
)。回答下列问题:
①固氧后的水样酸化时发生反应的离子方程式为
②取100.00 mL水样经固氧、酸化后,用a mol·L-1 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.高铁酸盐等具有强氧化性,溶液pH越小氧化性越强,可用于除去废水中的氨、重金属等。K2FeO4的稳定性与pH关系如图1所示,用K2FeO4去除某氨氮(NH3—N)废水,氨氮去除率与pH关系如图2所示;用K2FeO4处理Zn2+浓度为0.12mg·L-1的含锌废水{Ksp[Zn(OH)2]=1.2×10-17},锌残留量与pH关系如图3所示(已知:K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀)。

(1)图2中,pH越大氨氮的去除率越大,其原因可能是___ 。
(2)图3中,pH=10时锌的去除率比pH=5时大得多,其原因是___ (从锌的存在形态的角度说明)。
Ⅱ.甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法,具有工艺简单、成本低等优点。回答下列问题:
(3)已知1000K时,下列反应的平衡常数和反应热:
①CH4(g) C(s)+2H2(g) K1=10.2 △H1
C(s)+2H2(g) K1=10.2 △H1
②2CO(g) C(s)+CO2(g) K2=0.6 △H2
C(s)+CO2(g) K2=0.6 △H2
③CO(g)+H2O(g) CO2(g)+H2(g) K3=1.4 △H3
CO2(g)+H2(g) K3=1.4 △H3
④CH4(g)+2H2O(g) CO2(g)+4H2(g) K4△H4(SMR)
CO2(g)+4H2(g) K4△H4(SMR)
则1000K时,K4=___ ;△H4=___ (用△H1、△H2、△H3来表示)。
(4)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5ppm以下。脱硫的目的为___ 。
(5)如图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知△H4___ 0(填“>”或“<”)。

(6)如图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐___ (填“增加”“减小”或“不变”),600℃时,电流对三种催化剂中的___ (用图中的催化剂表示式回答)影响效果最为显著,当温度高于750℃时,无论电流强度大小,有无催化剂,H2产率趋于相同,其原因是___ 。


(1)图2中,pH越大氨氮的去除率越大,其原因可能是
(2)图3中,pH=10时锌的去除率比pH=5时大得多,其原因是
Ⅱ.甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法,具有工艺简单、成本低等优点。回答下列问题:
(3)已知1000K时,下列反应的平衡常数和反应热:
①CH4(g)
 C(s)+2H2(g) K1=10.2 △H1
C(s)+2H2(g) K1=10.2 △H1②2CO(g)
 C(s)+CO2(g) K2=0.6 △H2
C(s)+CO2(g) K2=0.6 △H2③CO(g)+H2O(g)
 CO2(g)+H2(g) K3=1.4 △H3
CO2(g)+H2(g) K3=1.4 △H3④CH4(g)+2H2O(g)
 CO2(g)+4H2(g) K4△H4(SMR)
CO2(g)+4H2(g) K4△H4(SMR)则1000K时,K4=
(4)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5ppm以下。脱硫的目的为
(5)如图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知△H4

(6)如图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐

您最近一年使用:0次
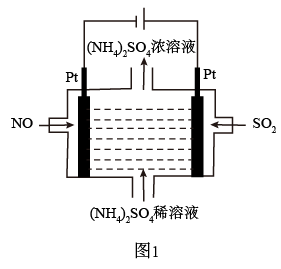
7 . 燃煤烟气中的NOx、SO2经处理后可被吸收。
(1)若烟气主要成分为NO、SO2,可通过电解法除去,其原理如图1所示。阴极的电极反应式为___ 。电解过程得到产物为___ 。
(2)若烟气主要成分为NO2、SO2,可通入NaOH溶液将NO2完全转化为NO 。则NO2、SO2与NaOH反应的离子方程式为
。则NO2、SO2与NaOH反应的离子方程式为___ 。
(3)O3氧化性强于O2,能更有效地氧化NO。
①2NO(g)+O2(g)=2NO2(g)ΔH1=-114kJ·mol-1
2O3(g)=3O2(g)ΔH2=-284.2kJ·mol-1(活化能Ea=119.2kJ·mol-1)
NO(g)+O3(g)=NO2(g)+O2(g)ΔH3=___ kJ·mol-1(活化能Ea=3.2kJ·mol-1)
②NO可经O3处理后再用碱液吸收而实现脱除。为分析氧化时温度对NO脱除率的影响,将NO与O3混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,NO脱除率随NO与O3混合反应时温度变化如图2所示。温度在50~150℃时,随着温度升高,NO脱除率无明显变化;温度超过150℃时,随着温度升高,NO脱除率下降。其可能原因是___ 。

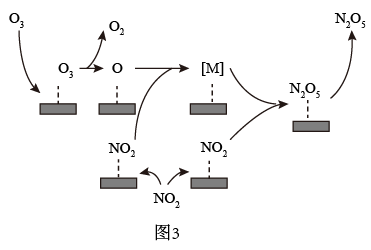
(4)用O3氧化NO2时,使用催化剂可提高氧化效率。研究发现NO2在某催化剂表面被O3氧化时反应机理如图3所示,反应过程中,氮氧化物[M]与NO2按物质的量1∶1反应生成N2O5,[M]的化学式为___ 。该催化氧化过程总反应的化学方程式为___ 。
(1)若烟气主要成分为NO、SO2,可通过电解法除去,其原理如图1所示。阴极的电极反应式为

(2)若烟气主要成分为NO2、SO2,可通入NaOH溶液将NO2完全转化为NO
 。则NO2、SO2与NaOH反应的离子方程式为
。则NO2、SO2与NaOH反应的离子方程式为(3)O3氧化性强于O2,能更有效地氧化NO。
①2NO(g)+O2(g)=2NO2(g)ΔH1=-114kJ·mol-1
2O3(g)=3O2(g)ΔH2=-284.2kJ·mol-1(活化能Ea=119.2kJ·mol-1)
NO(g)+O3(g)=NO2(g)+O2(g)ΔH3=
②NO可经O3处理后再用碱液吸收而实现脱除。为分析氧化时温度对NO脱除率的影响,将NO与O3混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,NO脱除率随NO与O3混合反应时温度变化如图2所示。温度在50~150℃时,随着温度升高,NO脱除率无明显变化;温度超过150℃时,随着温度升高,NO脱除率下降。其可能原因是

(4)用O3氧化NO2时,使用催化剂可提高氧化效率。研究发现NO2在某催化剂表面被O3氧化时反应机理如图3所示,反应过程中,氮氧化物[M]与NO2按物质的量1∶1反应生成N2O5,[M]的化学式为

您最近一年使用:0次
2021-01-07更新
|
286次组卷
|
4卷引用:江苏扬州市2021届高三1月调研考试化学试题



