1 . 化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总△T计算获得。
(1)盐酸浓度的测定:移取20.00mL特测液,加入指示利,用0.500mol/LNaOH溶液滴定至终点消耗NaOH溶液22.00mL。该盐酸浓度为_____ mol/L。
(2)热量的测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为_____ J(c和ρ分别取4.18J/g·℃和1.0g/mL,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4 (aq)=FeSO4(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响,下同)。实验结果见如表。
①温度:b_____ c(填“>”“<”或“=”)。
②△H=_____ (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。
查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是抑制Fe3+水解。
提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和_____ (用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为_____ 。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用_____ 。
(1)盐酸浓度的测定:移取20.00mL特测液,加入指示利,用0.500mol/LNaOH溶液滴定至终点消耗NaOH溶液22.00mL。该盐酸浓度为
(2)热量的测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4 (aq)=FeSO4(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响,下同)。实验结果见如表。
| 反应试剂 | 体系温度/℃ | |||
| 反应前 | 反应后 | |||
| ⅰ | 0.20mol/LCuSO4溶液100mL | 1.20gFe粉 | A | b |
| ⅱ | 0.56gFe粉 | a | C | |
②△H=
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。
查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是抑制Fe3+水解。
提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为
(5)化学能可转化为热能,写出其在生产或生活中的一种应用
您最近一年使用:0次
解题方法
2 . 碘及其化合物在生活中应用广泛。含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列两个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1
反应Ⅱ:HI(aq)=1/2H2(g)+1/2I2(aq) △H2
①反应:SO2(g)+2H2O(1)=H2SO4(aq)+H2(g)的△H=_________ (用△H1、△H2表示)。
②反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq) I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________ 。
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子,写出氯气与碘单质反应的离子方程式:____________ 。
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同PH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附____ (填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________ [用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示]。该方法去除碘离子的原理是________________ 。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列两个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1
反应Ⅱ:HI(aq)=1/2H2(g)+1/2I2(aq) △H2
①反应:SO2(g)+2H2O(1)=H2SO4(aq)+H2(g)的△H=
②反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)
 I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是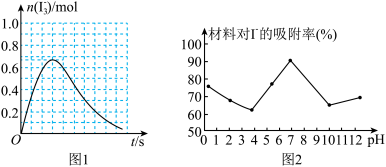
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子,写出氯气与碘单质反应的离子方程式:
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同PH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
您最近一年使用:0次
解题方法
3 . 肼(N2H4)是一种无色油状液体,沸点113.5℃,具有强还原性。能与NaClO剧烈反应生成N2。
(1)N2H4分子中N的化合价为___________
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是___________ 。
(3)由碱性NaClO溶液和尿素 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为___________ (填序号)。
A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为___________ 。
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为___________ 。
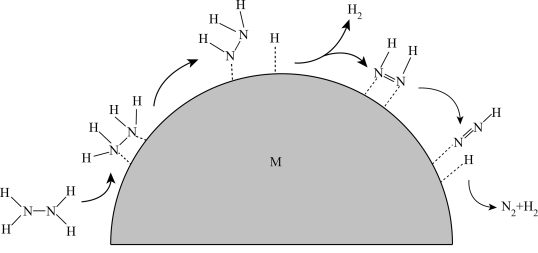
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂___________ 键,形成N2H3、___________ 和N2H等中间产物,直至H原子全部脱去,最终生成___________ 。
(1)N2H4分子中N的化合价为
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是
(3)由碱性NaClO溶液和尿素
 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂

您最近一年使用:0次
4 . 零价纳米铁在环境修复中具有广泛应用,可用来处理地下水中的铼酸根离子( )。
)。
资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。
(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式___ 。
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑
①氮气作用下烘干的目的是___ 。
②每生成1molFe,转移电子数为___ 。
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。
①写出反应的离子方程式___ 。
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是___ 。
③研究表明pH过高或过低会使 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是___ 。
 )。
)。资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO
 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2
 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑①氮气作用下烘干的目的是
②每生成1molFe,转移电子数为
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、
 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。①写出反应的离子方程式
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是
③研究表明pH过高或过低会使
 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是
您最近一年使用:0次
2021-01-22更新
|
331次组卷
|
2卷引用:江苏省徐州市第一中学2021届高三上学期期末考试化学试题
名校
5 . 完成下列问题
(1)已知:①
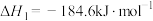
②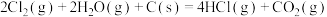
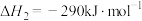
则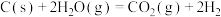

___________ 。
(2)已知:①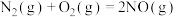
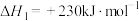
②
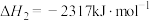
则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

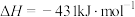 ,则a=
,则a=___________ 。
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(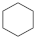 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是___________ ;反应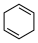 (l)=
(l)=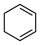 (l)的
(l)的
___________ 。

(1)已知:①
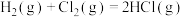
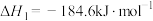
②
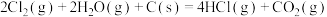
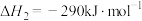
则
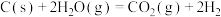

(2)已知:①
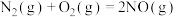
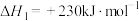
②

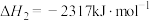
则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

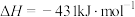 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)= (l)的
(l)的

您最近一年使用:0次
6 . 我国提出“碳达峰”目标是在2030年前达到最高值,2060年前达到“碳中和”。因此,二氧化碳的综合利用尤为重要。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚( )也有广泛的应用。
)也有广泛的应用。
反应Ⅰ:
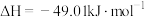
反应Ⅱ:
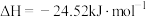
反应Ⅲ:
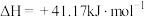
①结合计算分析反应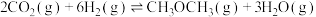 的自发性:
的自发性:___________ 。
②恒压、投料比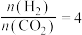 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
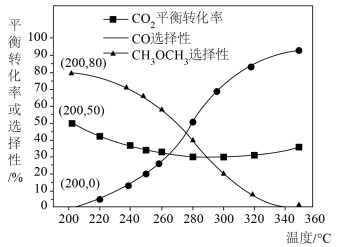
当温度超过 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是___________ 。
③工业实际设计温度一般在 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是___________ 。
(2)研究表明,在电解质水溶液中, 气体可被电化学还原。
气体可被电化学还原。
① 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(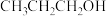 )的电极反应方程式为
)的电极反应方程式为___________ 。
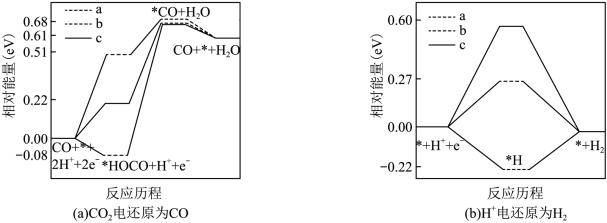
②在电解质水溶液中,三种不同催化剂( 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为___________ (用 、
、 、
、 字母排序)。
字母排序)。
(3) 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷,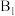 、
、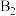 位点带部分负电荷)。
位点带部分负电荷)。

图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为___________ 。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(
 )也有广泛的应用。
)也有广泛的应用。反应Ⅰ:

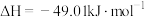
反应Ⅱ:

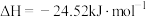
反应Ⅲ:

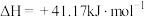
①结合计算分析反应
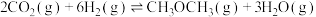 的自发性:
的自发性:②恒压、投料比
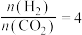 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
当温度超过
 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是③工业实际设计温度一般在
 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是(2)研究表明,在电解质水溶液中,
 气体可被电化学还原。
气体可被电化学还原。①
 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(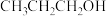 )的电极反应方程式为
)的电极反应方程式为②在电解质水溶液中,三种不同催化剂(
 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为 、
、 、
、 字母排序)。
字母排序)。
(3)
 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷,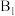 、
、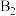 位点带部分负电荷)。
位点带部分负电荷)。
图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为
您最近一年使用:0次
名校
7 . 肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________ 。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________ 。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。
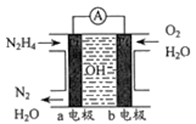
①该电池的负极是______ (填“a”或“b”)电极。
②写出正极的电极反应式:_____________ 。
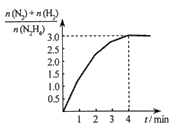
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中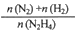 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______ 。

(1)已知肼的球棍模型如图所示,写出肼的电子式:
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是
②写出正极的电极反应式:
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l)
 N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中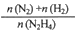 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
您最近一年使用:0次
2018-07-04更新
|
366次组卷
|
3卷引用:【全国百强校】江苏省常熟中学2017-2018学年高一下学期期末调研测试化学试题
名校
解题方法
8 . I.锰是在地壳中广泛分布的元素之一,其单质和化合物在工农业生产中有着重要的作用。已知Al的燃烧热为ΔH=—ckJ·mol—1,金属锰可用铝热法制得。其余相关热化学方程式为:3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) ΔH1 = akJ·mol—1
3MnO2(s)=Mn3O4(s)+O2(g) ΔH2 = b kJ·mol—1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) ΔH3 =__________ kJ·mol—1(用含a、b、c的式子表示)
II.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
(1)电解处理法:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________ (填“阴极”或“阳极”),阳极产生ClO-的电极反应为__________ ,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________ 。

(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH—=4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
①废水中的CN一经以下反应实现转化:CN—+H2O2+H2O=A+NH3↑,则A是__________ (用符号表示)。
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为__________ (a.7-10;b.10-11;c.11-13),解释该pH不宜太大的原因__________ 。
3MnO2(s)=Mn3O4(s)+O2(g) ΔH2 = b kJ·mol—1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) ΔH3 =
II.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
(1)电解处理法:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为

(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH—=4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
①废水中的CN一经以下反应实现转化:CN—+H2O2+H2O=A+NH3↑,则A是
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为

您最近一年使用:0次
名校
9 . Ⅰ.我国要在2030年前实现碳达峰、2060年前实现碳中和的目标, 的捕集与转化是研究的重要课题。
的捕集与转化是研究的重要课题。
(1) 和
和 重整可制合成气
重整可制合成气 和
和 ,其热化学方程式为
,其热化学方程式为
已知下列热化学方程式:
反应1:
反应2:
反应3: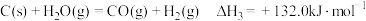
则
___________ 
(2)一种电化学法将 转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。
转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。
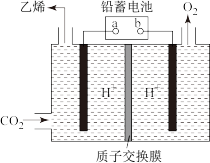
①阴极上的电极反应式为___________ 。
②以铅蓄电池为电源,每生成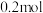 乙烯,理论上需消耗铅蓄电池中的硫酸的物质的量为
乙烯,理论上需消耗铅蓄电池中的硫酸的物质的量为___________ 。
Ⅱ.过量含磷物质的排放会致使水体富营养化,因此发展水体除磷技术非常重要。常用的除磷技术有化学沉淀法,吸附法等。
(3)铁炭混合物在水溶液中形成微电池,铁转化为 进一步被氧化为
进一步被氧化为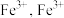 与
与 结合成
结合成 沉淀。铁炭总质量一定,反应时间相同,测得磷去除率随铁炭质量比的变化如图所示。
沉淀。铁炭总质量一定,反应时间相同,测得磷去除率随铁炭质量比的变化如图所示。

①当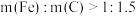 时,随着
时,随着 增加,磷去除率降低,原因是
增加,磷去除率降低,原因是___________ 。
②当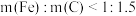 时,随着
时,随着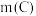 增加,磷去除率也降低。但降低幅度低于
增加,磷去除率也降低。但降低幅度低于 增加时的降低幅度,原因是
增加时的降低幅度,原因是___________ 。
(4)次磷酸根(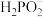 )具有较强的还原性。利用
)具有较强的还原性。利用 联合除去废水中次磷酸根,转化过程如图所示。
联合除去废水中次磷酸根,转化过程如图所示。

①转化(Ⅰ)除生成 和羟基自由基
和羟基自由基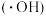 外,还生成一种离子,其化学式为
外,还生成一种离子,其化学式为___________ 。
②利用 联合除去废水中
联合除去废水中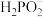 的过程可描述为
的过程可描述为___________ 。
 的捕集与转化是研究的重要课题。
的捕集与转化是研究的重要课题。(1)
 和
和 重整可制合成气
重整可制合成气 和
和 ,其热化学方程式为
,其热化学方程式为
已知下列热化学方程式:
反应1:

反应2:

反应3:
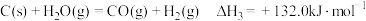
则


(2)一种电化学法将
 转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。
转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。
①阴极上的电极反应式为
②以铅蓄电池为电源,每生成
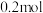 乙烯,理论上需消耗铅蓄电池中的硫酸的物质的量为
乙烯,理论上需消耗铅蓄电池中的硫酸的物质的量为Ⅱ.过量含磷物质的排放会致使水体富营养化,因此发展水体除磷技术非常重要。常用的除磷技术有化学沉淀法,吸附法等。
(3)铁炭混合物在水溶液中形成微电池,铁转化为
 进一步被氧化为
进一步被氧化为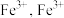 与
与 结合成
结合成 沉淀。铁炭总质量一定,反应时间相同,测得磷去除率随铁炭质量比的变化如图所示。
沉淀。铁炭总质量一定,反应时间相同,测得磷去除率随铁炭质量比的变化如图所示。
①当
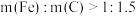 时,随着
时,随着 增加,磷去除率降低,原因是
增加,磷去除率降低,原因是②当
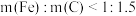 时,随着
时,随着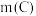 增加,磷去除率也降低。但降低幅度低于
增加,磷去除率也降低。但降低幅度低于 增加时的降低幅度,原因是
增加时的降低幅度,原因是(4)次磷酸根(
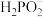 )具有较强的还原性。利用
)具有较强的还原性。利用 联合除去废水中次磷酸根,转化过程如图所示。
联合除去废水中次磷酸根,转化过程如图所示。
①转化(Ⅰ)除生成
 和羟基自由基
和羟基自由基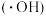 外,还生成一种离子,其化学式为
外,还生成一种离子,其化学式为②利用
 联合除去废水中
联合除去废水中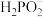 的过程可描述为
的过程可描述为
您最近一年使用:0次
解题方法
10 . 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________ 。
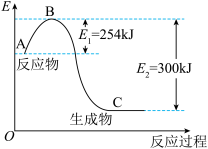
(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
试根据表中及(1)的图中数据计算N—H键的键能为________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________ 。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:

(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近一年使用:0次



