(1)复合氧化物铁酸锰
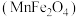 可用于热化学循环分解制氢气,原理如下:
可用于热化学循环分解制氢气,原理如下:①
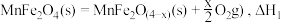
②
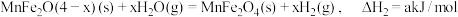
③

则
 的燃烧热
的燃烧热
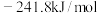 (填>、=或<),
(填>、=或<),
(2)
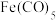 是一种重要的催化剂,制取反应为
是一种重要的催化剂,制取反应为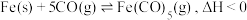 。在
。在 恒容密闭容器中加入足量铁粉和
恒容密闭容器中加入足量铁粉和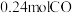 。
。①
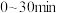 内在T温度下进行反应,测得
内在T温度下进行反应,测得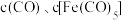 随时间的变化关系,以及
随时间的变化关系,以及 和
和 开始随条件的变化关系如图甲所示。
开始随条件的变化关系如图甲所示。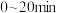 内用
内用 表示的平均反应速率为
表示的平均反应速率为 ;则此温度下的
;则此温度下的
②曲线I代表
 或
或 ]浓度的变化,
]浓度的变化, 时改变的条件是
时改变的条件是 后曲线Ⅱ下降的原因是
后曲线Ⅱ下降的原因是
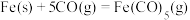 达到平衡状态的是
达到平衡状态的是A.密度保持不变 B.
 体积分数保持不变
体积分数保持不变C.平均摩尔质量保持不变 D.
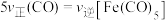
(1)化工燃料重整制氢
已知:

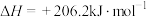

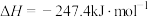
则
 与
与 反应生成
反应生成 和
和 的反应热是
的反应热是 。
。(2)工业副产氢
已知:工业上用水煤气法制氢气,有关化学方程式是:
反应一:


反应二:


①反应一在
 时达到化学平衡状态,则此温度下该反应的平衡常数表达式
时达到化学平衡状态,则此温度下该反应的平衡常数表达式
②在
 时将
时将 和
和 各
各 通入体积为
通入体积为 的密闭容器中反应发生反应二,
的密闭容器中反应发生反应二, 时达到平衡状态,该反应的平衡常数是9,则
时达到平衡状态,该反应的平衡常数是9,则 的转化率是
的转化率是 的浓度变化表示的反应速率
的浓度变化表示的反应速率 是
是 。
。(3)清洁能源电解制氢
已知:利用电解饱和食盐水可制得氢气,下图为电解装置示意图:

 电极是极
电极是极 电极的电极反应式
电极的电极反应式②假设室温条件下电解
 饱和食盐水一段时间,当两极产生的气体共
饱和食盐水一段时间,当两极产生的气体共 (标准状况下)时,溶液的
(标准状况下)时,溶液的 为
为 和
和 作为原料,其能量转化关系如下图:
作为原料,其能量转化关系如下图: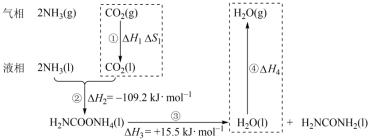

 。下列有关说法正确的是
。下列有关说法正确的是A. |
B.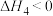 |
C. |
D.过程③反应速率慢,使用合适的催化剂可减小 而加快反应 而加快反应 |
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。
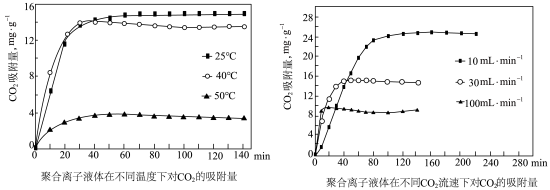
(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
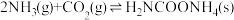
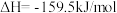
第二步:

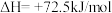
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示: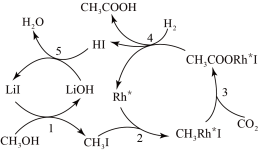
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.
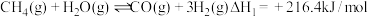
b.

则反应

(2)起始时投入氮气和氢气的物质的量分别为
 、
、 ,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。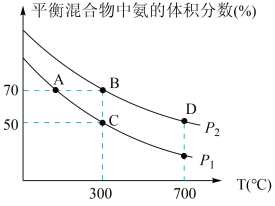
①恒容时,反应一定达到平衡状态的标志是
A.
 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变C.
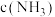 保持不变 D.
保持不变 D.
②

 (填“>”“<”“=”或“不确定”,下同);反应的平衡常数:B点
(填“>”“<”“=”或“不确定”,下同);反应的平衡常数:B点③C点
 的转化率为
的转化率为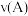
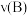 。
。II.用间接电化学法去除烟气中
 的原理如图所示。
的原理如图所示。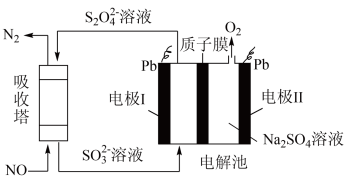
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为
 为
为 时,吸收塔中生成的气体在标准状况下的体积为
时,吸收塔中生成的气体在标准状况下的体积为6 .  (主要指NO和
(主要指NO和 )是大气主要污染物之一、有效去除大气中的
)是大气主要污染物之一、有效去除大气中的 是环境保护的重要课题。回答下列问题:
是环境保护的重要课题。回答下列问题:
(1)用水吸收
 的相关热化学方程式如下:
的相关热化学方程式如下:



反应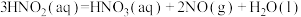 的
的
 。
。
(2)工业上可利用如下反应既可以生产甲醇,又可以降低二氧化碳排放量:
 。若该反应在一定条件能自发进行,判断该反应的△H
。若该反应在一定条件能自发进行,判断该反应的△H(3)在催化剂的作用下
 能与
能与 反应生成
反应生成 。
。① 与
与 生成
生成 的反应中,
的反应中, 的作用
的作用
②在有氧条件下,新型催化剂M能催化 与
与 反应生成
反应生成 。将一定比例的
。将一定比例的 、
、 和
和  的混合气体,匀速通入装有催化剂M的反应器中,反应相同时间
的混合气体,匀速通入装有催化剂M的反应器中,反应相同时间 的去除率随反应温度的变化曲线如图所示。
的去除率随反应温度的变化曲线如图所示。

i.当反应温度高于380℃时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是
(4)氮的氧化物脱除可用电化学原理处理,如图装置可同时吸收
 和NO。已知:
和NO。已知: 是一种弱酸。直流电源的正极为
是一种弱酸。直流电源的正极为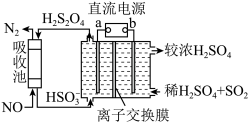
7 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mo)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置
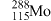 的中子数为
的中子数为已知:
P(s,白磷)=P(s,黑磷) 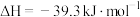 ;
;
P(s,白磷)=P(s,红磷) 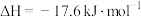 ;
;
由此推知,其中最稳定的磷单质是
(2)氮和磷氢化物性质的比较:
热稳定性:

沸点:
 。
。
(3)
 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与HI反应产物的推断正确的是
与HI反应产物的推断正确的是a.不能与NaOH反应 b.含离子键、共价键 c.其溶液显碱性
(4)
 能发生较强烈的水解,生成难溶的SbOCl,因此,配制
能发生较强烈的水解,生成难溶的SbOCl,因此,配制 溶液应注意
溶液应注意(5)解释碳酸钠溶液显碱性的原因
(1)甲醇是人们开发和利用的一种新能源。已知:
2H2(g)+O2(g)=2H2O(1) △H1=-571.8kJ/mol
CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol
O2(g)=CO2(g)+2H2(g) △H2=-192.9kJ/mol①由上述热化学方程式可知甲醇的燃烧热△H=
②上述第二个反应的能量变化如图所示,则△H2=
(2)已知反应N2(g)+3H2(g)
 2NH3(g),试根据表中所列键能数据估算该反应的△H=
2NH3(g),试根据表中所列键能数据估算该反应的△H=| 化学键 | H-H | N-H | N≡N |
| 键能(kJ/mol) | 436 | 391 | 945 |
(3)1molH2和1molCH4完全燃烧放出的热量分别为286kJ、890kJ,等质量的H2和CH4完全燃烧,放出热量较多的是
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
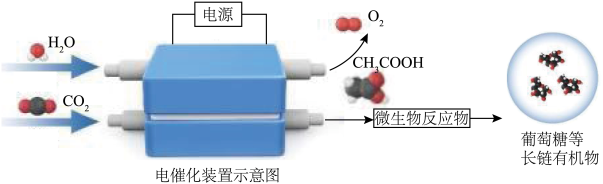
(1)利用二氧化碳合成高浓度乙酸,进一步利用微重物合成葡萄糖等长链有机物。其合成示意图如下,写出生成乙酸的电极反应式
(2)燃料的热值和
 排放量如下表所示
排放量如下表所示| 燃料 |  (l) (l) |  (g) (g) | 煤油 |
热值( ) ) | 22.47 | 50.4 | 29.0 |
 排放量( 排放量( ) ) | 16.5 | 16.2 | 22.9 |
 (l)的燃烧热(△H)为
(l)的燃烧热(△H)为 。
。A.-726.4 B.-1452.8 C.22.7 D.-22.7
②根据上表数据,从
 排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因
排放量和燃料储存两个角度分析,选用甲醇作为主火炬塔燃料的可能原因(3)以
 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一、其反应原理为:
资源化利用的方式之一、其反应原理为:
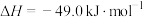 。
。①下图中,曲线
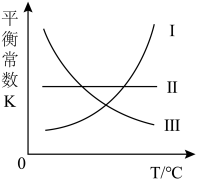
A.I B.Ⅱ C.Ⅲ
②某温度下,向容积为2.0L恒容密闭容器中充入1.0mol
 (g)和3.0mol
(g)和3.0mol (g)模拟上述反应。反应达到平衡状态时,测得
(g)模拟上述反应。反应达到平衡状态时,测得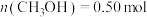 。该温度下,平衡常数K=
。该温度下,平衡常数K=(4)在不同温度下,向等容积的反应器中,分别通入等量、相同比例的
 和
和 的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO:
的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如下图所示。除生成甲醇外,还会生成副产物CO: 
 。
。
①图中一定不处于化学平衡状态的是
A.点A B.点B C.点C D.点D
②已知催化剂对副反应没有影响。图中当温度高于500K,甲醇产率逐渐下降,原因可能有
(1)某科研团队利用Ni-CaO-Fe3O4三元催化剂在850℃下“超干重整”CH4和CO2。
已知:反应I:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH=+247kJ/mol
2CO(g)+2H2(g)ΔH=+247kJ/mol反应Ⅱ:CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH=-41kJ/mol
CO2(g)+H2(g)ΔH=-41kJ/mol则反应Ⅲ:CH4(g)+3CO2(g)
 4CO(g)+2H2O(g)ΔH=
4CO(g)+2H2O(g)ΔH=(2)在容积为1L的刚性容器中进行“合成气催化重整”,反应的化学方程式为:CH4(g)+CO2(g)
 2CO(g)+2H2(g),当投料n(CH4):n(CO2)=1.0时,CO2的平衡转化率(ɑ)与温度(T),初始压强(p)的关系如图所示,压强p1
2CO(g)+2H2(g),当投料n(CH4):n(CO2)=1.0时,CO2的平衡转化率(ɑ)与温度(T),初始压强(p)的关系如图所示,压强p1



