名校
解题方法
1 .  、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
(1) 的VSEPR模型是
的VSEPR模型是______ 。已知 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为______ (填标号)。 B.
B. C.
C. D.
D.
(2)已知,①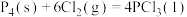
 kJ⋅mol
kJ⋅mol ,
,
②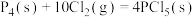
 kJ⋅mol
kJ⋅mol (
(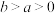 )。
)。
则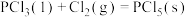

______ (用含a、b、c的式子表示)kJ⋅mol 。
。
(3)实验测得 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为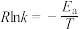 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。 和
和 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下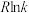 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是______ (填“Cat1”或“Cat2”),判断依据是____________ 。
②将2n mol 和n mol
和n mol 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol  ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为______ (填标号)。
A. mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol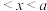 mol
mol
(4)向恒容密闭容器中投入0.2 mol 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。____________ ;曲线c改变的条件可能是____________ 。
②曲线b条件下,该反应平衡常数( )为
)为______ 。[提示:用分压计算的平衡常数为压强平衡常数 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
 、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:(1)
 的VSEPR模型是
的VSEPR模型是 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为
 B.
B. C.
C. D.
D.
(2)已知,①
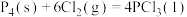
 kJ⋅mol
kJ⋅mol ,
,②
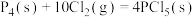
 kJ⋅mol
kJ⋅mol (
(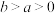 )。
)。则
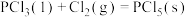

 。
。(3)实验测得
 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。
 和
和 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下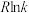 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是②将2n mol
 和n mol
和n mol 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol  ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为A.
 mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol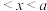 mol
mol(4)向恒容密闭容器中投入0.2 mol
 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
②曲线b条件下,该反应平衡常数(
 )为
)为 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
您最近半年使用:0次
昨日更新
|
172次组卷
|
3卷引用:2024届湘豫名校联考高三第二次模拟考试理综试题-高中化学
2024届湘豫名校联考高三第二次模拟考试理综试题-高中化学(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)2024届江西省吉安市第一中学高三下学期一模化学试题
名校
解题方法
2 . 过渡金属氧化物离子(以MO+表示)在烃类的选择性氧化等方面应用广泛。MO+与CH4反应的过程如下图所示。不正确 的是
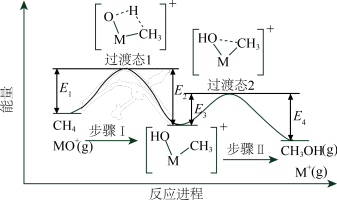
| A.反应速率:步骤I<步骤II |
| B.CH3OH分子中,键角:H—C—H>H—O—C |
| C.若MO+与CH3D反应,生成的氘代甲醇有2种 |
D.CH4(g) + MO+(g)=CH3OH(g) + M+(g)  = E2+E4-E1-E3 = E2+E4-E1-E3 |
您最近半年使用:0次
7日内更新
|
301次组卷
|
3卷引用:北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题
北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)江苏省常州市第一中学2023-2024学年高二下学期4月期中考试化学试题
3 . 第19届杭州亚运会上,“零碳”甲醇火炬彰显了“绿色亚运”的精神。“零碳”甲醇是利用焦炉气副产物 和工业尾气中的
和工业尾气中的 合成,涉及以下反应:
合成,涉及以下反应:
①
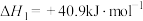
②

③

(1)反应③的 为
为___________  ;有利于反应②自发进行的条件是
;有利于反应②自发进行的条件是___________ (填“低温”或“高温”)。
(2)一定条件下,向容积为V L的恒容密闭容器中通入1mol 和2mol
和2mol 发生上述反应,反应20min时容器内反应达到平衡,容器中CO为
发生上述反应,反应20min时容器内反应达到平衡,容器中CO为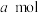 ,
, 为
为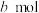 。
。
①以 表示的0~20min内平均反应速率
表示的0~20min内平均反应速率
___________  (用含a、b、V的代数式表示,下同),此时
(用含a、b、V的代数式表示,下同),此时 的浓度为
的浓度为___________  ,反应②的平衡常数为
,反应②的平衡常数为___________ 。
③下列叙述正确的有___________ (填字母)。
A.混合气体的密度不变能表明反应①达到化学平衡状态
B.增大压强,会增大反应②的平衡常数
C.适当提高氢碳比,有利于提高 的平衡产率
的平衡产率
D.适当升高温度,反应①②③的速率均会增大
(3) 优异的
优异的 催化加氢制甲醇性能逐渐受到科研工作者的关注,其晶体结构单元如图所示(
催化加氢制甲醇性能逐渐受到科研工作者的关注,其晶体结构单元如图所示( 之间紧密堆积,
之间紧密堆积, 位于
位于 形成的空隙中且未画出),其中
形成的空隙中且未画出),其中 半径为
半径为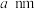 ,晶体结构单元的高为
,晶体结构单元的高为 ,该结构单元含
,该结构单元含 的个数是
的个数是___________ 。已知阿伏加德罗常数的值为 ,则
,则 晶体的摩尔体积
晶体的摩尔体积
___________ 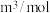 。
。
 和工业尾气中的
和工业尾气中的 合成,涉及以下反应:
合成,涉及以下反应:①

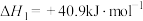
②


③


(1)反应③的
 为
为 ;有利于反应②自发进行的条件是
;有利于反应②自发进行的条件是(2)一定条件下,向容积为V L的恒容密闭容器中通入1mol
 和2mol
和2mol 发生上述反应,反应20min时容器内反应达到平衡,容器中CO为
发生上述反应,反应20min时容器内反应达到平衡,容器中CO为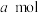 ,
, 为
为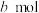 。
。①以
 表示的0~20min内平均反应速率
表示的0~20min内平均反应速率
 (用含a、b、V的代数式表示,下同),此时
(用含a、b、V的代数式表示,下同),此时 的浓度为
的浓度为 ,反应②的平衡常数为
,反应②的平衡常数为③下列叙述正确的有
A.混合气体的密度不变能表明反应①达到化学平衡状态
B.增大压强,会增大反应②的平衡常数
C.适当提高氢碳比,有利于提高
 的平衡产率
的平衡产率D.适当升高温度,反应①②③的速率均会增大
(3)
 优异的
优异的 催化加氢制甲醇性能逐渐受到科研工作者的关注,其晶体结构单元如图所示(
催化加氢制甲醇性能逐渐受到科研工作者的关注,其晶体结构单元如图所示( 之间紧密堆积,
之间紧密堆积, 位于
位于 形成的空隙中且未画出),其中
形成的空隙中且未画出),其中 半径为
半径为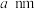 ,晶体结构单元的高为
,晶体结构单元的高为 ,该结构单元含
,该结构单元含 的个数是
的个数是 ,则
,则 晶体的摩尔体积
晶体的摩尔体积
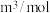 。
。
您最近半年使用:0次
2024高三下·全国·专题练习
4 . 丙烯是有机化工中的重要原料,可用丙烷直接脱氢工艺和丙烷氧化脱氢工艺制备,其主反应和有关物质的燃烧热数据如下。
Ⅰ.丙烷直接脱氢工艺: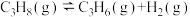 ;
;
Ⅱ.丙烷氧化脱氢工艺: ;
;
回答下列问题:
(1)反应Ⅰ的ΔH=___________ kJ/mol,其自发进行的条件是___________ 。丙烷在不同温度下按照一定流速通过铬催化剂反应相同时间,所得混合物中部分物质的体积分数如下表所示,实际控制温度为580℃,原因是___________ 。
(2)①反应Ⅱ属于自由基反应,其反应历程如下,写出第iv步的反应方程式。
i)C3H6+O2→·C3H7+HO2·
ii)·C3H7+HO2·→C3H6+H2O2
iii)H2O2→2HO·
iv)___________ 。
(3)将3molC3H8、 置于某恒温(高于100℃)、恒压(p)的密闭容器中进行反应Ⅱ时,发生了副反应Ⅲ:C3H8(g)+2O2(g)
置于某恒温(高于100℃)、恒压(p)的密闭容器中进行反应Ⅱ时,发生了副反应Ⅲ:C3H8(g)+2O2(g) CH3CH2OH(g)+CO2(g)+H2O(g)。达平衡时的体积分数φ(C3H6)=40%,φ(CO2)=4%,则
CH3CH2OH(g)+CO2(g)+H2O(g)。达平衡时的体积分数φ(C3H6)=40%,φ(CO2)=4%,则 的选择性为
的选择性为___________ ( 的选择性=
的选择性=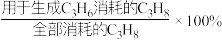 ,计算结果保留3位有效数字),反应Ⅲ的
,计算结果保留3位有效数字),反应Ⅲ的
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)使用惰性电极电解CO2的酸性溶液制丙烯,其装置如下图所示。___________ (填“增大”“减小”或“不变”)。
②X电极的电极反应式为___________ 。
Ⅰ.丙烷直接脱氢工艺:
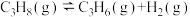 ;
;Ⅱ.丙烷氧化脱氢工艺:
 ;
;| 物质 |  |  | H2 |
燃烧热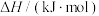 | -2219.9 | -2058.0 | -285.8 |
(1)反应Ⅰ的ΔH=
| 510℃ | 550℃ | 580℃ | 620℃ | |
| 丙烷(%) | 64.82 | 57.87 | 37.76 | 31.91 |
| 丙烯(%) | 12.33 | 15.85 | 22.72 | 23.13 |
| 乙烯(%) | 0.12 | 0.19 | 0.20 | 0.71 |
| 甲烷(%) | 1.50 | 2.78 | 4.03 | 7.31 |
| 氢气(%) | 20.47 | 18.99 | 25.45 | 31.14 |
i)C3H6+O2→·C3H7+HO2·
ii)·C3H7+HO2·→C3H6+H2O2
iii)H2O2→2HO·
iv)
(3)将3molC3H8、
 置于某恒温(高于100℃)、恒压(p)的密闭容器中进行反应Ⅱ时,发生了副反应Ⅲ:C3H8(g)+2O2(g)
置于某恒温(高于100℃)、恒压(p)的密闭容器中进行反应Ⅱ时,发生了副反应Ⅲ:C3H8(g)+2O2(g) CH3CH2OH(g)+CO2(g)+H2O(g)。达平衡时的体积分数φ(C3H6)=40%,φ(CO2)=4%,则
CH3CH2OH(g)+CO2(g)+H2O(g)。达平衡时的体积分数φ(C3H6)=40%,φ(CO2)=4%,则 的选择性为
的选择性为 的选择性=
的选择性=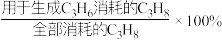 ,计算结果保留3位有效数字),反应Ⅲ的
,计算结果保留3位有效数字),反应Ⅲ的
(4)使用惰性电极电解CO2的酸性溶液制丙烯,其装置如下图所示。

②X电极的电极反应式为
您最近半年使用:0次
2024高三下·全国·专题练习
5 . 完成下列问题
(1)已知:
反应I:N2(g)+O2(g) 2NO(g) ΔH1=akJ/mol
2NO(g) ΔH1=akJ/mol
反应Ⅱ;2NO(g)+O2(g) 2NO2(g) ΔH2=bkJ/mol
2NO2(g) ΔH2=bkJ/mol
反应Ⅲ:2N2O(g) 2N2(g)+O2(g) ΔH3=ckJ/mol
2N2(g)+O2(g) ΔH3=ckJ/mol
反应Ⅳ:N2O(g)+NO2(g) 3NO(g) ΔH=
3NO(g) ΔH=___________ kJ/mol
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体。在密闭容器中充入反应物,测得平衡时NO的体积分数与温度、压强的关系如图。 N2(g)+2CO2(g) ΔH<0,则T1
N2(g)+2CO2(g) ΔH<0,则T1___________ T2(填“>”“=”或“<”)。
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有___________ (答两点即可)。
③在D点,对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的___________ 点。
(3)在催化剂作用下,利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒容,在相同时间内测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒容,在相同时间内测得NO的转化率随温度的变化如图所示:___________ ;在1050K时,CO2的体积分数为___________ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1100K、1.1×106Pa时,该反应的化学平衡常数Kp=___________ [已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(1)已知:
反应I:N2(g)+O2(g)
 2NO(g) ΔH1=akJ/mol
2NO(g) ΔH1=akJ/mol反应Ⅱ;2NO(g)+O2(g)
 2NO2(g) ΔH2=bkJ/mol
2NO2(g) ΔH2=bkJ/mol反应Ⅲ:2N2O(g)
 2N2(g)+O2(g) ΔH3=ckJ/mol
2N2(g)+O2(g) ΔH3=ckJ/mol反应Ⅳ:N2O(g)+NO2(g)
 3NO(g) ΔH=
3NO(g) ΔH=(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体。在密闭容器中充入反应物,测得平衡时NO的体积分数与温度、压强的关系如图。

 N2(g)+2CO2(g) ΔH<0,则T1
N2(g)+2CO2(g) ΔH<0,则T1②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有
③在D点,对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的
(3)在催化剂作用下,利用反应C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒容,在相同时间内测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒容,在相同时间内测得NO的转化率随温度的变化如图所示:
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1100K、1.1×106Pa时,该反应的化学平衡常数Kp=
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
6 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.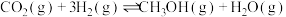
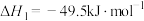
Ⅱ.

Ⅲ.

回答下列问题:
(1)不同压强下,按照 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。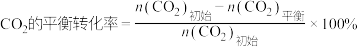
CH3OH的平衡产率=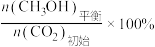
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(2)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
I.
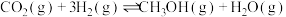
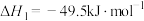
Ⅱ.


Ⅲ.


回答下列问题:
(1)不同压强下,按照
 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。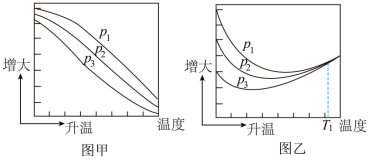
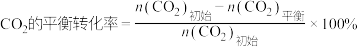
CH3OH的平衡产率=
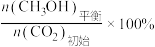
其中纵坐标表示CO2平衡转化率的是图
(2)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
您最近半年使用:0次
2024高三下·全国·专题练习
7 . 尽管NOx、SO2、CO都是有毒气体,但是它们在生产、医学领域中都有重要应用。合理利用或转化CO、NOx等污染性气体是人们共同关注的课题。回答下列问题:
(1)已知:①CO(g)+ H2O(g)=CO2(g)+H2(g) H=-41.0kJ·mol-1
H=-41.0kJ·mol-1
②N2(g)+ O2(g)=2NO(g) H=+ 180.0kJ· mol-1
H=+ 180.0kJ· mol-1
③H2(g)+ O2 (g)=H2O(g)
O2 (g)=H2O(g)  H=- 241.8kJ·mol-l
H=- 241.8kJ·mol-l
CO和NO按一定比例混合,在适当催化剂作用下可生成无毒气体实现安全排放,该反应的热化学方程式为___________ 。
(2)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,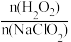 、 溶液pH对脱硫脱硝的影响如图所示:
、 溶液pH对脱硫脱硝的影响如图所示:___________ 。
②根据图示SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是___________ 。
(1)已知:①CO(g)+ H2O(g)=CO2(g)+H2(g)
 H=-41.0kJ·mol-1
H=-41.0kJ·mol-1②N2(g)+ O2(g)=2NO(g)
 H=+ 180.0kJ· mol-1
H=+ 180.0kJ· mol-1③H2(g)+
 O2 (g)=H2O(g)
O2 (g)=H2O(g)  H=- 241.8kJ·mol-l
H=- 241.8kJ·mol-lCO和NO按一定比例混合,在适当催化剂作用下可生成无毒气体实现安全排放,该反应的热化学方程式为
(2)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,
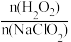 、 溶液pH对脱硫脱硝的影响如图所示:
、 溶液pH对脱硫脱硝的影响如图所示:
②根据图示SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
8 . I、 的资源化可以推动经济高质量发展和生态环境质量的持续改善,回答下列问题:
的资源化可以推动经济高质量发展和生态环境质量的持续改善,回答下列问题:
(1) 和
和 都是主要的温室气体。发生催化重整反应
都是主要的温室气体。发生催化重整反应

已知 时,相关物质的燃烧热数据如下表:
时,相关物质的燃烧热数据如下表:
反应的
___________ 
(2)在恒温恒容装置中通入等体积 和
和 ,发生上述反应,起始压强为p,
,发生上述反应,起始压强为p, 的平衡转化率为
的平衡转化率为 。达平衡时,容器内总压为
。达平衡时,容器内总压为___________ 。该反应的平衡常数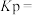
___________ (用平衡分压代替平衡浓度计算,分压 总压×物质的量分数,用
总压×物质的量分数,用 、
、 表达,并化为最简式)。
表达,并化为最简式)。
 的资源化可以推动经济高质量发展和生态环境质量的持续改善,回答下列问题:
的资源化可以推动经济高质量发展和生态环境质量的持续改善,回答下列问题:(1)
 和
和 都是主要的温室气体。发生催化重整反应
都是主要的温室气体。发生催化重整反应

已知
 时,相关物质的燃烧热数据如下表:
时,相关物质的燃烧热数据如下表:| 物质 |  |  |  |
燃烧热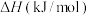 |  |  |  |


(2)在恒温恒容装置中通入等体积
 和
和 ,发生上述反应,起始压强为p,
,发生上述反应,起始压强为p, 的平衡转化率为
的平衡转化率为 。达平衡时,容器内总压为
。达平衡时,容器内总压为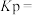
 总压×物质的量分数,用
总压×物质的量分数,用 、
、 表达,并化为最简式)。
表达,并化为最简式)。
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
9 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。我国科学家研究 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
反应I.
反应II.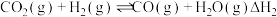
反应III.
(1)有利于提高甲醇平衡产率的措施有___________ (至少回答2条)。
(2)T℃时,将 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应II和反应III:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应II和反应III:
反应II:
反应III: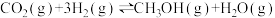
反应达到平衡状态时, 和
和 的分压相等,甲醇的选择性是
的分压相等,甲醇的选择性是 的2倍,则
的2倍,则 的平衡转化率为
的平衡转化率为___________ 。
 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:反应I.

反应II.
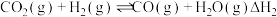
反应III.

(1)有利于提高甲醇平衡产率的措施有
(2)T℃时,将
 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应II和反应III:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应II和反应III:反应II:

反应III:
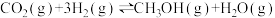
反应达到平衡状态时,
 和
和 的分压相等,甲醇的选择性是
的分压相等,甲醇的选择性是 的2倍,则
的2倍,则 的平衡转化率为
的平衡转化率为
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
10 . CO2-CH4干气重整反应制合成气(H2、CO)是CO2资源化利用的重要研究方向。其反应主要包括:
反应I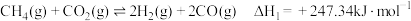
反应II
(1)已知 H2(g)、CO(g)的燃烧热分别为285.8 kJ∙mol-1和283kJ∙mol-1,水的汽化热为44kJ∙mol-1,则 =
=___________ kJ∙mol-1;能同时提高CH4(g)的平衡转化率和反应速率的措施为___________ (写一条即可)。
反应I
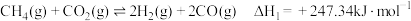
反应II

(1)已知 H2(g)、CO(g)的燃烧热分别为285.8 kJ∙mol-1和283kJ∙mol-1,水的汽化热为44kJ∙mol-1,则
 =
=
您最近半年使用:0次



