名校
1 . 电催化还原CO2是当今资源化利用二氧化碳的重点课题。
(1)利用CO2合成淀粉
①
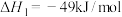
②
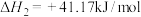
③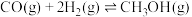

___________ (填“高温自发”“低温自发”或“任何温度下都自发”)。
(2)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示.控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示.___________ 。
②控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
③科研小组利用13CO2代替原有的CO2进行研究,其目的是___________ 。
(3)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色.写出Cu2O还原HAuCl4的离子方程式:___________ 。
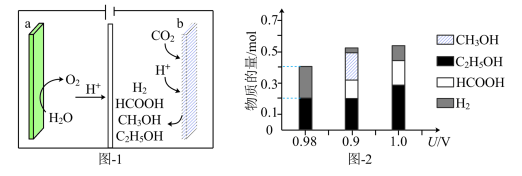
(4)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图4所示。___________ 。
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是___________ 。
(1)利用CO2合成淀粉
①

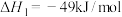
②

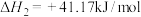
③
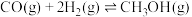

(2)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示.控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示.
②控制电压为0.8V,电解时转移电子的物质的量为
③科研小组利用13CO2代替原有的CO2进行研究,其目的是
(3)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色.写出Cu2O还原HAuCl4的离子方程式:
(4)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图4所示。
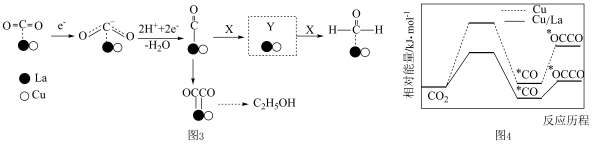
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是
您最近半年使用:0次
名校
2 . 完成下列填空:
(1)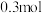 气态高能燃料乙硼烷
气态高能燃料乙硼烷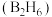 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:___________ ;
(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应:
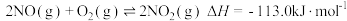 ①
①
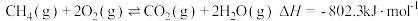 ②
②
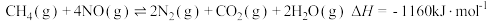 ③
③
则反应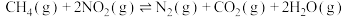 的
的
___________ 。
(3)天然气的一个重要用途是制取 ,其原理为:
,其原理为: 。
。
①该反应的平衡常数表达式为___________ 。
②在密闭容器中通入物质的量浓度均为 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1_______ P2(填"大于”或“小于”);压强为 时,在
时,在 点:v(正)
点:v(正)______ v(逆)(填“大于”、“小于”或“等于”)。 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以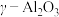 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,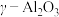 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是___________ 。240℃以后,随着温度的升高, 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是___________ 。 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:
Ⅰ:
Ⅱ:
当 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是___________ 。
(1)
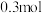 气态高能燃料乙硼烷
气态高能燃料乙硼烷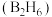 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为
 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应: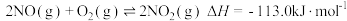 ①
①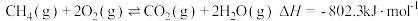 ②
②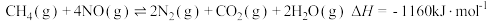 ③
③则反应
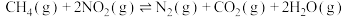 的
的
(3)天然气的一个重要用途是制取
 ,其原理为:
,其原理为: 。
。①该反应的平衡常数表达式为
②在密闭容器中通入物质的量浓度均为
 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1 时,在
时,在 点:v(正)
点:v(正)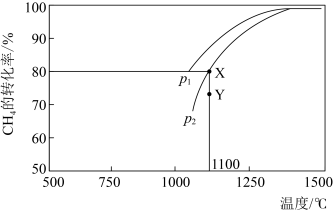
 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以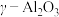 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,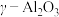 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是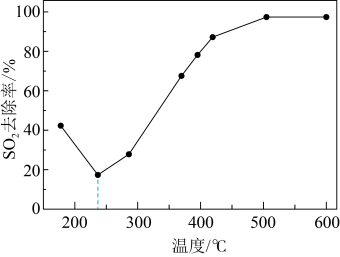
 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:Ⅰ:

Ⅱ:

当
 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是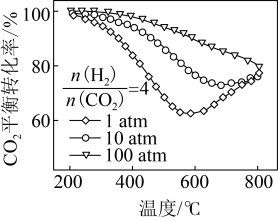
您最近半年使用:0次
3 . 碳资源的合理利用和控制储存具有重要意义。
(1)工业上制备甲醇的主要反应有:
反应Ⅰ. 平衡常数K1
平衡常数K1
反应Ⅱ.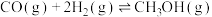 平衡常数K2
平衡常数K2
反应Ⅲ.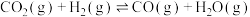 平衡常数K3
平衡常数K3
K3=___________ 。(用K1、K2表示)
(2)乙烷直接热解脱氢制乙烯。热化学方程式为: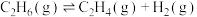 △H
△H
△H=___________ kJ∙mol-1 (填数值,相关键能数据如下表)。
(3)已知草酸( )为二元弱酸,
)为二元弱酸, 、
、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
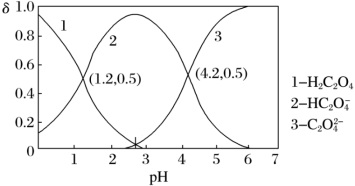
①用已知浓度的酸性KMnO4溶液滴定未知浓度草酸溶液,终点判断:当滴入最后半滴KMnO4溶液时,___________ ,停止滴定,并记录KMnO4溶液的体积,重复操作2~3次。
②硫酸酸化的KMnO4溶液滴定H2C2O4溶液的离子方程式为___________ 。
③结合图中信息,pH=2.7的溶液中: =
=___________ 。(填数值)
(1)工业上制备甲醇的主要反应有:
反应Ⅰ.
 平衡常数K1
平衡常数K1反应Ⅱ.
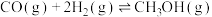 平衡常数K2
平衡常数K2反应Ⅲ.
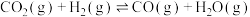 平衡常数K3
平衡常数K3K3=
(2)乙烷直接热解脱氢制乙烯。热化学方程式为:
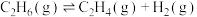 △H
△H△H=
| 化学键 |  |  |  |  |
键能/ | 348 | 615 | 413 | 436 |
(3)已知草酸(
 )为二元弱酸,
)为二元弱酸, 、
、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
①用已知浓度的酸性KMnO4溶液滴定未知浓度草酸溶液,终点判断:当滴入最后半滴KMnO4溶液时,
②硫酸酸化的KMnO4溶液滴定H2C2O4溶液的离子方程式为
③结合图中信息,pH=2.7的溶液中:
 =
=
您最近半年使用:0次
名校
解题方法
4 . 阅读下列材料,完成6~8题:氯气及含氯物质在生产生活中具有广泛的应用。Deacon催化氧化法将HCl转化为Cl2的反应为: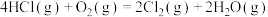

研究发现CuCl2(s)催化反应的过程如下:
反应ⅰ: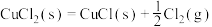

反应ⅱ:

反应ⅲ:……
下列关于Deacon催化氧化法制Cl2的说法正确的是
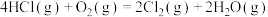

研究发现CuCl2(s)催化反应的过程如下:
反应ⅰ:
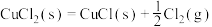

反应ⅱ:


反应ⅲ:……
下列关于Deacon催化氧化法制Cl2的说法正确的是
| A.总反应中反应物的总键能大于生成物的总键能 |
B.反应ⅰ的平衡常数可表示为 |
C.反应ⅱ中,生成22.4L  转移2mol 转移2mol 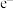 |
D.推断反应ⅲ应为 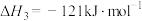 |
您最近半年使用:0次
名校
解题方法
5 . NOx(主要指NO和NO2)和SO2是大气主要污染物。有效去除大气中的NOx和SO2是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=-116.1kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=_______ kJ·mol-1。
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物S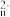 ,S
,S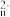 容易被继续氧化而生成硫单质。
容易被继续氧化而生成硫单质。

①阳极HS-氧化为S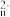 的电极反应式为
的电极反应式为_______ 。
②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是_______ 。
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式_______ 。
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。
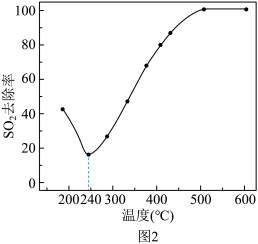
240℃以前,随着温度的升高,SO2去除率降低的原因是_______ 。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是_______ 。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=-116.1kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物S
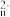 ,S
,S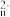 容易被继续氧化而生成硫单质。
容易被继续氧化而生成硫单质。
①阳极HS-氧化为S
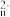 的电极反应式为
的电极反应式为②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。

240℃以前,随着温度的升高,SO2去除率降低的原因是
您最近半年使用:0次
名校
解题方法
6 . 完成下列问题
(1)工厂烟气(主要污染物 、
、 )直接排放会造成空气污染,需处理后才能排放。用
)直接排放会造成空气污染,需处理后才能排放。用 氧化。
氧化。 氧化过程中部分反应的能量变化如图所示。
氧化过程中部分反应的能量变化如图所示。
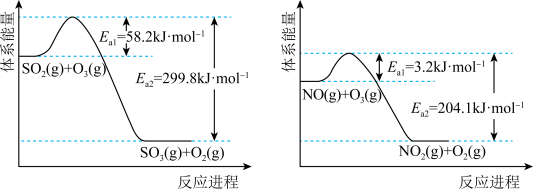
①已知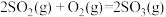
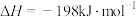 。则
。则 转化为
转化为 的热化学方程式为
的热化学方程式为___________ 。
②其他条件不变时,反应过渡态所需能量越高,反应越难进行,速率越慢。增加 ,
, 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是_______ 。
(2)利用如图1装置可将 转化为
转化为 ,变废为宝,分别在两极通入
,变废为宝,分别在两极通入 和
和 ,溶液中
,溶液中 向
向______ 极(填“A”或“B”)移动,请写出正极的电极反应式为_______ ,该电池总反应方程式为_______ 。
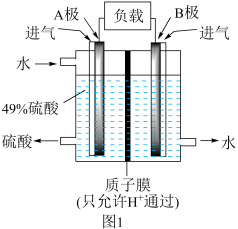
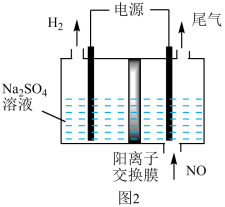
(3)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图2所示(均为石墨电极),电解过程中NO转化为硝酸,请写出阳极的电极反应式为_______ ;电解总反应方程式为______ 。
(4)电解产生的氢气在标准状况下的体积为33.6L,生成的稀硝酸和足量的硫酸混合最多可溶解的铜的质量为______ 。(写出计算过程)
(1)工厂烟气(主要污染物
 、
、 )直接排放会造成空气污染,需处理后才能排放。用
)直接排放会造成空气污染,需处理后才能排放。用 氧化。
氧化。 氧化过程中部分反应的能量变化如图所示。
氧化过程中部分反应的能量变化如图所示。
①已知
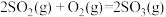
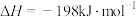 。则
。则 转化为
转化为 的热化学方程式为
的热化学方程式为②其他条件不变时,反应过渡态所需能量越高,反应越难进行,速率越慢。增加
 ,
, 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是(2)利用如图1装置可将
 转化为
转化为 ,变废为宝,分别在两极通入
,变废为宝,分别在两极通入 和
和 ,溶液中
,溶液中 向
向
(3)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图2所示(均为石墨电极),电解过程中NO转化为硝酸,请写出阳极的电极反应式为

(4)电解产生的氢气在标准状况下的体积为33.6L,生成的稀硝酸和足量的硫酸混合最多可溶解的铜的质量为
您最近半年使用:0次
名校
7 . 完成下列问题
(1)已知:①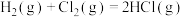
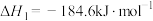
②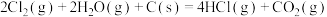
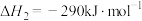
则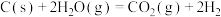

___________ 。
(2)已知:①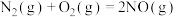
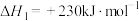
②
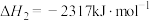
则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

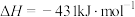 ,则a=
,则a=___________ 。
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(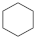 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是___________ ;反应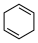 (l)=
(l)=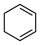 (l)的
(l)的
___________ 。

(1)已知:①
②
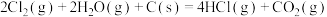
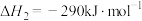
则
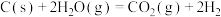

(2)已知:①
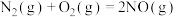
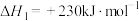
②

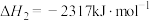
则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

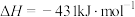 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)= (l)的
(l)的

您最近半年使用:0次
名校
解题方法
8 . 载人飞船中通过如下过程实现 再生:
再生:
①
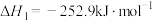
②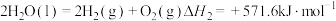
下列说法错误的是
 再生:
再生:①

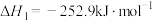
②
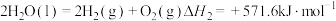
下列说法错误的是
A. 的燃烧热 的燃烧热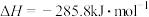 |
B.反应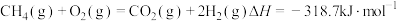 |
C.反应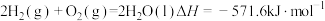 |
D.反应 |
您最近半年使用:0次
名校
9 . 研究废气、废水中污染物处理的有效措施是环保领域的重要课题。
Ⅰ、 是空气的主要污染物之一,有效去除大气中的
是空气的主要污染物之一,有效去除大气中的 可以保护大气环境。
可以保护大气环境。
(1)空气中污染物NO可在催化剂作用下用 还原。
还原。
已知: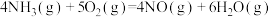
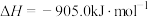
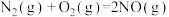

有氧条件下, 与NO反应生成
与NO反应生成 ,相关热化学方程式为
,相关热化学方程式为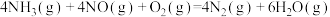

___________ 
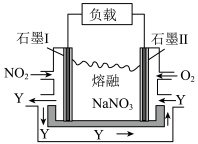
(2)工业上含氮污染物处理以 、
、 、熔融
、熔融 组成的燃料电池装置如题图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为
组成的燃料电池装置如题图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为___________ 。
Ⅱ、在水溶液中,Cr(Ⅲ)以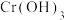 形态存在;Cr(Ⅵ)主要以
形态存在;Cr(Ⅵ)主要以 和形态存在,其毒性是Cr(Ⅲ)的100倍。处理含Cr废水的常用方法是先将其转化为Cr(Ⅲ),再进一步将
和形态存在,其毒性是Cr(Ⅲ)的100倍。处理含Cr废水的常用方法是先将其转化为Cr(Ⅲ),再进一步将 转化为
转化为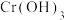 沉淀,减少水体中总铬含量。
沉淀,减少水体中总铬含量。
(3)Cr(Ⅵ)在水溶液中常有 和
和 两种存在形式,加酸可以使
两种存在形式,加酸可以使 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(4) 可用于直接还原去除废水中的
可用于直接还原去除废水中的 ,反应时消耗大量
,反应时消耗大量 。废水的初始pH对去除溶液中的Cr(Ⅵ)和总Cr的影响关系如题图所示:
。废水的初始pH对去除溶液中的Cr(Ⅵ)和总Cr的影响关系如题图所示:

①废水初始pH=2时,Cr(Ⅵ)的去除率达到100%,总Cr的去除率为0%,其原因是___________ 。
②氢化铝锂( )、硼氢化钠(
)、硼氢化钠( )在有机合成中应用广泛。还原能力(单位质量转移电子数):
)在有机合成中应用广泛。还原能力(单位质量转移电子数):
___________  (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
③ 是一种应用广泛的强还原剂,在热水中生成硼酸钠和氢气,反应如下:
是一种应用广泛的强还原剂,在热水中生成硼酸钠和氢气,反应如下:
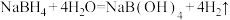 。
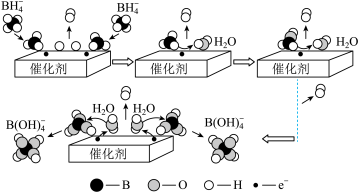
。 在催化剂作用下与水反应获得
在催化剂作用下与水反应获得 的微观过程如题图所示,若将
的微观过程如题图所示,若将 中的H全部用D(重氢原子)代替,请根据上图结合相关方程式描述生成
中的H全部用D(重氢原子)代替,请根据上图结合相关方程式描述生成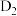 气体这一步的微观过程:
气体这一步的微观过程:___________ 。
Ⅰ、
 是空气的主要污染物之一,有效去除大气中的
是空气的主要污染物之一,有效去除大气中的 可以保护大气环境。
可以保护大气环境。(1)空气中污染物NO可在催化剂作用下用
 还原。
还原。已知:
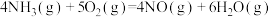
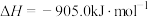
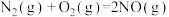

有氧条件下,
 与NO反应生成
与NO反应生成 ,相关热化学方程式为
,相关热化学方程式为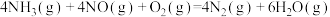


(2)工业上含氮污染物处理以
 、
、 、熔融
、熔融 组成的燃料电池装置如题图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为
组成的燃料电池装置如题图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为
Ⅱ、在水溶液中,Cr(Ⅲ)以
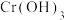 形态存在;Cr(Ⅵ)主要以
形态存在;Cr(Ⅵ)主要以 和形态存在,其毒性是Cr(Ⅲ)的100倍。处理含Cr废水的常用方法是先将其转化为Cr(Ⅲ),再进一步将
和形态存在,其毒性是Cr(Ⅲ)的100倍。处理含Cr废水的常用方法是先将其转化为Cr(Ⅲ),再进一步将 转化为
转化为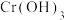 沉淀,减少水体中总铬含量。
沉淀,减少水体中总铬含量。(3)Cr(Ⅵ)在水溶液中常有
 和
和 两种存在形式,加酸可以使
两种存在形式,加酸可以使 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(4)
 可用于直接还原去除废水中的
可用于直接还原去除废水中的 ,反应时消耗大量
,反应时消耗大量 。废水的初始pH对去除溶液中的Cr(Ⅵ)和总Cr的影响关系如题图所示:
。废水的初始pH对去除溶液中的Cr(Ⅵ)和总Cr的影响关系如题图所示:
①废水初始pH=2时,Cr(Ⅵ)的去除率达到100%,总Cr的去除率为0%,其原因是
②氢化铝锂(
 )、硼氢化钠(
)、硼氢化钠( )在有机合成中应用广泛。还原能力(单位质量转移电子数):
)在有机合成中应用广泛。还原能力(单位质量转移电子数):
 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)③
 是一种应用广泛的强还原剂,在热水中生成硼酸钠和氢气,反应如下:
是一种应用广泛的强还原剂,在热水中生成硼酸钠和氢气,反应如下: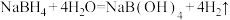 。
。 在催化剂作用下与水反应获得
在催化剂作用下与水反应获得 的微观过程如题图所示,若将
的微观过程如题图所示,若将 中的H全部用D(重氢原子)代替,请根据上图结合相关方程式描述生成
中的H全部用D(重氢原子)代替,请根据上图结合相关方程式描述生成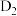 气体这一步的微观过程:
气体这一步的微观过程:
您最近半年使用:0次
名校
10 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于放热反应的是_____ (填字母)。
A. 碳与水蒸气反应
B. 铝和氧化铁反应
C. CaCO3受热分解
D. 氢气还原三氧化钨制取钨
E. 锌与盐酸反应
(2)获取能量变化的途径
①已知:
则:SiCl4(g)+2H2(g)= Si(s)+4HCl(g)的反应热
_____ 
②已知在常温常压下:
i、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)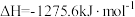
ii、H2O(l)=H2O(g)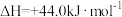
写出表示甲醇燃烧热的热化学方程式_____ 。
(3)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为____________ 。
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。
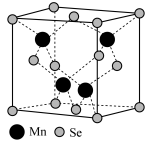
①β-MnSe中Mn的配位数为_______ 。
②Mn2+的价电子排布式为_______ 。
(1)下列反应中,属于放热反应的是
A. 碳与水蒸气反应
B. 铝和氧化铁反应
C. CaCO3受热分解
D. 氢气还原三氧化钨制取钨
E. 锌与盐酸反应
(2)获取能量变化的途径
①已知:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能(kJ·mol-1) | 460 | 360 | 436 | 431 | 176 | 347 |


②已知在常温常压下:
i、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)
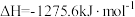
ii、H2O(l)=H2O(g)
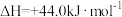
写出表示甲醇燃烧热的热化学方程式
(3)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。

①β-MnSe中Mn的配位数为
②Mn2+的价电子排布式为
您最近半年使用:0次



