名校
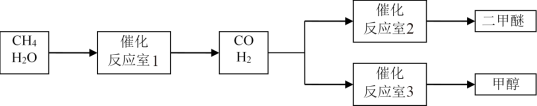
1 . 以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____ 。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____ 。
(3)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如图所示。
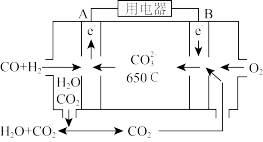
①该电池的正极反应式为______________ 。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为______ L(标准状况)。

已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=
(3)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如图所示。

①该电池的正极反应式为
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为
您最近一年使用:0次
名校
2 . 能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是______ (填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
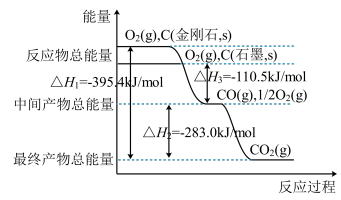
由上图可知,在通常状况下,金刚石和石墨中___ (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__ kJ·mol−1
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol−1、497 kJ·mol−1,N2(g)+O2(g)=2NO(g) ΔH=180.0 kJ·mol−1。NO分子中化学键的键能为_____ kJ·mol−1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:________ 。
(1)下列做法有助于能源“开源节流”的是
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
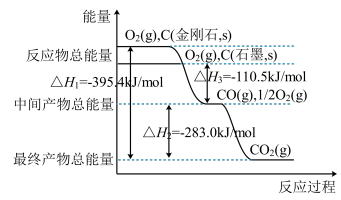
由上图可知,在通常状况下,金刚石和石墨中
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol−1、497 kJ·mol−1,N2(g)+O2(g)=2NO(g) ΔH=180.0 kJ·mol−1。NO分子中化学键的键能为
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:
您最近一年使用:0次
2019-05-05更新
|
694次组卷
|
3卷引用:江苏省大丰市新丰中学2018-2019学年高二下学期期中考试化学试题
3 . 依据下列热化学反应方程式作出的判断正确的是
①CH4(g) + O2(g)= CO (g)+ 2H2O(g)
O2(g)= CO (g)+ 2H2O(g)  H1 = a kJ·mol-1
H1 = a kJ·mol-1
②CH4 (g)+ 2O2(g)= CO2(g) + 2H2O(g) H2 = b kJ·mol-1
H2 = b kJ·mol-1
③C (s)+ O2 (g) = CO (g)
O2 (g) = CO (g)  H3= c kJ·mol-1
H3= c kJ·mol-1
④H2 (g)+ O2 (g)=H2O (l)
O2 (g)=H2O (l)  H4 =d kJ·mol-1
H4 =d kJ·mol-1
①CH4(g) +
 O2(g)= CO (g)+ 2H2O(g)
O2(g)= CO (g)+ 2H2O(g)  H1 = a kJ·mol-1
H1 = a kJ·mol-1②CH4 (g)+ 2O2(g)= CO2(g) + 2H2O(g)
 H2 = b kJ·mol-1
H2 = b kJ·mol-1③C (s)+
 O2 (g) = CO (g)
O2 (g) = CO (g)  H3= c kJ·mol-1
H3= c kJ·mol-1④H2 (g)+
 O2 (g)=H2O (l)
O2 (g)=H2O (l)  H4 =d kJ·mol-1
H4 =d kJ·mol-1| A.a>b |
| B.a + c<b |
C.2CO (g)+O2 (g) =2CO2 (g)的 H =(b-a)kJ·mol-1 H =(b-a)kJ·mol-1 |
D.CO (g) + H2O (g)=CO2 (g)+H2 (g)的 H =(b-a-d)kJ·mol-1 H =(b-a-d)kJ·mol-1 |
您最近一年使用:0次
名校
4 . 已知反应A+B C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是

 C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是
| A.产物C的能量高于反应物的总能量 |
| B.若该反应中有电子得失,则可设计成原电池 |
| C.反应物的总能量低于生成物的总能量 |
| D.该反应中的反应物A和B的转化率一定相同 |
您最近一年使用:0次
2018-06-16更新
|
290次组卷
|
5卷引用:江苏省东台中学、安丰中学2019-2020学年高一下学期期中联考化学试题
真题
名校
5 . NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=___________ kJ·mol−1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________ 。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:____________________________________ 。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为__________ mol。
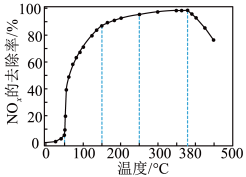
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________ ;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________ 。
 。
。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是
 。
。
您最近一年使用:0次
2018-06-10更新
|
4885次组卷
|
8卷引用:江苏省盐城市田家炳中学2019届高三上学期开学考试化学试题
名校
6 . 化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧示意图和相关热化学反应如下:
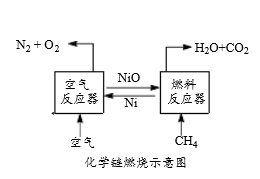
2Ni(s)+O2(g)=2NiO(s) △H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s) △H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S) △H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) △H=156.9 kJ·mol-1
下列说法错误的是( )

2Ni(s)+O2(g)=2NiO(s) △H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s) △H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S) △H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) △H=156.9 kJ·mol-1
下列说法错误的是( )
| A.CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1 |
| C.甲烷在“燃料反应器”中反应时产生淡蓝色火焰并放出热量 |
| D.含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收 |
您最近一年使用:0次
2018-05-17更新
|
309次组卷
|
5卷引用:【全国市级联考】江苏省盐城市2018届高三第三次模拟考试化学试题
【全国市级联考】江苏省盐城市2018届高三第三次模拟考试化学试题(已下线)2018年高考题及模拟题汇编 专题07 化学反应中的能量变化(已下线)高考母题题源05 化学反应与能量江西省抚州市临川二中、临川二中实验学校2020届高三上学期第三次月考化学试题2020届高三化学二轮冲刺新题专练——盖斯定律的应用2
7 . NH3是一种重要的化工原料,可用来制备肼、硝酸、硝酸铵和氯胺等。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2 2NH3,测得平衡体系中NH3的物质的量分数如图。
2NH3,测得平衡体系中NH3的物质的量分数如图。

①下列途径可提高氨气产率的是_____ (填序号)。
a.采用常温条件 b.采用适当的催化剂 c.将原料气加压 d.将氨液化,不断移去液氨
②上图中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1___ (选填“>”或“<”或“=”)K2。
(2)肼(N2H4)是一种火箭燃料。已知:N2(g)+2O2(g)=2NO2(g) ∆H=+67.7kJ·mol-1
N2H4(g)+O2g)=N2(g)+2H2O(g) ∆H =-534.0 kJ·mol-1
NO2(g)=1/2N2O4(g) ∆H =-28.0 kJ·mol-1
①反应2N2H4(g)+ N2O4(g)=3N2(g) + 4H2O(g)的∆H =_____ kJ·mol-1。
②氨气与次氯酸钠溶液反应生成肼的离子方程式为_________ 。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。

①阴极的电极反应式为__________ 。
②将电解生成的HNO3全部转化为NH4NO3, 则通入的NH3与实际参加反应的NO的物质的量之比至少为_________ 。
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果,其原因是_____________ 。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2
 2NH3,测得平衡体系中NH3的物质的量分数如图。
2NH3,测得平衡体系中NH3的物质的量分数如图。
①下列途径可提高氨气产率的是
a.采用常温条件 b.采用适当的催化剂 c.将原料气加压 d.将氨液化,不断移去液氨
②上图中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1
(2)肼(N2H4)是一种火箭燃料。已知:N2(g)+2O2(g)=2NO2(g) ∆H=+67.7kJ·mol-1
N2H4(g)+O2g)=N2(g)+2H2O(g) ∆H =-534.0 kJ·mol-1
NO2(g)=1/2N2O4(g) ∆H =-28.0 kJ·mol-1
①反应2N2H4(g)+ N2O4(g)=3N2(g) + 4H2O(g)的∆H =
②氨气与次氯酸钠溶液反应生成肼的离子方程式为
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。

①阴极的电极反应式为
②将电解生成的HNO3全部转化为NH4NO3, 则通入的NH3与实际参加反应的NO的物质的量之比至少为
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果,其原因是
您最近一年使用:0次
8 . 乙炔和电石(CaC2)都是重要的化工原料。
(1)电石可由焦炭与氧化钙固体在电炉中高温制得,同时生成一氧化碳气体。
①每生成1.00g固态CaC2吸收7.25kJ的热量,该制备反应的热化学方程式为___________ 。
②CaC2与H2O反应的化学方程式为___________ 。
③炼钢时可用电石将钢水中FeO转变为铁,同时有一氧化碳等物质生成,该反应的化学方程式为___________ 。
(2)已知下列反应:
CH4 (g)+ 2O2(g) = CO2(g) + 2H2O(g) H1 = akJ·mol-1
H1 = akJ·mol-1
2C2H2(g)+ 5O2(g) = 4CO2(g) + 2H2O(g) H2 = bkJ·mol-1
H2 = bkJ·mol-1
2H2(g) + O2(g) =2H2O(g) H3= ckJ·mol-1
H3= ckJ·mol-1
2CH4(g) = C2H2(g) + 3H2(g) H4
H4
① H4 =
H4 =___________ kJ·mol-1(用含a、b、c的代数式表示)。
②已知下列键能数据:
则 H4 =
H4 =___________ kJ·mol-1(填数值)。
(3)在压强为1×105kPa的恒压密闭容器中充入1mol乙炔和1molHCl气体,加入催化剂,乙炔与HCl发生反应:HC≡CH(g)+HCl(g) CH2=CHCl(g),乙炔的平衡转化率与温度的关系如下图所示:
CH2=CHCl(g),乙炔的平衡转化率与温度的关系如下图所示:
①该反应的 H
H___________ 0(填“>”或“<”),N点时乙炔的反应速率v(正)___________ v(逆) (填“>”、“<”或“=”)。
②M点对应温度的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并注明单位)
(1)电石可由焦炭与氧化钙固体在电炉中高温制得,同时生成一氧化碳气体。
①每生成1.00g固态CaC2吸收7.25kJ的热量,该制备反应的热化学方程式为
②CaC2与H2O反应的化学方程式为
③炼钢时可用电石将钢水中FeO转变为铁,同时有一氧化碳等物质生成,该反应的化学方程式为
(2)已知下列反应:
CH4 (g)+ 2O2(g) = CO2(g) + 2H2O(g)
 H1 = akJ·mol-1
H1 = akJ·mol-12C2H2(g)+ 5O2(g) = 4CO2(g) + 2H2O(g)
 H2 = bkJ·mol-1
H2 = bkJ·mol-12H2(g) + O2(g) =2H2O(g)
 H3= ckJ·mol-1
H3= ckJ·mol-12CH4(g) = C2H2(g) + 3H2(g)
 H4
H4①
 H4 =
H4 =②已知下列键能数据:
| 共价键 | C—H | H—H | C≡C |
| 键能/ kJ·mol-1 | 413.4 | 436 | 812 |
则
 H4 =
H4 =(3)在压强为1×105kPa的恒压密闭容器中充入1mol乙炔和1molHCl气体,加入催化剂,乙炔与HCl发生反应:HC≡CH(g)+HCl(g)
 CH2=CHCl(g),乙炔的平衡转化率与温度的关系如下图所示:
CH2=CHCl(g),乙炔的平衡转化率与温度的关系如下图所示:
①该反应的
 H
H②M点对应温度的平衡常数Kp=
您最近一年使用:0次
9 . 随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点
(1)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,其相关反应的主要热化学方程式如下:
反应①:NH3(aq)+HClO(aq)= NH2Cl(aq)+H2O(l)△H1= akJ•mol﹣1
反应②:NH2Cl(aq)+HClO(aq)= NHCl2(aq)+H2O(I)△H2= bkJ•mol﹣1
反应③:2NHCl2(aq)+H2O(l)= N2(g)+HClO(aq)+3HCl(aq)△H3= ckJ•mol﹣1
① 2NH3(aq)+3HClO(aq)= N2(g)+3H2O(I)+3HCl(aq)的△H=______ 。
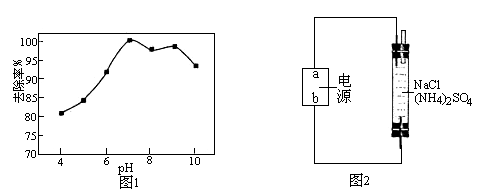
② 溶液pH对次氯酸钠去除氨氮有较大的影响(如图1所示)。在pH较低时溶液中有无色无味的气体生成,氨氮去除效率较低,其原因是_________________ 。
③ 用电化学法也可以去除废水中氨氮.在蒸馏水中加入硫酸铵用惰性电极直接电解发现氨氮去除效率极低,但在溶液中再加入一定量的氯化钠后,去除效率可以大大提高。反应装置如图2所示,b为电极__ 极,电解时阴极的电极反应式为_____________ 。
(2)“低碳经济”正成为科学家研究的主要课题。
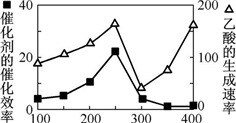
① 以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是__________________ 。
② 为了提高该反应中CO2的转化率,可以采取的措施是_____________ 。(写一条即可)
(1)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,其相关反应的主要热化学方程式如下:
反应①:NH3(aq)+HClO(aq)= NH2Cl(aq)+H2O(l)△H1= akJ•mol﹣1
反应②:NH2Cl(aq)+HClO(aq)= NHCl2(aq)+H2O(I)△H2= bkJ•mol﹣1
反应③:2NHCl2(aq)+H2O(l)= N2(g)+HClO(aq)+3HCl(aq)△H3= ckJ•mol﹣1
① 2NH3(aq)+3HClO(aq)= N2(g)+3H2O(I)+3HCl(aq)的△H=
② 溶液pH对次氯酸钠去除氨氮有较大的影响(如图1所示)。在pH较低时溶液中有无色无味的气体生成,氨氮去除效率较低,其原因是
③ 用电化学法也可以去除废水中氨氮.在蒸馏水中加入硫酸铵用惰性电极直接电解发现氨氮去除效率极低,但在溶液中再加入一定量的氯化钠后,去除效率可以大大提高。反应装置如图2所示,b为电极

(2)“低碳经济”正成为科学家研究的主要课题。
① 以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是
② 为了提高该反应中CO2的转化率,可以采取的措施是
您最近一年使用:0次
名校
10 . 下列图示与对应的叙述不相符合 的是
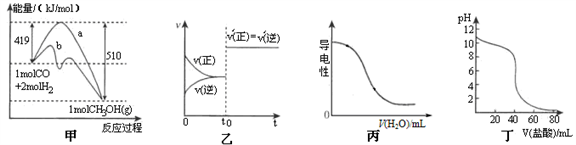
A.图甲表示工业上用CO生产甲醇的反应CO(g)+2H2(g) CH3OH(g)。该反应的△H=-91.kJ·mol-1 CH3OH(g)。该反应的△H=-91.kJ·mol-1 |
| B.图乙表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂 |
| C.图丙表示向0.1 mol·L–1的氨水溶液中逐渐加水时溶液的导电性变化 |
| D.图丁表示盐酸滴加到0.1mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
您最近一年使用:0次



