名校
解题方法
1 . I.CO2相关转化的研究对解决环境、能源问题意义重大。
(1)CO2与CH4经催化重整可制得合成气:CO2(g)+CH4(g) 2CO(g)+2H2(g),按一定体积比加入CH4和CO2,在恒压下发生反应温度对CO和H2产率影响如图所示。生产中优选的温度范围是
2CO(g)+2H2(g),按一定体积比加入CH4和CO2,在恒压下发生反应温度对CO和H2产率影响如图所示。生产中优选的温度范围是___________ (填字母序号)。

a.800℃~850℃ b.850℃~900℃ c.950℃~1000℃
Ⅱ.CO2与H2反应制取甲醇(CH3OH)
(2)CO2与H2反应的热化学方程式表示如下:
反应i:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-58kJ·mol﹣1
CH3OH(g)+H2O(g) △H1=-58kJ·mol﹣1
反应ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+42kJ·mol﹣1
CO(g)+H2O(g) △H2=+42kJ·mol﹣1
写出CO(g)与H2(g)生成CH3OH(g)的热化学方程式___________ 。
(3)关于反应i和反应ⅱ的说法正确的是___________ 。
a.升高温度能使反应i的反应速率增大,平衡常数增大
b.增大压强能提高反应ⅱ中CO2的转化率
c.低温、高压有利于CO2催化加氢制取CH3OH
(4)某同学研究温度、压强对反应平衡的影响,得到上述反应i和反应ⅱ中CO2平衡转化率、甲醇选择性与温度、压强的关系如下图。已知:
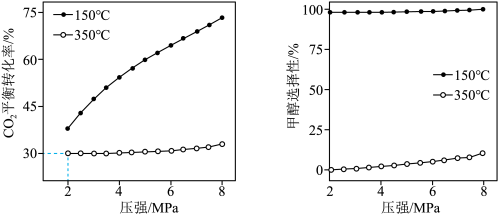
结合上图,350℃、2MPa时,发生的主要反应是___________ (填“反应i”或“反应ii”)。此条件下,a mol/LCO2和a mol/LH2在恒容、密闭容器中充分反应达到平衡,写出所发生反应的化学平衡常数K的计算过程及结果___________ (结果用分数表示)。
Ⅲ.利用Al-CO2电池(工作原理如下图所示)能有效地将CO2转化成化工原料草酸铝Al2(C2O4)3。

(5)电池的负极反应式为___________ 。
(6)电池的正极反应式:2CO2+2e-= (草酸根)。正极反应过程分两步,其中O2起催化作用,催化过程可表示为:①6O2+6e-=6
(草酸根)。正极反应过程分两步,其中O2起催化作用,催化过程可表示为:①6O2+6e-=6 ,②∙∙∙∙∙∙
,②∙∙∙∙∙∙
写出反应②的离子方程式___________ 。
(7)若电池反应生成1molAl2(C2O4)3,则转移电子的物质的量为___________ 。
(1)CO2与CH4经催化重整可制得合成气:CO2(g)+CH4(g)
 2CO(g)+2H2(g),按一定体积比加入CH4和CO2,在恒压下发生反应温度对CO和H2产率影响如图所示。生产中优选的温度范围是
2CO(g)+2H2(g),按一定体积比加入CH4和CO2,在恒压下发生反应温度对CO和H2产率影响如图所示。生产中优选的温度范围是
a.800℃~850℃ b.850℃~900℃ c.950℃~1000℃
Ⅱ.CO2与H2反应制取甲醇(CH3OH)
(2)CO2与H2反应的热化学方程式表示如下:
反应i:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-58kJ·mol﹣1
CH3OH(g)+H2O(g) △H1=-58kJ·mol﹣1反应ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+42kJ·mol﹣1
CO(g)+H2O(g) △H2=+42kJ·mol﹣1写出CO(g)与H2(g)生成CH3OH(g)的热化学方程式
(3)关于反应i和反应ⅱ的说法正确的是
a.升高温度能使反应i的反应速率增大,平衡常数增大
b.增大压强能提高反应ⅱ中CO2的转化率
c.低温、高压有利于CO2催化加氢制取CH3OH
(4)某同学研究温度、压强对反应平衡的影响,得到上述反应i和反应ⅱ中CO2平衡转化率、甲醇选择性与温度、压强的关系如下图。已知:


结合上图,350℃、2MPa时,发生的主要反应是
Ⅲ.利用Al-CO2电池(工作原理如下图所示)能有效地将CO2转化成化工原料草酸铝Al2(C2O4)3。

(5)电池的负极反应式为
(6)电池的正极反应式:2CO2+2e-=
 (草酸根)。正极反应过程分两步,其中O2起催化作用,催化过程可表示为:①6O2+6e-=6
(草酸根)。正极反应过程分两步,其中O2起催化作用,催化过程可表示为:①6O2+6e-=6 ,②∙∙∙∙∙∙
,②∙∙∙∙∙∙写出反应②的离子方程式
(7)若电池反应生成1molAl2(C2O4)3,则转移电子的物质的量为
您最近半年使用:0次
名校
2 . 硫及其化合物之间的转化具有重要意义。请按要求回答下列问题。
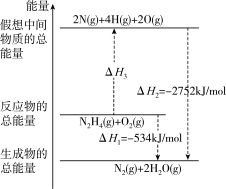
(1)土壤中的微生物可将大气中H2S经两步反应氧化成 ,两步反应的能量变化如图,写出1molH2S(g)全部氧化成
,两步反应的能量变化如图,写出1molH2S(g)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为___________ 。

(2)将SO2通入0.1mol/L Ba(NO3)2溶液中会观察到有白色沉淀生成,该反应的离子方程式为________ 。
(3)利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO4的成本低,优势明显,其流程如下。

①举例说明向大气中排放SO2导致的环境问题:___________
②下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是___________
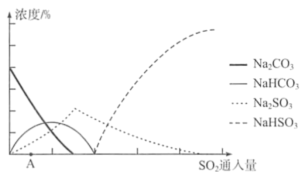

③中和器中发生的主要反应的化学方程式是___________ 。
④为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
i.用化学反应原理解释NaOH过量的原因___________ 。
ii.结晶时应选择的最佳操作是___________ (选填字母)
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
⑤为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是___________ 。
⑥KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
i.滴定终点前反应的离子方程式是:_______ ,___ +__
+__ =___+___(将方程式补充完整)
=___+___(将方程式补充完整)
ii.成品中Na2SO3 (M=126g/mol)的质量分数是___________ 。
(1)土壤中的微生物可将大气中H2S经两步反应氧化成
 ,两步反应的能量变化如图,写出1molH2S(g)全部氧化成
,两步反应的能量变化如图,写出1molH2S(g)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为
(2)将SO2通入0.1mol/L Ba(NO3)2溶液中会观察到有白色沉淀生成,该反应的离子方程式为
(3)利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO4的成本低,优势明显,其流程如下。

①举例说明向大气中排放SO2导致的环境问题:
②下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是


③中和器中发生的主要反应的化学方程式是
④为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
i.用化学反应原理解释NaOH过量的原因
ii.结晶时应选择的最佳操作是
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
⑤为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是
⑥KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
i.滴定终点前反应的离子方程式是:
 +__
+__ =___+___(将方程式补充完整)
=___+___(将方程式补充完整)ii.成品中Na2SO3 (M=126g/mol)的质量分数是
您最近半年使用:0次
名校
3 . 下表是有关可逆反应的数据
根据以上信息判断下列结论错误的是
| 编号 | 化学反应方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| I | Fe(s)+CO2(g)  FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| II | Fe(s)+H2O(g)  FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| III | CO(g)+H2O(g)  CO2(g)+H2(g) CO2(g)+H2(g) | K3 | a | b |
| A.反应III是放热反应 |
| B.a>b,a=1.62 |
| C.若要使反应III在一定条件下平衡向逆反应方向移动,可采取措施①升高温度;②充入He气使体积增大 |
| D.从979K到1173K,三个反应速率都会加快,但加快的程度不同 |
您最近半年使用:0次
4 . 依据图示关系,下列说法不正确的是
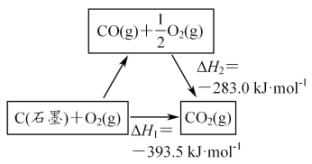

| A.C(石墨)的燃烧热为△H=—393.5kJ/mol |
| B.C(石墨)+CO2(g)= 2CO(g) △H=△H1—△H2 |
| C.1molC(石墨)和1 mol CO分别在足量O2中燃烧,全部转化为CO2,前者放热多 |
| D.化学反应的△H,只与反应体系的始态和终态有关,与反应途径无关 |
您最近半年使用:0次
名校
5 . 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有若重要作用。
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。
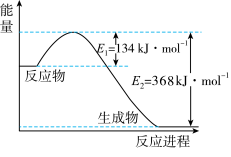
①该反应是___________ (填“吸热”或“放热”)反应。
②请写出反应的热化学方程式___________ 。
③若在反应体系中加入催化剂能使反应热___________ 。(填“增大”、“不变”或"减小")
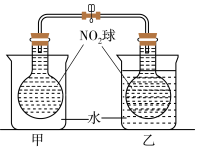
(2)已知,可逆反应2NO2(g) N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会______ (填“变深”、“不变”或“变浅”),能量发生这种变化的原因是______ 。
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是___________ kJ。
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。

①该反应是
②请写出反应的热化学方程式
③若在反应体系中加入催化剂能使反应热
(2)已知,可逆反应2NO2(g)
 N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是

您最近半年使用:0次
名校
6 . 铜冶金技术以火法冶炼为主。
(1)火法炼铜的工艺流程如下:
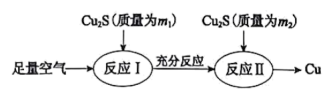
反应I:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ·mol-1
①在反应Ⅱ中,每生成1molSO2转移电子___________ mol。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=___________ kJ·mol-1 。
③理论上m1:m2=___________ 。
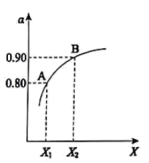
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。制硫酸中重要的一步反应是:2SO2(g)+O2(g) 2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是___________ 。A对应条件下平衡常数K=___________ 。
(3)工业硫酸中往往含有一定量SO2,测定过程如下:取mg工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用cmol·L-1I2标准溶液滴定,消耗的I2标准溶液VmL,工业硫酸中含有SO2的质量分数的计算式是___________ 。
(1)火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ·mol-1
①在反应Ⅱ中,每生成1molSO2转移电子
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
③理论上m1:m2=
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。制硫酸中重要的一步反应是:2SO2(g)+O2(g)
 2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
(3)工业硫酸中往往含有一定量SO2,测定过程如下:取mg工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用cmol·L-1I2标准溶液滴定,消耗的I2标准溶液VmL,工业硫酸中含有SO2的质量分数的计算式是
您最近半年使用:0次
名校
解题方法
7 . CO2在自然界碳循环中起着重要作用,合理利用CO2是当今科学研究的前沿。
(1)蓝色碳汇技术:利用海洋生物吸收大气中的CO2,将其固定在海洋中。

①海水的CO295%以 形式存在,写出CO2溶于水产生
形式存在,写出CO2溶于水产生 的方程式
的方程式__________ 。
②珊瑚虫是海洋中的一种腔肠动物,经钙化作用可以形成石灰石外壳,示意图如上。写出钙化作用的离子方程式____________________ 。
(2)用CO2生产绿色燃料甲醇:
①用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1365.0kJ/mol
H2(g)+ O2(g)=H2O(g) △H=-241.8kJ/mol
O2(g)=H2O(g) △H=-241.8kJ/mol
则反应A的热化学方程式为___________________________ 。
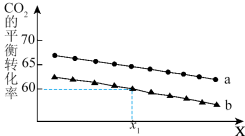
②在体积为1L的恒容密闭容器中发生反应A,下图为不同投料[n(CO2)和n(H2)分别为1mol,3mol;lmol,6mol]下,CO2平衡转化率随X(温度或压强)的变化曲线。
Ⅰ.曲线a对应的投料是___________ 。
Ⅱ.判断X代表的物理量是______ ,简述理由____________________ 。
Ⅲ.x1时,曲线b对应的化学平衡常数是______________ 。
Ⅳ.将CO2和H2按物质的量比1:3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如下图所示。
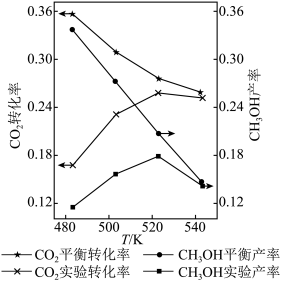
已知:CH3OH产率=
ⅰ.催化剂活性最好的温度为___ (填字母序号)。
a.483K b.503K c.523K d.543K
ⅱ.温度由523K升到543K,CO2的平衡转化率和CH3OH的实验产率均降低,解释原因:____________ 。
(1)蓝色碳汇技术:利用海洋生物吸收大气中的CO2,将其固定在海洋中。

①海水的CO295%以
 形式存在,写出CO2溶于水产生
形式存在,写出CO2溶于水产生 的方程式
的方程式②珊瑚虫是海洋中的一种腔肠动物,经钙化作用可以形成石灰石外壳,示意图如上。写出钙化作用的离子方程式
(2)用CO2生产绿色燃料甲醇:
①用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1365.0kJ/mol
H2(g)+
 O2(g)=H2O(g) △H=-241.8kJ/mol
O2(g)=H2O(g) △H=-241.8kJ/mol则反应A的热化学方程式为
②在体积为1L的恒容密闭容器中发生反应A,下图为不同投料[n(CO2)和n(H2)分别为1mol,3mol;lmol,6mol]下,CO2平衡转化率随X(温度或压强)的变化曲线。
Ⅰ.曲线a对应的投料是
Ⅱ.判断X代表的物理量是
Ⅲ.x1时,曲线b对应的化学平衡常数是

Ⅳ.将CO2和H2按物质的量比1:3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如下图所示。

已知:CH3OH产率=

ⅰ.催化剂活性最好的温度为
a.483K b.503K c.523K d.543K
ⅱ.温度由523K升到543K,CO2的平衡转化率和CH3OH的实验产率均降低,解释原因:
您最近半年使用:0次
名校
8 . CO2催化加氢制取甲醇、乙醇等低碳醇的研究,对于环境问题和能源问题都具有非常重要的意义。已知一定条件下的如下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
下列说法不正确的是
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol下列说法不正确的是
| A.CH3OH(g)+CO2(g)+3H2(g)=CH3CH2OH(g)+2H2O(g) △H<0 |
| B.增大压强,有利于反应向生成低碳醇的方向移动,平衡常数增大 |
| C.升高温度,可以加快生成低碳醇的速率,但反应限度降低 |
| D.增大二氧化碳浓度可以提高氢气的转化率 |
您最近半年使用:0次
名校
9 . 二氧化碳是主要的温室气体,也是一种工业原料。将其固定及利用,有利于缓解温室效应带来的环境问题。
(1)用二氧化碳合成甲醇。
已知:2H2(g)+O2(g)=2H2O(g) ∆H=-484kJ/mol
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1348kJ/mol
在催化剂作用下,CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g),该反应的热化学方程式是___________ 。
(2)用二氧化碳与环氧丙烷(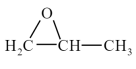 )反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示:在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
)反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示:在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
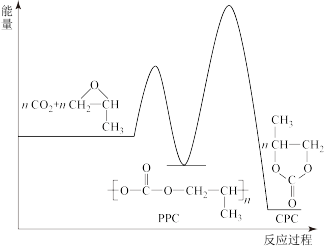
①通过表中数据ⅰ、ⅱ、ⅲ可以得出的结论是___________ 。在25℃时,实际生产中反应压强为1.5MPa,而不是2.0MPa,理由是___________ 。
②通过表中数据ⅱ、ⅳ、ⅴ可知温度升高会使PPC的选择性下降,结合上图说明其原因可能是___________ 。
(1)用二氧化碳合成甲醇。
已知:2H2(g)+O2(g)=2H2O(g) ∆H=-484kJ/mol
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1348kJ/mol
在催化剂作用下,CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g),该反应的热化学方程式是
(2)用二氧化碳与环氧丙烷(
 )反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示:在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
)反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示:在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
| 序号 | 温度/℃ | 压强/MPa | 总产率/% | PPC的选择性/% |
| ⅰ | 25 | 0.5 | 90 | 92.1 |
| ⅱ | 25 | 1.5 | 94.9 | >99 |
| ⅲ | 25 | 2.0 | 95.4 | >99 |
| ⅳ | 40 | 1.5 | 95.6 | 96.2 |
| ⅴ | 60 | 1.5 | 99 | 76 |
②通过表中数据ⅱ、ⅳ、ⅴ可知温度升高会使PPC的选择性下降,结合上图说明其原因可能是
您最近半年使用:0次
10 . 通过以下反应均可获取H2。
①C(s)+H2O(g)=CO(g)+H2(g) ΔH1=+131.3kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3
下列说法正确的是
①C(s)+H2O(g)=CO(g)+H2(g) ΔH1=+131.3kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3
下列说法正确的是
| A.①中反应物的总能量大于生成物的总能量 |
| B.②中使用适当催化剂,可以使ΔH2减小 |
| C.由①、②计算反应CH4(g)=C(s)+2H2(g)的ΔH=-74.8kJ·mol-1 |
| D.若知反应C(s)+CO2(g)=2CO(g)的ΔH,结合ΔH1可计算出ΔH3 |
您最近半年使用:0次



