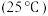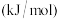1 . 向丙烷脱氢制丙烯的反应体系中加入 ,可以提高丙烷的利用率。在相同温度下,分别将投料比相同的
,可以提高丙烷的利用率。在相同温度下,分别将投料比相同的 、
、 混合气体以相同流速持续通过同种催化剂表面,
混合气体以相同流速持续通过同种催化剂表面, 转化率和
转化率和 选择性随通入气体时间的变化如图:
选择性随通入气体时间的变化如图:
I.反应①
反应②
Ⅱ.反应体系中存在 的裂解和生成积炭等副反应。
的裂解和生成积炭等副反应。
Ⅲ. 的选择性
的选择性
下列说法正确的是
 ,可以提高丙烷的利用率。在相同温度下,分别将投料比相同的
,可以提高丙烷的利用率。在相同温度下,分别将投料比相同的 、
、 混合气体以相同流速持续通过同种催化剂表面,
混合气体以相同流速持续通过同种催化剂表面, 转化率和
转化率和 选择性随通入气体时间的变化如图:
选择性随通入气体时间的变化如图:
I.反应①

反应②

Ⅱ.反应体系中存在
 的裂解和生成积炭等副反应。
的裂解和生成积炭等副反应。Ⅲ.
 的选择性
的选择性
下列说法正确的是
A. |
B.30min内,两体系中 选择性相同,生成 选择性相同,生成 的速率也相同 的速率也相同 |
C.iii中的 转化率高于iv中的,是因为反应②使反应①的平衡正向移动 转化率高于iv中的,是因为反应②使反应①的平衡正向移动 |
D.iii、iv对比,150min后iv中 转化率为0,可能是因为积炭使催化剂失效 转化率为0,可能是因为积炭使催化剂失效 |
您最近半年使用:0次
2 . 将 转化为高附加值的化学品,对实现碳中和、可持续发展具有重要意义。
转化为高附加值的化学品,对实现碳中和、可持续发展具有重要意义。
Ⅰ.利用 催化加氢制备乙烯,反应过程主要分为两步。
催化加氢制备乙烯,反应过程主要分为两步。
ⅰ.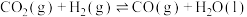

ⅱ.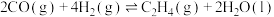
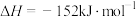
(1) 和
和 反应制备乙烯的热化学方程式为
反应制备乙烯的热化学方程式为___________ 。
(2)0.1MPa,投料比 的条件下研究反应ⅰ,在不同温度下达到平衡时各气体的物质的量分数如图1所示(水转化为液态,不计入)。
的条件下研究反应ⅰ,在不同温度下达到平衡时各气体的物质的量分数如图1所示(水转化为液态,不计入)。___________ 。
②800℃时, 的平衡转化率为
的平衡转化率为___________ 。
Ⅱ.利用煤气化灰渣(主要成分有CaO、 、
、 和MgO等)封存
和MgO等)封存 ,制备高纯碳酸钙。
,制备高纯碳酸钙。
ⅰ.浸出:向灰渣中加入稍过量盐酸,充分反应后过滤,得滤液a;
ⅱ.净化:向滤液a中逐渐加入氨水,金属氢氧化物分步沉淀,分步过滤,得到滤液b;
ⅲ.碳酸化:向滤液b中通入 ,过滤、洗涤、干燥,得到高纯
,过滤、洗涤、干燥,得到高纯 。
。
已知:一些金属氢氧化物在溶液中达到沉淀溶解平衡时的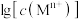 与pH关系如图2所示。
与pH关系如图2所示。___________ 。
(4)碳酸化时发生主要反应的离子方程式是___________ 。
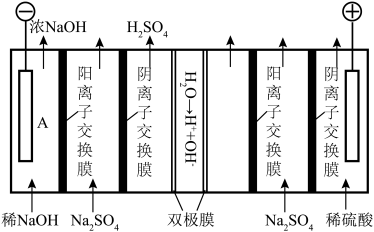
Ⅲ.利用双极膜电解 制备NaOH,捕集烟气中
制备NaOH,捕集烟气中 ,制备
,制备 。已知:双极膜为复合膜,可在直流电的作用下,将膜间的
。已知:双极膜为复合膜,可在直流电的作用下,将膜间的 解离,提供
解离,提供 和
和 。
。___________ 。
(6)当电路中转移2mol 时,上图装置产生
时,上图装置产生___________ mol NaOH。
(7)制得的 固体样品中常混有
固体样品中常混有 。准确称量xg样品,下列方案中,能测定样品中
。准确称量xg样品,下列方案中,能测定样品中 纯度的是
纯度的是___________ 。
A.充分加热,固体减重
B.与足量稀盐酸充分反应,加热蒸干,得 固体
固体
C.与足量稀硫酸充分反应并加热,逸出气体用碱石灰吸收,增重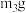
 转化为高附加值的化学品,对实现碳中和、可持续发展具有重要意义。
转化为高附加值的化学品,对实现碳中和、可持续发展具有重要意义。Ⅰ.利用
 催化加氢制备乙烯,反应过程主要分为两步。
催化加氢制备乙烯,反应过程主要分为两步。ⅰ.
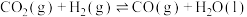

ⅱ.
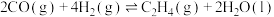
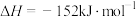
(1)
 和
和 反应制备乙烯的热化学方程式为
反应制备乙烯的热化学方程式为(2)0.1MPa,投料比
 的条件下研究反应ⅰ,在不同温度下达到平衡时各气体的物质的量分数如图1所示(水转化为液态,不计入)。
的条件下研究反应ⅰ,在不同温度下达到平衡时各气体的物质的量分数如图1所示(水转化为液态,不计入)。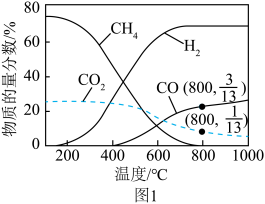
②800℃时,
 的平衡转化率为
的平衡转化率为Ⅱ.利用煤气化灰渣(主要成分有CaO、
 、
、 和MgO等)封存
和MgO等)封存 ,制备高纯碳酸钙。
,制备高纯碳酸钙。ⅰ.浸出:向灰渣中加入稍过量盐酸,充分反应后过滤,得滤液a;
ⅱ.净化:向滤液a中逐渐加入氨水,金属氢氧化物分步沉淀,分步过滤,得到滤液b;
ⅲ.碳酸化:向滤液b中通入
 ,过滤、洗涤、干燥,得到高纯
,过滤、洗涤、干燥,得到高纯 。
。已知:一些金属氢氧化物在溶液中达到沉淀溶解平衡时的
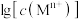 与pH关系如图2所示。
与pH关系如图2所示。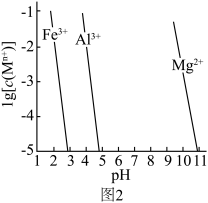
(4)碳酸化时发生主要反应的离子方程式是
Ⅲ.利用双极膜电解
 制备NaOH,捕集烟气中
制备NaOH,捕集烟气中 ,制备
,制备 。已知:双极膜为复合膜,可在直流电的作用下,将膜间的
。已知:双极膜为复合膜,可在直流电的作用下,将膜间的 解离,提供
解离,提供 和
和 。
。
(6)当电路中转移2mol
 时,上图装置产生
时,上图装置产生(7)制得的
 固体样品中常混有
固体样品中常混有 。准确称量xg样品,下列方案中,能测定样品中
。准确称量xg样品,下列方案中,能测定样品中 纯度的是
纯度的是A.充分加热,固体减重

B.与足量稀盐酸充分反应,加热蒸干,得
 固体
固体C.与足量稀硫酸充分反应并加热,逸出气体用碱石灰吸收,增重
您最近半年使用:0次
3 . 二氧化碳与氢气催化合成乙烯具有重要的意义。将 和
和 按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。
按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。
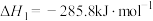
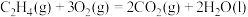
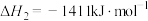

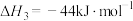
下列说法不正确 的是
 和
和 按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。
按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。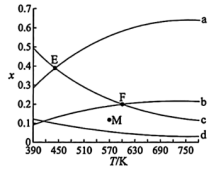
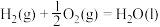
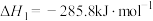
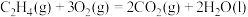
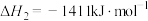

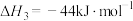
下列说法
A. 与 与 合成 合成 反应的热化学方程式: 反应的热化学方程式: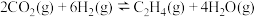 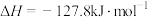 |
B.图中b、d分别表示 、 、 的变化曲线 的变化曲线 |
C.570K、0.2MPa反应达到平衡状态时,M点显示的可能是 的物质的量分数 的物质的量分数 |
D. 与 与 合成 合成 反应的 反应的 |
您最近半年使用:0次
4 . 我国科学家研发的“液态阳光”计划通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备甲醇。
(1)制备甲醇的主反应:
 。
。
该过程中还存在一个生成CO的副反应,结合反应: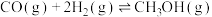
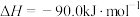 写出该副反应的热化学方程式:
写出该副反应的热化学方程式:______ 。
(2)将 和
和 按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/AI/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。
按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/AI/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。
①催化剂活性最好的温度为______ (填字母序号)。
a.483K b.503K c.523K d.543K
②温度由523K升到543K, 的平衡转化率降低,解释其原因:
的平衡转化率降低,解释其原因:______ 。
(3)使用 薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。
①将铜箔放入煮沸的饱和硫酸铜溶液中,制得 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为______ 。
②用 薄膜电极作阴极,
薄膜电极作阴极, 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备ZnO薄膜的电极反应式为
。制备ZnO薄膜的电极反应式为______ 。
③电催化法制备甲醇如图所示。______ 。
(1)制备甲醇的主反应:

 。
。该过程中还存在一个生成CO的副反应,结合反应:
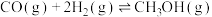
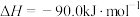 写出该副反应的热化学方程式:
写出该副反应的热化学方程式:(2)将
 和
和 按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/AI/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。
按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/AI/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。

①催化剂活性最好的温度为
a.483K b.503K c.523K d.543K
②温度由523K升到543K,
 的平衡转化率降低,解释其原因:
的平衡转化率降低,解释其原因:(3)使用
 薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。①将铜箔放入煮沸的饱和硫酸铜溶液中,制得
 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为②用
 薄膜电极作阴极,
薄膜电极作阴极, 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备ZnO薄膜的电极反应式为
。制备ZnO薄膜的电极反应式为③电催化法制备甲醇如图所示。

您最近半年使用:0次
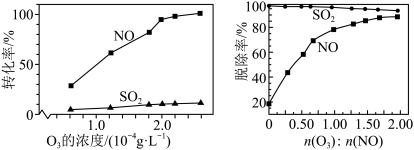
5 . 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟O3氧化结合(NH4)2SO3溶液吸收法同时脱除SO2和NO。气体反应器中的主要反应原理及相关数据如下表。
不正确 的是
反应 | 平衡常数 | 活化能/ |
 |  | 24.6 |
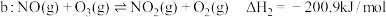 | 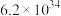 | 3.17 |
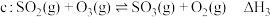 | 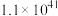 | 58.17 |
A.已知: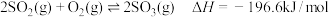 则 则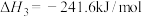 |
| B.其他条件不变,在相同时间内,SO2和NO的转化率均随温度升高而降低 |
| C.其他条件不变,在相同时间内,随O3浓度的升高,NO的转化率远远高于SO2的转化率 |
| D.其他条件不变,在相同时间内,O3的浓度很低时,SO2的脱除率远高于NO的脱除率,因为反应c速率大于反应b |
您最近半年使用:0次
6 . 烟气脱硝技术是环境科学研究的热点。实验室模拟 将烟气中的
将烟气中的 深度氧化为
深度氧化为 ,并进一步将
,并进一步将 转化获得含氮产品,流程示意图如下。
转化获得含氮产品,流程示意图如下。
i.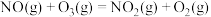
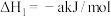
ii.

iii.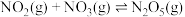

(1) 被
被 深度氧化,补全热化学方程式:
深度氧化,补全热化学方程式:


___________ 
(2)一定条件下,不同温度时, 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。
___________  (填“>”或“<”)。
(填“>”或“<”)。
②8s时, 的浓度不同的原因是
的浓度不同的原因是___________ 。
(3)一定条件下,NO的初始浓度为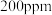 时,不同反应时间,深度氧化器中
时,不同反应时间,深度氧化器中 的浓度随
的浓度随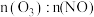 的变化如图所示。反应过程中
的变化如图所示。反应过程中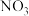 的浓度极低。
的浓度极低。 时,深度氧化器中发生的反应主要是
时,深度氧化器中发生的反应主要是___________ (填“i”“ii”或“iii”)。
② 时,
时, 的浓度随
的浓度随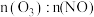 变化的原因是
变化的原因是___________ 。
(4) 且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是
且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是___________ 。
(5)深度氧化后的烟气通过吸收器完全转化为硝酸盐产品,产品浓度的测定方法如下。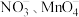 的还原产物分别是
的还原产物分别是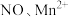 。产品中
。产品中 的物质的量浓度为
的物质的量浓度为___________  。
。
 将烟气中的
将烟气中的 深度氧化为
深度氧化为 ,并进一步将
,并进一步将 转化获得含氮产品,流程示意图如下。
转化获得含氮产品,流程示意图如下。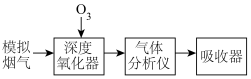
i.
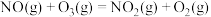
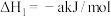
ii.


iii.
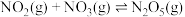

(1)
 被
被 深度氧化,补全热化学方程式:
深度氧化,补全热化学方程式:


(2)一定条件下,不同温度时,
 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。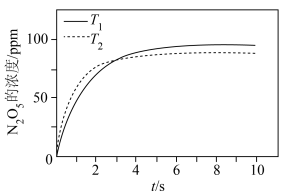

 (填“>”或“<”)。
(填“>”或“<”)。②8s时,
 的浓度不同的原因是
的浓度不同的原因是(3)一定条件下,NO的初始浓度为
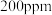 时,不同反应时间,深度氧化器中
时,不同反应时间,深度氧化器中 的浓度随
的浓度随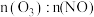 的变化如图所示。反应过程中
的变化如图所示。反应过程中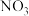 的浓度极低。
的浓度极低。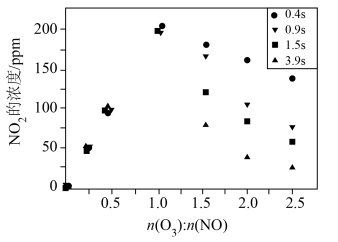
 时,深度氧化器中发生的反应主要是
时,深度氧化器中发生的反应主要是②
 时,
时, 的浓度随
的浓度随 变化的原因是
变化的原因是(4)
 且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是
且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是(5)深度氧化后的烟气通过吸收器完全转化为硝酸盐产品,产品浓度的测定方法如下。
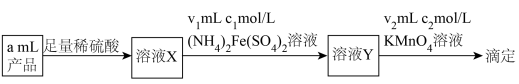
 的还原产物分别是
的还原产物分别是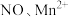 。产品中
。产品中 的物质的量浓度为
的物质的量浓度为 。
。
您最近半年使用:0次
7 . 碱金属单质M和 反应的能量变化如下图所示。下列说法正确的是
反应的能量变化如下图所示。下列说法正确的是
 反应的能量变化如下图所示。下列说法正确的是
反应的能量变化如下图所示。下列说法正确的是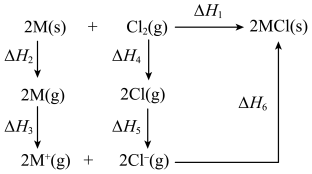
| A.CsCl晶体是共价晶体 |
B. |
C.若M分别为Na和K,则 :Na<K :Na<K |
D.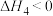 , ,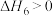 |
您最近半年使用:0次
2024·天津河北·一模
8 . 氢能的开发和利用是推动我国能源结构转型,保障国家能源安全,实现“碳达峰”、“碳中和”目标的重要途径。目前,我国已成为世界第一大产氢国,主要有三类工业制氢路线:
(1)化工燃料重整制氢
已知:
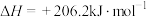

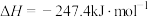
则 与
与 反应生成
反应生成 和
和 的反应热是
的反应热是___________  。
。
(2)工业副产氢
已知:工业上用水煤气法制氢气,有关化学方程式是:
反应一:

反应二:

①反应一在 时达到化学平衡状态,则此温度下该反应的平衡常数表达式
时达到化学平衡状态,则此温度下该反应的平衡常数表达式
___________ 。
②在 时将
时将 和
和 各
各 通入体积为
通入体积为 的密闭容器中反应发生反应二,
的密闭容器中反应发生反应二, 时达到平衡状态,该反应的平衡常数是9,则
时达到平衡状态,该反应的平衡常数是9,则 的转化率是
的转化率是___________ ,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率 是
是___________  。
。
(3)清洁能源电解制氢
已知:利用电解饱和食盐水可制得氢气,下图为电解装置示意图: 电极是极
电极是极___________ (填“阴”或“阳”), 电极的电极反应式
电极的电极反应式___________ 。
②假设室温条件下电解 饱和食盐水一段时间,当两极产生的气体共
饱和食盐水一段时间,当两极产生的气体共 (标准状况下)时,溶液的
(标准状况下)时,溶液的 为
为___________ (溶液体积没有变化)。
(1)化工燃料重整制氢
已知:

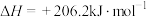

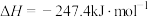
则
 与
与 反应生成
反应生成 和
和 的反应热是
的反应热是 。
。(2)工业副产氢
已知:工业上用水煤气法制氢气,有关化学方程式是:
反应一:


反应二:


①反应一在
 时达到化学平衡状态,则此温度下该反应的平衡常数表达式
时达到化学平衡状态,则此温度下该反应的平衡常数表达式
②在
 时将
时将 和
和 各
各 通入体积为
通入体积为 的密闭容器中反应发生反应二,
的密闭容器中反应发生反应二, 时达到平衡状态,该反应的平衡常数是9,则
时达到平衡状态,该反应的平衡常数是9,则 的转化率是
的转化率是 的浓度变化表示的反应速率
的浓度变化表示的反应速率 是
是 。
。(3)清洁能源电解制氢
已知:利用电解饱和食盐水可制得氢气,下图为电解装置示意图:

 电极是极
电极是极 电极的电极反应式
电极的电极反应式②假设室温条件下电解
 饱和食盐水一段时间,当两极产生的气体共
饱和食盐水一段时间,当两极产生的气体共 (标准状况下)时,溶液的
(标准状况下)时,溶液的 为
为
您最近半年使用:0次
9 . 氨是一种重要的化工原料,迄今为止,人类仍然在追求低成本、高产率的合成氨技术。
Ⅰ. 直接合成氨。
直接合成氨。
(1)根据图1所示的能量转换关系, 合成
合成 的热化学方程式为
的热化学方程式为_______ 。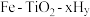 双催化剂,通过光辐射产生温差。使
双催化剂,通过光辐射产生温差。使 在
在_______ (填“热 ”或“冷
”或“冷 ”,下同)表面断裂,氨气在
”,下同)表面断裂,氨气在_______ 表面生成,有利于提高合成氨的反应速率和平衡产率。
Ⅱ.电化学法合成氨。
应用电化学原理,硝酸盐 亚硝酸盐
亚硝酸盐 氨,实现了高效合成氨,装置如图2。
氨,实现了高效合成氨,装置如图2。 的电极反应式是
的电极反应式是_______ 。
(4)当电路中有 电子通过时,一定量的
电子通过时,一定量的 被还原生成
被还原生成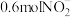 和
和_______ 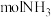 。
。
Ⅲ.氯化镁循环法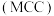 合成氨。
合成氨。 完成转化。
完成转化。
①选用 进行转化,将
进行转化,将 置于
置于 中能释放出
中能释放出 ,反应的方程式是
,反应的方程式是_______ 。
②选用 固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:_______ 。 ,用
,用 固体转化
固体转化 的优点有
的优点有_______ (写出一条即可)。
Ⅰ.
 直接合成氨。
直接合成氨。(1)根据图1所示的能量转换关系,
 合成
合成 的热化学方程式为
的热化学方程式为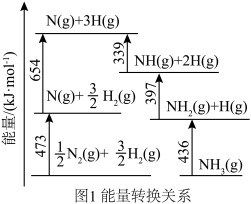
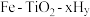 双催化剂,通过光辐射产生温差。使
双催化剂,通过光辐射产生温差。使 在
在 ”或“冷
”或“冷 ”,下同)表面断裂,氨气在
”,下同)表面断裂,氨气在Ⅱ.电化学法合成氨。
应用电化学原理,硝酸盐
 亚硝酸盐
亚硝酸盐 氨,实现了高效合成氨,装置如图2。
氨,实现了高效合成氨,装置如图2。
 的电极反应式是
的电极反应式是(4)当电路中有
 电子通过时,一定量的
电子通过时,一定量的 被还原生成
被还原生成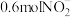 和
和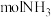 。
。Ⅲ.氯化镁循环法
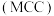 合成氨。
合成氨。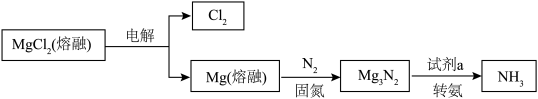
 完成转化。
完成转化。①选用
 进行转化,将
进行转化,将 置于
置于 中能释放出
中能释放出 ,反应的方程式是
,反应的方程式是②选用
 固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式: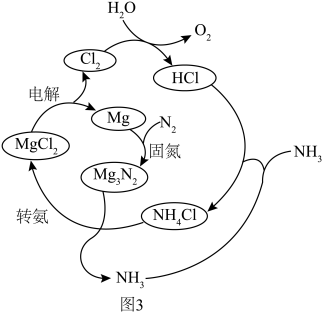
 ,用
,用 固体转化
固体转化 的优点有
的优点有
您最近半年使用:0次
名校
10 . 肼( )有较强的还原性,与
)有较强的还原性,与 等可组成火箭推进剂。
等可组成火箭推进剂。
(1)已知:Ⅰ.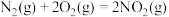

Ⅱ.
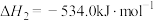
Ⅲ.

火箭发射时 与
与 反应生成
反应生成 和
和 。该反应的热化学方程式是
。该反应的热化学方程式是___________ 。
(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.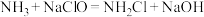 (快)
(快)
ii.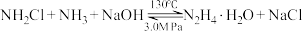 (慢)
(慢)
已知电负性N>Cl。下列说法正确的是___________ (填序号)。
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内 的产量
的产量
c.采用3.0MPa压强可以增大 的溶解度,提高反应ii中
的溶解度,提高反应ii中 的利用率
的利用率
(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。
①水合肼( ,常温为液态)中
,常温为液态)中 与
与 间存在氢键,用“X-H…Y”表示
间存在氢键,用“X-H…Y”表示 与
与 间存在的氢键:
间存在的氢键:___________ 。
②蒸馏过程中首先馏出的物质是___________ (填序号)。
a. b.
b. c.NaCl
c.NaCl
(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用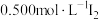 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00mL。已知:
溶液20.00mL。已知: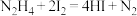
①样品中肼(以 计)的质量分数为
计)的质量分数为___________ 。
②若滴定过程中操作过于缓慢,则测定结果___________ (填“偏大”“偏小”或“不受影响”)。
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如右图所示。___________ 。
②电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因___________ 。
 )有较强的还原性,与
)有较强的还原性,与 等可组成火箭推进剂。
等可组成火箭推进剂。(1)已知:Ⅰ.
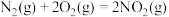

Ⅱ.

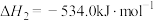
Ⅲ.


火箭发射时
 与
与 反应生成
反应生成 和
和 。该反应的热化学方程式是
。该反应的热化学方程式是(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.
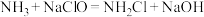 (快)
(快)ii.
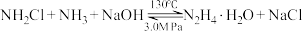 (慢)
(慢)已知电负性N>Cl。下列说法正确的是
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内
 的产量
的产量c.采用3.0MPa压强可以增大
 的溶解度,提高反应ii中
的溶解度,提高反应ii中 的利用率
的利用率(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。
①水合肼(
 ,常温为液态)中
,常温为液态)中 与
与 间存在氢键,用“X-H…Y”表示
间存在氢键,用“X-H…Y”表示 与
与 间存在的氢键:
间存在的氢键:②蒸馏过程中首先馏出的物质是
a.
 b.
b. c.NaCl
c.NaCl(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用
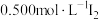 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00mL。已知:
溶液20.00mL。已知: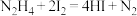
①样品中肼(以
 计)的质量分数为
计)的质量分数为②若滴定过程中操作过于缓慢,则测定结果
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如右图所示。
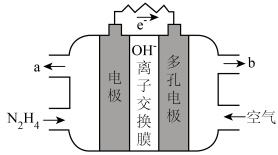
②电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因
您最近半年使用:0次