氨是一种重要的化工原料,迄今为止,人类仍然在追求低成本、高产率的合成氨技术。
Ⅰ.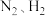 直接合成氨。
直接合成氨。
(1)根据图1所示的能量转换关系,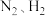 合成
合成 的热化学方程式为
的热化学方程式为_______ 。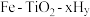 双催化剂,通过光辐射产生温差。使
双催化剂,通过光辐射产生温差。使 在
在_______ (填“热 ”或“冷
”或“冷 ”,下同)表面断裂,氨气在
”,下同)表面断裂,氨气在_______ 表面生成,有利于提高合成氨的反应速率和平衡产率。
Ⅱ.电化学法合成氨。
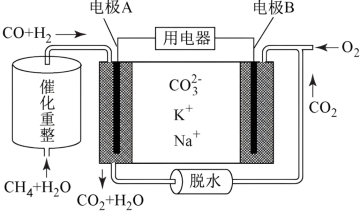
应用电化学原理,硝酸盐 亚硝酸盐
亚硝酸盐 氨,实现了高效合成氨,装置如图2。
氨,实现了高效合成氨,装置如图2。 的电极反应式是
的电极反应式是_______ 。
(4)当电路中有 电子通过时,一定量的
电子通过时,一定量的 被还原生成
被还原生成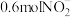 和
和_______ 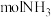 。
。
Ⅲ.氯化镁循环法 合成氨。
合成氨。 完成转化。
完成转化。
①选用 进行转化,将
进行转化,将 置于
置于 中能释放出
中能释放出 ,反应的方程式是
,反应的方程式是_______ 。
②选用 固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:_______ 。 ,用
,用 固体转化
固体转化 的优点有
的优点有_______ (写出一条即可)。
Ⅰ.
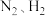 直接合成氨。
直接合成氨。(1)根据图1所示的能量转换关系,
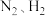 合成
合成 的热化学方程式为
的热化学方程式为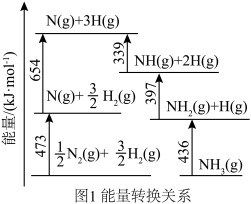
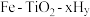 双催化剂,通过光辐射产生温差。使
双催化剂,通过光辐射产生温差。使 在
在 ”或“冷
”或“冷 ”,下同)表面断裂,氨气在
”,下同)表面断裂,氨气在Ⅱ.电化学法合成氨。
应用电化学原理,硝酸盐
 亚硝酸盐
亚硝酸盐 氨,实现了高效合成氨,装置如图2。
氨,实现了高效合成氨,装置如图2。
 的电极反应式是
的电极反应式是(4)当电路中有
 电子通过时,一定量的
电子通过时,一定量的 被还原生成
被还原生成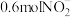 和
和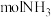 。
。Ⅲ.氯化镁循环法
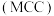 合成氨。
合成氨。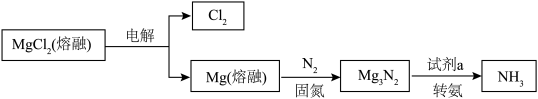
 完成转化。
完成转化。①选用
 进行转化,将
进行转化,将 置于
置于 中能释放出
中能释放出 ,反应的方程式是
,反应的方程式是②选用
 固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
 ,用
,用 固体转化
固体转化 的优点有
的优点有
更新时间:2024-04-20 20:38:50
|
相似题推荐
【推荐1】二甲醚(DME)(CH3OCH3)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g) + 2H2(g)⇌CH3OH(g) △H1= -90.7kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g) + H2O △H2= -23.5kJ·mol-1
③CO(g) + H2O(g)⇌CO2 (g)+H2(g) △H3= -41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2 (g) △H=___________ kJ/mol。
(2)以下说法能说明反应3H2(g) + 3CO(g)⇌CH3OCH3(g) +CO2 (g)达到平衡状态的有___________ 。
A. 和
和 的浓度之比为3︰1
的浓度之比为3︰1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(3)如图所示装置,装置A是二甲醚燃料电池,已知该装置工作时电子从b极流出,a极流入。

①A池中a电极反应式为___________
②当装置A中消耗0.25mol二甲醚时,此时转移的电子数为___________ ;装置A中溶液的pH会___________ (填写“增大”“减小”或“不变”)。
(4)一定量的 与足量的碳在体积可变的恒压密闭容器中反应:C(S)+CO2(g)⇌2CO(g)平衡时,体系中气体体积分数与温度的关系如图所示:
与足量的碳在体积可变的恒压密闭容器中反应:C(S)+CO2(g)⇌2CO(g)平衡时,体系中气体体积分数与温度的关系如图所示:
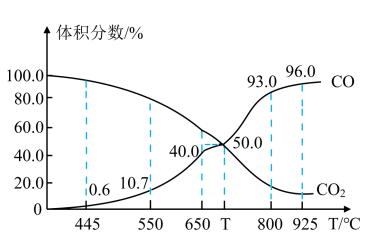
(已知气体分压(P分)=气体总压(P总)×体积分数)
①该反应
___________ (填“>”“<”或“=”)0,550 ℃ 时,平衡后若充入惰性气体,平衡___________ (填“正移”“逆移”或“不移动”)。
②650 ℃ 时,反应达平衡后 的转化率为
的转化率为___________ (保留2位有效数字)。
③T ℃ 时,用平衡分压代替平衡浓度表示的化学平衡常数
___________ P总。
①CO(g) + 2H2(g)⇌CH3OH(g) △H1= -90.7kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g) + H2O △H2= -23.5kJ·mol-1
③CO(g) + H2O(g)⇌CO2 (g)+H2(g) △H3= -41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2 (g) △H=
(2)以下说法能说明反应3H2(g) + 3CO(g)⇌CH3OCH3(g) +CO2 (g)达到平衡状态的有
A.
 和
和 的浓度之比为3︰1
的浓度之比为3︰1B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(3)如图所示装置,装置A是二甲醚燃料电池,已知该装置工作时电子从b极流出,a极流入。

①A池中a电极反应式为
②当装置A中消耗0.25mol二甲醚时,此时转移的电子数为
(4)一定量的
 与足量的碳在体积可变的恒压密闭容器中反应:C(S)+CO2(g)⇌2CO(g)平衡时,体系中气体体积分数与温度的关系如图所示:
与足量的碳在体积可变的恒压密闭容器中反应:C(S)+CO2(g)⇌2CO(g)平衡时,体系中气体体积分数与温度的关系如图所示:
(已知气体分压(P分)=气体总压(P总)×体积分数)
①该反应

②650 ℃ 时,反应达平衡后
 的转化率为
的转化率为③T ℃ 时,用平衡分压代替平衡浓度表示的化学平衡常数

您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】一定条件下,向容器中同时通入甲烷、氧气和水蒸气三种气体,发生的化学反应有:
(1)已知:H2O(1)=H2O(g) △H=+44.0kJ•mol-1,则表示H2燃烧热的热化学方程式为______ 。
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率,原因可能是______ 。
(3)恒温恒压体系(温度为T,压强为P)反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)达到平衡时,各气体的物质的量均为1mol,用某气体组分(B)的平衡分压(分压=总压×物质的量分数)代替物质的量浓度(cB)也可表示平衡常数(记作KP)。则:
①平衡常数Kp=______ 。
②再向容器中瞬时同时充入1molCH4、1mol H2O、1molCO、3molH2,此时 (正)
(正)______  (逆)(填“>”“<”或“=”)。
(逆)(填“>”“<”或“=”)。
③恒温恒容条件下,将CH4、H2O、CO、H2按照体积比1:1:1:3投料,能判断反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)达到平衡状态的是______ 。
A.密度保持不变
B.CO体积分数保持不变
C.平均摩尔质量保持不变
D.c(CO)和c(H2)的比保持不变
E.2molO-H断裂的同时,有3molH-H断裂
(4)向绝热恒容密闭容器中通入CH4和O2使反应CH4(g)+O2(g)⇌CO2(g)+2H2(g)达到平衡,正反应速率随时间变化的示意图如图。图中c点反应是否达到平衡:______ (填“是”或“否”)。

(5)利用重整反应CH4(g)+H2O(g)⇌CO(g)+3H2(g),设计一种熔融碳酸盐燃料电池,原理示意如图,电极B上发生的电极反应为______ 。
| 反应过程 | 化学方程式 | 焓变△H(kJ•mol-1) | 活化能Ea(kJ•mol-1) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)⇌CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)⇌CO(g)+3H2(g) | +206.2 | 240.1 |
| CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) | +158.6 | 243.9 |
(1)已知:H2O(1)=H2O(g) △H=+44.0kJ•mol-1,则表示H2燃烧热的热化学方程式为
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率,原因可能是
(3)恒温恒压体系(温度为T,压强为P)反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)达到平衡时,各气体的物质的量均为1mol,用某气体组分(B)的平衡分压(分压=总压×物质的量分数)代替物质的量浓度(cB)也可表示平衡常数(记作KP)。则:
①平衡常数Kp=
②再向容器中瞬时同时充入1molCH4、1mol H2O、1molCO、3molH2,此时
 (正)
(正) (逆)(填“>”“<”或“=”)。
(逆)(填“>”“<”或“=”)。③恒温恒容条件下,将CH4、H2O、CO、H2按照体积比1:1:1:3投料,能判断反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)达到平衡状态的是
A.密度保持不变
B.CO体积分数保持不变
C.平均摩尔质量保持不变
D.c(CO)和c(H2)的比保持不变
E.2molO-H断裂的同时,有3molH-H断裂
(4)向绝热恒容密闭容器中通入CH4和O2使反应CH4(g)+O2(g)⇌CO2(g)+2H2(g)达到平衡,正反应速率随时间变化的示意图如图。图中c点反应是否达到平衡:

(5)利用重整反应CH4(g)+H2O(g)⇌CO(g)+3H2(g),设计一种熔融碳酸盐燃料电池,原理示意如图,电极B上发生的电极反应为

您最近半年使用:0次
【推荐3】深入研究碳、氮元素的物质转化有着重要的实际意义, 按要求回答下列问题:
(1)合成尿素的反应为: 2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。
CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。
(2)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g) CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
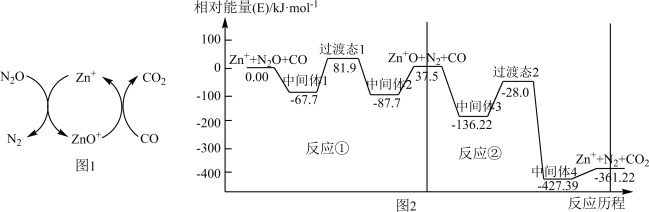
总反应:CO(g)+N2O(g) CO2(g)+N2(g) ΔH=
CO2(g)+N2(g) ΔH=___________ kJ·mol-1;该总反应的决速步是反应___________ (填“①”或“②”)
(3)已知:CO(g)+N2O(g) CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
(4)在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和 N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与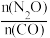 、在
、在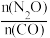 =1时N2O的转化率与
=1时N2O的转化率与 的变化曲线如图3所示:
的变化曲线如图3所示:
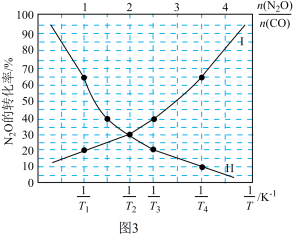
①表示N2O的转化率随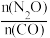 的变化曲线为
的变化曲线为___________ 曲线(填“I”或“Ⅱ”);
②T1___________ T2(填“>”或“<”);
③已知:该反应的标准平衡常数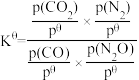 ,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=___________ (列出计算式)。
(1)合成尿素的反应为: 2NH3(g)+CO2(g)
 CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。
CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。| A.2v正(NH3) = v逆[CO(NH2)2] | B.压强不再变化 |
| C.混合气体的密度不再变化 | D.CO2的体积分数不再变化 |
(2)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g)
 CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
总反应:CO(g)+N2O(g)
 CO2(g)+N2(g) ΔH=
CO2(g)+N2(g) ΔH=(3)已知:CO(g)+N2O(g)
 CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。| A.升温 | B.恒容时,再充入CO |
| C.恒容时,再充入N2O | D.恒压时,再充入N2 |
(4)在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和 N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与
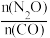 、在
、在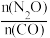 =1时N2O的转化率与
=1时N2O的转化率与 的变化曲线如图3所示:
的变化曲线如图3所示:
①表示N2O的转化率随
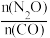 的变化曲线为
的变化曲线为②T1
③已知:该反应的标准平衡常数
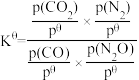 ,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H2= -47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3 = +640.5kJ/mol
写出 CO 气体还原 FeO 固体得到 Fe固体和 CO2气体的热化学反应方程式___________ ;
(2)在水溶液中,橙色的 Cr2O 与黄色的 CrO
与黄色的 CrO 有下列平衡关系:Cr2O
有下列平衡关系:Cr2O +H2O
+H2O 2 CrO
2 CrO +2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
①向上述溶液中加入NaOH溶液,溶液呈___________ 色,因为___________
②向已加入 NaOH 溶液的①中再加入过量的稀 H2SO4,则溶液呈___________ 色,因为___________ 。
(3)向原溶液中逐滴加入 Ba(NO3)2溶液(已知 BaCrO4为黄色沉淀),则平衡___________ ,溶液颜色将___________ 。
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H2= -47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3 = +640.5kJ/mol
写出 CO 气体还原 FeO 固体得到 Fe固体和 CO2气体的热化学反应方程式
(2)在水溶液中,橙色的 Cr2O
 与黄色的 CrO
与黄色的 CrO 有下列平衡关系:Cr2O
有下列平衡关系:Cr2O +H2O
+H2O 2 CrO
2 CrO +2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。①向上述溶液中加入NaOH溶液,溶液呈
②向已加入 NaOH 溶液的①中再加入过量的稀 H2SO4,则溶液呈
(3)向原溶液中逐滴加入 Ba(NO3)2溶液(已知 BaCrO4为黄色沉淀),则平衡
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】碳单质在工业上有多种用途。
(1)焦炭可用于制取水煤气。测得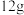 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了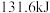 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是___________ 。
(2)活性炭可处理大气污染物 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:

①请结合上表数据,写出 与活性炭反应的化学方程式
与活性炭反应的化学方程式___________ 。
②上述反应 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。
Ⅰ.计算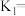
___________ 。
Ⅱ.根据上述信息判断,温度 和
和 的关系是(填序号)
的关系是(填序号)___________ 。
a.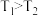 b.
b. c.无法比较
c.无法比较
③在T温度下反应达到平衡后,下列措施不能改变 的转化率的是
的转化率的是___________ 。
a.增大 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属。若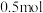 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到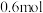 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是___________ 。
(1)焦炭可用于制取水煤气。测得
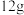 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了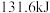 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是(2)活性炭可处理大气污染物
 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出
 与活性炭反应的化学方程式
与活性炭反应的化学方程式②上述反应
 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。Ⅰ.计算
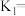
Ⅱ.根据上述信息判断,温度
 和
和 的关系是(填序号)
的关系是(填序号)a.
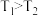 b.
b. c.无法比较
c.无法比较③在T温度下反应达到平衡后,下列措施不能改变
 的转化率的是
的转化率的是a.增大
 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F(3)工业上可用焦炭冶炼金属。若
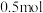 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到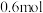 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】“碳中和”是指企业、团体或个人测算在一定时间内,直接或间接产生的温室气体排放总量,通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放,实现二氧化碳的“零排放”。简单地说,也就是让二氧化碳排放量“收支相抵”。利用CO2合成二甲醚在近年来深受人们的关注,可以很大程度地帮助实现“碳中和”,其合成过程由两种工艺组成。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
Ⅱ.逆水汽变换:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
请回答:
(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式为_______ 。
(2)向一绝热恒容密闭容器中充入等物质的量的CO2和H2进行反应Ⅱ,下面不能判断该反应已达到平衡状态的是_______ ;
A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.容器中n(CO2)/n(H2O)的值保持不变
E.CO2和H2的体积比保持不变
(3)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

下列说法正确的是_______ 。
A.图甲纵坐标表示CH3OH的平衡产率
B.P1<P2<P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因_______ 。
(4)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应II,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
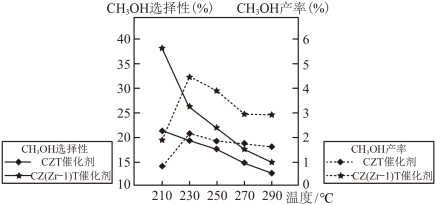
其中:CH3OH的选择性=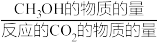 ×100%
×100%
在上述条件下合成甲醇的工业条件是_______。
(5)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应I和反应II,初始压强为p0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小20%。则达到平衡时H2的转化率为_______ ,反应II的平衡常数K=_______ (保留两位有效数字)。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1Ⅱ.逆水汽变换:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
请回答:
(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式为
(2)向一绝热恒容密闭容器中充入等物质的量的CO2和H2进行反应Ⅱ,下面不能判断该反应已达到平衡状态的是
A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.容器中n(CO2)/n(H2O)的值保持不变
E.CO2和H2的体积比保持不变
(3)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

下列说法正确的是
A.图甲纵坐标表示CH3OH的平衡产率
B.P1<P2<P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因
(4)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应II,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

其中:CH3OH的选择性=
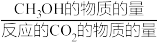 ×100%
×100%在上述条件下合成甲醇的工业条件是_______。
| A.210℃ | B.230℃ | C.催化CZT | D.催化剂CZ(Zr-1)T |
您最近半年使用:0次
【推荐1】化学变化中的能量转换对于生产具有重大意义和研究价值。回答下列问题:
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量__ (填“释放”或“吸收”。
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJ•mol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJ•mol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJ•mol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJ•mol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=__ kJ•mol-1。
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。
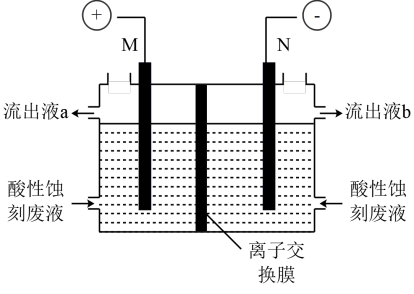
①再生的CuCl2蚀刻液为流出液__ (填“a”或“b”)。
②写出N极的电极反应:__ 。
③装置中使用___ 离子交换膜(填“阳”或“阴”)。若电解池工作前,阴极室和阳极室中电解液质量相等,当转移0.1mol电子,流出液未流出时,两侧电解液的质量差为__ g。
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJ•mol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJ•mol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJ•mol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJ•mol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。

①再生的CuCl2蚀刻液为流出液
②写出N极的电极反应:
③装置中使用
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
(1)一定温度下,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,发生反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),60min开始达到平衡。反应中CO2物质的量随时间变化如表所示:
CO(NH2)2(l)+H2O(g),60min开始达到平衡。反应中CO2物质的量随时间变化如表所示:
①该反应的平衡常数表达式为K=________ 。
②NH3的平衡转化率为_______ 。
(2)一定条件下,恒容容器中,若原料气中的NH3和CO2的物质的量之比,发生反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),x与CO2的平衡转化率(α)的关系如图所示:
CO(NH2)2(l)+H2O(g),x与CO2的平衡转化率(α)的关系如图所示:
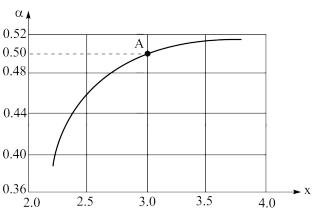
①α随着x增大而增大的原因是_______ 。
②A点平衡时容器内总压强为P0kPa,则上述反应的平衡常数Kp=_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)以惰性电极电解尿素[CO(NH2)2]的碱性溶液可制取氢气,装置如图所示。
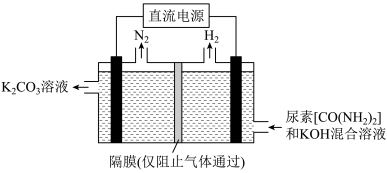
该装置阳极的电极反应方程式为________ ,若两极共收集到气体22.4L(标准状况),则消耗的尿素的质量为_______ (忽略气体的溶解)。
(1)一定温度下,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,发生反应2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g),60min开始达到平衡。反应中CO2物质的量随时间变化如表所示:
CO(NH2)2(l)+H2O(g),60min开始达到平衡。反应中CO2物质的量随时间变化如表所示:| 时间/min | 0 | 20 | 60 | 80 | |
| n(CO2)/mol | 0.10 | 0.06 | 0.04 | 0.04 |
②NH3的平衡转化率为
(2)一定条件下,恒容容器中,若原料气中的NH3和CO2的物质的量之比,发生反应2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g),x与CO2的平衡转化率(α)的关系如图所示:
CO(NH2)2(l)+H2O(g),x与CO2的平衡转化率(α)的关系如图所示:
①α随着x增大而增大的原因是
②A点平衡时容器内总压强为P0kPa,则上述反应的平衡常数Kp=
(3)以惰性电极电解尿素[CO(NH2)2]的碱性溶液可制取氢气,装置如图所示。

该装置阳极的电极反应方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
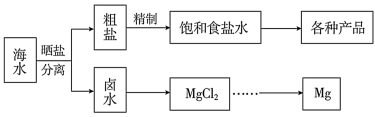
(1)用NaCl作原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是______ 。
②写出产物氯气制备“84”消毒液的离子方程式:______ 。
③NaCl也是侯氏制碱法的重要反应物之一,写出侯氏制碱法过程中涉及到的两个主要方程式:__________ , __________ 。
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O―→NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为________ mol。
(3)海水提镁的一段工艺流程如下图:
卤水
 Mg(OH)2
Mg(OH)2 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2 Mg
Mg
①采用石墨电极电解熔融的氯化镁,发生反应的化学方程式_________ ;
②电解时,若有少量水存在,则不能得到镁单质,写出有关反应的化学方程式__________ 。
(4)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
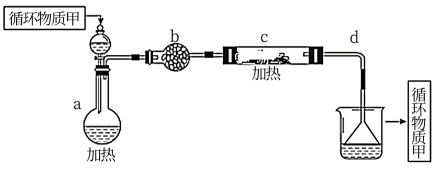
①上图中,装置a由________ 、________ 、双孔塞和导管组成。
②循环物质甲的名称是________ 。
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是______ 。

(1)用NaCl作原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是
②写出产物氯气制备“84”消毒液的离子方程式:
③NaCl也是侯氏制碱法的重要反应物之一,写出侯氏制碱法过程中涉及到的两个主要方程式:
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O―→NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为
(3)海水提镁的一段工艺流程如下图:
卤水
 Mg(OH)2
Mg(OH)2 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2 Mg
Mg①采用石墨电极电解熔融的氯化镁,发生反应的化学方程式
②电解时,若有少量水存在,则不能得到镁单质,写出有关反应的化学方程式
(4)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:

①上图中,装置a由
②循环物质甲的名称是
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是
您最近半年使用:0次



