深入研究碳、氮元素的物质转化有着重要的实际意义, 按要求回答下列问题:
(1)合成尿素的反应为: 2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。
CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。
(2)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g) CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
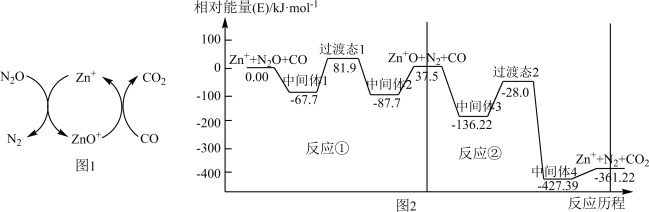
总反应:CO(g)+N2O(g) CO2(g)+N2(g) ΔH=
CO2(g)+N2(g) ΔH=___________ kJ·mol-1;该总反应的决速步是反应___________ (填“①”或“②”)
(3)已知:CO(g)+N2O(g) CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
(4)在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和 N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与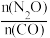 、在
、在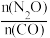 =1时N2O的转化率与
=1时N2O的转化率与 的变化曲线如图3所示:
的变化曲线如图3所示:
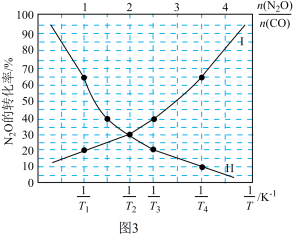
①表示N2O的转化率随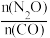 的变化曲线为
的变化曲线为___________ 曲线(填“I”或“Ⅱ”);
②T1___________ T2(填“>”或“<”);
③已知:该反应的标准平衡常数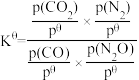 ,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=___________ (列出计算式)。
(1)合成尿素的反应为: 2NH3(g)+CO2(g)
 CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。
CO(NH2)2(g)+H2O(l),若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是___________(填标号)。| A.2v正(NH3) = v逆[CO(NH2)2] | B.压强不再变化 |
| C.混合气体的密度不再变化 | D.CO2的体积分数不再变化 |
(2)CO用于处理大气污染物N2O的反应为CO(g)+N2O(g)
 CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
CO2(g)+N2(g)。在Zn+作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
总反应:CO(g)+N2O(g)
 CO2(g)+N2(g) ΔH=
CO2(g)+N2(g) ΔH=(3)已知:CO(g)+N2O(g)
 CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。
CO2(g)+N2(g)的速率方程为v=k·c(N2O),k为速率常数,只与温度有关。为提高反应速率,可采取的措施是___________(填字母序号)。| A.升温 | B.恒容时,再充入CO |
| C.恒容时,再充入N2O | D.恒压时,再充入N2 |
(4)在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和 N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与
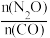 、在
、在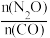 =1时N2O的转化率与
=1时N2O的转化率与 的变化曲线如图3所示:
的变化曲线如图3所示:
①表示N2O的转化率随
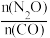 的变化曲线为
的变化曲线为②T1
③已知:该反应的标准平衡常数
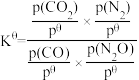 ,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
,其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=
2023·广东广州·模拟预测 查看更多[3]
更新时间:2024-02-25 22:44:58
|
相似题推荐
【推荐1】“绿水青山就是金山银山。”研究如何将NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1) 可在一定条件下转化为
可在一定条件下转化为 。已知:
。已知:

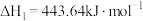
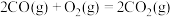
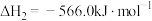
甲醇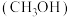 是一种重要的化工原料,也可以直接用作燃料。试写出
是一种重要的化工原料,也可以直接用作燃料。试写出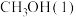 在氧气中完全燃烧生成
在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:___________ 。
(2)科研人员研发出一种由强碱溶液作电解质溶液的新型甲醇手机电池,充满电后手机可连续使用一个月,则放电时,甲醇在___________ (填“正”或“负”)极发生反应,其电极反应式为___________ 。
(3) 可在一定条件下转化为
可在一定条件下转化为 。向
。向 密闭容器中通入
密闭容器中通入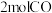 和
和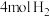 ,在适合的催化剂和
,在适合的催化剂和 温度下,发生反应
温度下,发生反应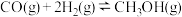
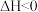 ,保持容器容积一直不变,
,保持容器容积一直不变, 时,反应达到平衡状态,
时,反应达到平衡状态,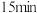 时改变温度为
时改变温度为 ,
, 时反应再次达到平衡状态,部分数据如下表:
时反应再次达到平衡状态,部分数据如下表:
① 时反应达到平衡,此时
时反应达到平衡,此时 的转化率为
的转化率为___________ ;化学平衡常数
___________
②
___________ (填“>”“<”或“=”) ;理由
;理由___________
③ 温度下,既能增大反应速率又能提高
温度下,既能增大反应速率又能提高 平䘖转化率的措施有
平䘖转化率的措施有___________ (填一种)。
④恒温恒容时,可以判断反应 达到平衡状态的有
达到平衡状态的有___________ (填标号)。
A.
B.容器内混合气体的压强不再改变
C. 和
和 的转化率的比值保持不变
的转化率的比值保持不变
D.容器内混合气体的平均相对分子质量不变
(1)
 可在一定条件下转化为
可在一定条件下转化为 。已知:
。已知:
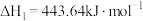
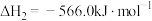
甲醇
 是一种重要的化工原料,也可以直接用作燃料。试写出
是一种重要的化工原料,也可以直接用作燃料。试写出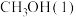 在氧气中完全燃烧生成
在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:(2)科研人员研发出一种由强碱溶液作电解质溶液的新型甲醇手机电池,充满电后手机可连续使用一个月,则放电时,甲醇在
(3)
 可在一定条件下转化为
可在一定条件下转化为 。向
。向 密闭容器中通入
密闭容器中通入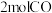 和
和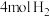 ,在适合的催化剂和
,在适合的催化剂和 温度下,发生反应
温度下,发生反应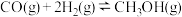
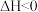 ,保持容器容积一直不变,
,保持容器容积一直不变, 时,反应达到平衡状态,
时,反应达到平衡状态,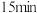 时改变温度为
时改变温度为 ,
, 时反应再次达到平衡状态,部分数据如下表:
时反应再次达到平衡状态,部分数据如下表:| 反应时间 |  | 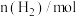 | 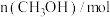 |
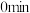 | 2 | 4 | 0 |
 | 1 | ||
 | 0.2 |
 时反应达到平衡,此时
时反应达到平衡,此时 的转化率为
的转化率为
②

 ;理由
;理由③
 温度下,既能增大反应速率又能提高
温度下,既能增大反应速率又能提高 平䘖转化率的措施有
平䘖转化率的措施有④恒温恒容时,可以判断反应
 达到平衡状态的有
达到平衡状态的有A.

B.容器内混合气体的压强不再改变
C.
 和
和 的转化率的比值保持不变
的转化率的比值保持不变 D.容器内混合气体的平均相对分子质量不变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】解答下列问题:
(1)2017年中科院某研究团队通过设计一种新型Na—Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+ O2(g)=H2O(l) ΔH1=-akJ·mol-1
O2(g)=H2O(l) ΔH1=-akJ·mol-1
C8H18(l)+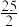 O2(g)=8CO2(g)+9H2O(l) ΔH2=-bkJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH2=-bkJ·mol-1
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式:___________ 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。工业上常用催化还原法和碱吸收法处理SO2气体。1molCH4完全燃烧生成气态水和1molS(g)燃烧的能量变化如下图所示:

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式:___________ 。
(3)合成氨在工业生产中具有重要意义。在合成氨工业中I2O5常用于定量测定CO的含量。
已知2I2(s)+5O2(g)=2I2O5(s) ΔH=-76kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1。
则该测定反应的热化学方程式为___________ 。
(4)化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH=+393.5kJ·mol-1
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH=___________ kJ·mol-1。
(5)氮及其化合物与人类生产、生活密切相关。氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36LCO时,放出的热量为___________ kJ(用含有a和b的代数式表示)。
(6)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析, 晶体中所含化学键的类型有
晶体中所含化学键的类型有___________ ,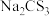 水溶液显
水溶液显___________ (填“酸性”、“碱性”或“中性”)。
(1)2017年中科院某研究团队通过设计一种新型Na—Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+
 O2(g)=H2O(l) ΔH1=-akJ·mol-1
O2(g)=H2O(l) ΔH1=-akJ·mol-1C8H18(l)+
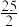 O2(g)=8CO2(g)+9H2O(l) ΔH2=-bkJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH2=-bkJ·mol-1试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式:
(2)直接排放含SO2的烟气会形成酸雨,危害环境。工业上常用催化还原法和碱吸收法处理SO2气体。1molCH4完全燃烧生成气态水和1molS(g)燃烧的能量变化如下图所示:

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式:
(3)合成氨在工业生产中具有重要意义。在合成氨工业中I2O5常用于定量测定CO的含量。
已知2I2(s)+5O2(g)=2I2O5(s) ΔH=-76kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1。
则该测定反应的热化学方程式为
(4)化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH=+393.5kJ·mol-1
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH=
(5)氮及其化合物与人类生产、生活密切相关。氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36LCO时,放出的热量为
(6)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,
 晶体中所含化学键的类型有
晶体中所含化学键的类型有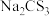 水溶液显
水溶液显
您最近一年使用:0次
【推荐3】氮的化合物的转化和综合利用是目前研究的热点之一。回答下列问题:
(1)已知:Ⅰ. N2(g)+2O2(g) N2O4(g) △H= +10.6kJ·mol-1;
N2O4(g) △H= +10.6kJ·mol-1;
Ⅱ.N2O4 (g) 2NO2(g) △H= +55.3 kJ·mol-1;
2NO2(g) △H= +55.3 kJ·mol-1;
Ⅲ. N2H4(l)+O2(g) N2(g)+2H2O(g) △H= -534.1 kJ·mol-1。
N2(g)+2H2O(g) △H= -534.1 kJ·mol-1。
①液态肼与二氧化氮气体反应生成氮气和水蒸气的热化学方程式为_______________________ 。
②一定温度下,将2 mol N2(g)和2 mol O2(g)充入10 L刚性密闭容器中发生反应Ⅰ和Ⅱ,10 min末达到平衡时测得容器中n(N2)=1.2 mol、n(NO2)=1.2 mol。0~10 min内,反应Ⅰ用O2的浓度变化表示的平均反应速率v(O2)=_________________ ;反应Ⅱ的平衡常数K=_____________ (保留两位有效数字)。
(2)N2分子在催化剂的作用下发生的一系列转化如图所示:
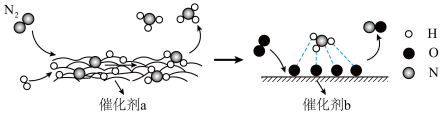
①催化剂b表面发生的化学反应方程式为_______________________________ 。
②下列叙述正确的是__________ 。
A. 在反应过程中作催化剂
在反应过程中作催化剂
B.催化剂降低了该反应的活化能
C.催化剂a表面发生了分解反应和化合反应
(3)以固体氧化物为电解质(能传导O2-)的新型N2H4燃料电池属于环境友好电池(产物对环境无污染),其结构如下图所示:

电极甲上发生的电极反应式为__________________________ ,消耗3.2 g N2H4时,理论上消耗O2的体积(标准状况)为_______ L。
(1)已知:Ⅰ. N2(g)+2O2(g)
 N2O4(g) △H= +10.6kJ·mol-1;
N2O4(g) △H= +10.6kJ·mol-1;Ⅱ.N2O4 (g)
 2NO2(g) △H= +55.3 kJ·mol-1;
2NO2(g) △H= +55.3 kJ·mol-1;Ⅲ. N2H4(l)+O2(g)
 N2(g)+2H2O(g) △H= -534.1 kJ·mol-1。
N2(g)+2H2O(g) △H= -534.1 kJ·mol-1。①液态肼与二氧化氮气体反应生成氮气和水蒸气的热化学方程式为
②一定温度下,将2 mol N2(g)和2 mol O2(g)充入10 L刚性密闭容器中发生反应Ⅰ和Ⅱ,10 min末达到平衡时测得容器中n(N2)=1.2 mol、n(NO2)=1.2 mol。0~10 min内,反应Ⅰ用O2的浓度变化表示的平均反应速率v(O2)=
(2)N2分子在催化剂的作用下发生的一系列转化如图所示:

①催化剂b表面发生的化学反应方程式为
②下列叙述正确的是
A.
 在反应过程中作催化剂
在反应过程中作催化剂 B.催化剂降低了该反应的活化能
C.催化剂a表面发生了分解反应和化合反应
(3)以固体氧化物为电解质(能传导O2-)的新型N2H4燃料电池属于环境友好电池(产物对环境无污染),其结构如下图所示:

电极甲上发生的电极反应式为
您最近一年使用:0次
【推荐1】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH 1 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2 kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3 kJ·mol-1
则CO(g)+2H2(g) CH3OH(g) ΔH =
CH3OH(g) ΔH =___________ kJ·mol-1。
(2)一定压强下,在容积为2L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
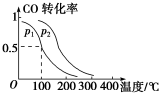
① 下列说法正确的是___________
A.若容器内气体的密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.若容器内各气体压强恒定,反应达到平衡状态
D.反应中,催化剂能使平衡向正反应方向移动
② 上述反应中,ΔH___________ 0 (填“>”、“<”或“=”)
③ p2___________ p1 (填“大于”、“小于”或“等于”);
④ 100 ℃时,该反应的化学平衡常数K=___________ ;
(3)某科研小组用SO2为原料制取硫酸。
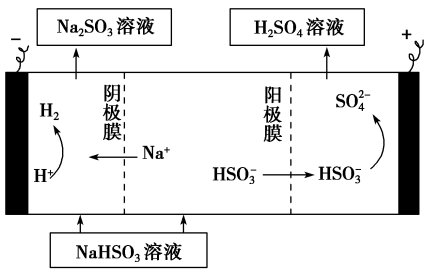
用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出阳极反应的电极反应式___________ 。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH 1 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2 kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3 kJ·mol-1
则CO(g)+2H2(g)
 CH3OH(g) ΔH =
CH3OH(g) ΔH =(2)一定压强下,在容积为2L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)
 CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
① 下列说法正确的是
A.若容器内气体的密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.若容器内各气体压强恒定,反应达到平衡状态
D.反应中,催化剂能使平衡向正反应方向移动
② 上述反应中,ΔH
③ p2
④ 100 ℃时,该反应的化学平衡常数K=
(3)某科研小组用SO2为原料制取硫酸。
用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出阳极反应的电极反应式

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】在2L恒温恒容密闭容器中投入2molSO2和1molO2在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。___________ ;平衡时,SO2的转化率为___________ 。
(2)下列叙述能判断该反应达到平衡状态的是___________ (填序号)。
①容器中压强不再改变
②容器中气体密度不再改变
③SO3的质量不再改变
④O2的物质的量浓度不再改变
⑤SO2的消耗速率和SO3的生成速率相等
(3)以下操作会引起化学反应速率变快的是___________ (填字母)。
A.向容器中通入氦气 B.升高温度 C.扩大容器的容积 D.向容器中通入O2 E.使用催化剂
(4)25min时,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(5)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:___________ 。(填“正极”或“负极”)
②电解质溶液中OH-离子向___________ 移动(填“电极a”或“电极b”)。
③电极b的电极反应式为___________ 。

(2)下列叙述能判断该反应达到平衡状态的是
①容器中压强不再改变
②容器中气体密度不再改变
③SO3的质量不再改变
④O2的物质的量浓度不再改变
⑤SO2的消耗速率和SO3的生成速率相等
(3)以下操作会引起化学反应速率变快的是
A.向容器中通入氦气 B.升高温度 C.扩大容器的容积 D.向容器中通入O2 E.使用催化剂
(4)25min时,正反应速率
(5)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
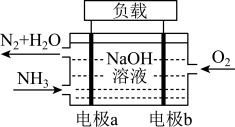
②电解质溶液中OH-离子向
③电极b的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】“绿水青山就是金山银山”,研究并消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
Ⅰ.已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ∙mol−1
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ∙mol−1
N2(g)+O2(g)=2NO(g) ΔH3=+181 kJ∙mol−1
(1)若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 _________ ,该反应自发进行的条件是_________ 。(填“高温”或“低温”或“任何温度”)
Ⅱ.为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中发生反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH1=-746.8 kJ∙mol−1
2CO2(g)+N2(g) ΔH1=-746.8 kJ∙mol−1
(2)T℃时,将体积比为1:1的CO和NO的混合气体充入刚性容器中发生上述反应,每隔一定时间测得容器内的压强如下表所示:
①反应开始10 min内,以CO的压强变化表示该反应的平均反应速率为_________ kPa/min,该反应的平衡常数Kp=_________ kPa-1 (用分数表示,Kp为用各气体分压表示的平衡常数。)
②反应达到平衡后,若再向容器中加入2 mol CO2(g)和1 mol N2,再次达到平衡时NO的百分含量将_________ (填“增大””减小”或”不变”)。
(3)实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________ (填“>”“<”或“ ” ) k逆增大的倍数。
” ) k逆增大的倍数。
②若在1 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
_________ 。
Ⅰ.已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ∙mol−1
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ∙mol−1
N2(g)+O2(g)=2NO(g) ΔH3=+181 kJ∙mol−1
(1)若某反应的平衡常数表达式为K=
 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 Ⅱ.为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中发生反应2NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH1=-746.8 kJ∙mol−1
2CO2(g)+N2(g) ΔH1=-746.8 kJ∙mol−1(2)T℃时,将体积比为1:1的CO和NO的混合气体充入刚性容器中发生上述反应,每隔一定时间测得容器内的压强如下表所示:
| 时间/min |  | 10 | 20 | 30 | 40 | 50 | 60 |
| kPa | 1.08 | 1.02 | 0.97 | 0.93 | 0.90 | 0.90 | 0.90 |
②反应达到平衡后,若再向容器中加入2 mol CO2(g)和1 mol N2,再次达到平衡时NO的百分含量将
(3)实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2)·c2(CO2),k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数
 ” ) k逆增大的倍数。
” ) k逆增大的倍数。②若在1 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】工业上一种制取硝酸的流程如图,请回答下列问题:
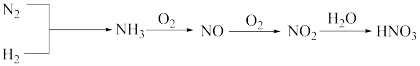
(1)在工业上制硝酸的生产中,写出由NH3转化为NO的化学方程式:___________ 。
(2)生产硝酸的过程中常会产生一些氮的氧化物,用NH3还原法处理时,能生成两种无污染的产物。写出在催化剂作用下,NH3还原法处理含NO2的尾气反应的化学方程式:___________ 。
(3)某温度下,在2L密闭容器中。通入等物质的量的N2和H2,在催化剂作用下发生反应,各物质的物质的量随时间的变化如图所示。
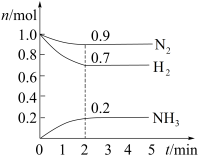
①反应进行到2min时,正反应速率和逆反应速率___________ (填“相等”或“不相等”)。
②反应开始至2min,用N2表示的平均反应速率为___________ ,H2的转化率为___________ 。混合气体中N2的体积分数为___________ 。
③向密闭容器中通入amolA(g)和bmolB(g),发生反应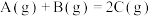 ,当改变下列条件时,会加快反应速率的是
,当改变下列条件时,会加快反应速率的是___________ (填标号)。
a.降低温度
b.保持容器的体积不变,充入氦气(不参与反应)
c.保持容器的体积不变,增加A(g)的物质的量
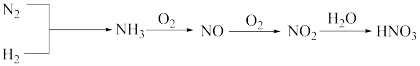
(1)在工业上制硝酸的生产中,写出由NH3转化为NO的化学方程式:
(2)生产硝酸的过程中常会产生一些氮的氧化物,用NH3还原法处理时,能生成两种无污染的产物。写出在催化剂作用下,NH3还原法处理含NO2的尾气反应的化学方程式:
(3)某温度下,在2L密闭容器中。通入等物质的量的N2和H2,在催化剂作用下发生反应,各物质的物质的量随时间的变化如图所示。

①反应进行到2min时,正反应速率和逆反应速率
②反应开始至2min,用N2表示的平均反应速率为
③向密闭容器中通入amolA(g)和bmolB(g),发生反应
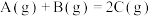 ,当改变下列条件时,会加快反应速率的是
,当改变下列条件时,会加快反应速率的是a.降低温度
b.保持容器的体积不变,充入氦气(不参与反应)
c.保持容器的体积不变,增加A(g)的物质的量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①一定条件下,在一个容积固定为2L的密闭容器中充入0.8mol NO和1.2mol CO,开始反应至2min时测得CO转化率为20%,则用N2表示的平均反应速率为v(N2)=_______ 。
②对于气相反应,用某组分(B)的平衡压强[P(B)]代替物质的量浓度[c(B)]也可以表示平衡常数(记作KP),则该反应平衡常数的表达式KP=_______ 。
③该反应在低温下能自发进行,该反应的△H________ 0(填“>”、“<”)
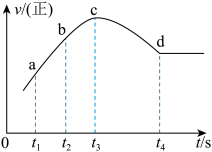
④在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2),则下列说法不正确的是________ (填编号)
A. 反应在c点未达到平衡状态
B. 反应速率a点小于b点
C. 反应物浓度a点大于b点
D. NO的转化率:t1~t2>t2~t3
(2)使用甲醇汽油可以减少汽车尾气对环境的污染.某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应CO(g)+2H2(g) CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)_________ v(逆)(填“>”、“<”或“=”),判断的理由_________ 。
(3)二甲醚也是清洁能源.用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比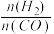 的变化曲线如图:
的变化曲线如图:

①a、b、c按从大到小的顺序排序为_______ 。
②某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3所示,关于温度和压强的关系判断正确的是_________ 。
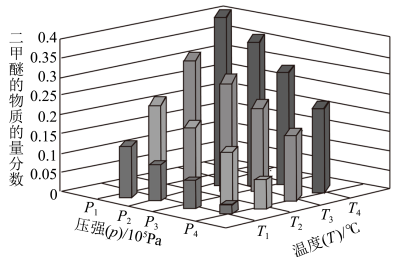
A. P3>P 2,T3>T 2 B. P 1>P 3,T 1>T 3
C. P 2>P 4,T 4>T 2 D. P 1>P 4,T 2>T 3
③在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___ 。
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E. 混合气体的密度减小 F. 氢气的转化率减小
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g)+N2(g)
2CO2(g)+N2(g)①一定条件下,在一个容积固定为2L的密闭容器中充入0.8mol NO和1.2mol CO,开始反应至2min时测得CO转化率为20%,则用N2表示的平均反应速率为v(N2)=
②对于气相反应,用某组分(B)的平衡压强[P(B)]代替物质的量浓度[c(B)]也可以表示平衡常数(记作KP),则该反应平衡常数的表达式KP=
③该反应在低温下能自发进行,该反应的△H
④在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2),则下列说法不正确的是

A. 反应在c点未达到平衡状态
B. 反应速率a点小于b点
C. 反应物浓度a点大于b点
D. NO的转化率:t1~t2>t2~t3
(2)使用甲醇汽油可以减少汽车尾气对环境的污染.某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应CO(g)+2H2(g)
 CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)(3)二甲醚也是清洁能源.用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比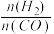 的变化曲线如图:
的变化曲线如图:
①a、b、c按从大到小的顺序排序为
②某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3所示,关于温度和压强的关系判断正确的是

A. P3>P 2,T3>T 2 B. P 1>P 3,T 1>T 3
C. P 2>P 4,T 4>T 2 D. P 1>P 4,T 2>T 3
③在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E. 混合气体的密度减小 F. 氢气的转化率减小
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】温室效应和污染正在成为日益严重的环境问题。
Ⅰ.煤制得的化工原料中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
①水解反应:COS(g)+H2O(g) H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
②氢解反应:COS(g)+H2(g) H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
(1)请计算CO(g)+H2O(g) H2(g)+CO2(g) ΔH3=
H2(g)+CO2(g) ΔH3=_________ kJ·mol-1。
(2)在定温定容条件下,下列事实说明反应①达到平衡状态的是________ (填字母)。
A.容器的压强不再改变 B.混合气体的密度不再改变
C.H2S的百分含量不再改变 D.生成1 mol H—O键,同时生成1 mol H—S键
(3)一定温度和压强下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
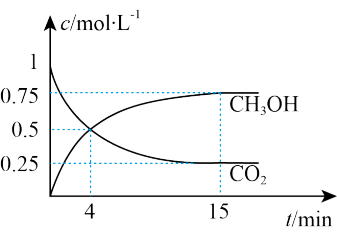
①反应进行到4 min 时,v(正)______ v(逆) (填“>”“<"或“=”)。0~4 min,H2的平均反应速率v(H2)=___ mol· L-1·min-1。
②写出一种在该温度下提高CH3OH产率的方法_____________________ 。
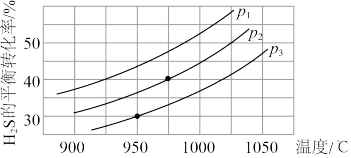
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:
2H2S(g) 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
(4)该反应ΔH_________ 0;ΔS________ 0。(填“>”或“<”)
(5)图中压强P1、P2、P3由大到小的顺序是__________________ 。
(6)在压强为P2,温度为975℃时,该反应的平衡常数K=___________ (保留2位有效数字)
Ⅰ.煤制得的化工原料中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
①水解反应:COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1②氢解反应:COS(g)+H2(g)
 H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1(1)请计算CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH3=
H2(g)+CO2(g) ΔH3=(2)在定温定容条件下,下列事实说明反应①达到平衡状态的是
A.容器的压强不再改变 B.混合气体的密度不再改变
C.H2S的百分含量不再改变 D.生成1 mol H—O键,同时生成1 mol H—S键
(3)一定温度和压强下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
①反应进行到4 min 时,v(正)
②写出一种在该温度下提高CH3OH产率的方法
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:
2H2S(g)
 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。(4)该反应ΔH
(5)图中压强P1、P2、P3由大到小的顺序是
(6)在压强为P2,温度为975℃时,该反应的平衡常数K=

您最近一年使用:0次



