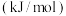1 . 烟气脱硝技术是环境科学研究的热点。实验室模拟 将烟气中的
将烟气中的 深度氧化为
深度氧化为 ,并进一步将
,并进一步将 转化获得含氮产品,流程示意图如下。
转化获得含氮产品,流程示意图如下。
i.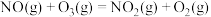
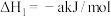
ii.

iii.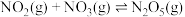

(1) 被
被 深度氧化,补全热化学方程式:
深度氧化,补全热化学方程式:


___________ 
(2)一定条件下,不同温度时, 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。
___________  (填“>”或“<”)。
(填“>”或“<”)。
②8s时, 的浓度不同的原因是
的浓度不同的原因是___________ 。
(3)一定条件下,NO的初始浓度为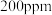 时,不同反应时间,深度氧化器中
时,不同反应时间,深度氧化器中 的浓度随
的浓度随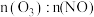 的变化如图所示。反应过程中
的变化如图所示。反应过程中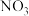 的浓度极低。
的浓度极低。 时,深度氧化器中发生的反应主要是
时,深度氧化器中发生的反应主要是___________ (填“i”“ii”或“iii”)。
② 时,
时, 的浓度随
的浓度随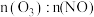 变化的原因是
变化的原因是___________ 。
(4) 且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是
且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是___________ 。
(5)深度氧化后的烟气通过吸收器完全转化为硝酸盐产品,产品浓度的测定方法如下。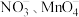 的还原产物分别是
的还原产物分别是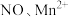 。产品中
。产品中 的物质的量浓度为
的物质的量浓度为___________  。
。
 将烟气中的
将烟气中的 深度氧化为
深度氧化为 ,并进一步将
,并进一步将 转化获得含氮产品,流程示意图如下。
转化获得含氮产品,流程示意图如下。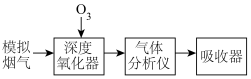
i.
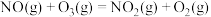
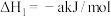
ii.


iii.
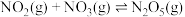

(1)
 被
被 深度氧化,补全热化学方程式:
深度氧化,补全热化学方程式:


(2)一定条件下,不同温度时,
 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。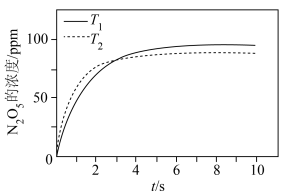

 (填“>”或“<”)。
(填“>”或“<”)。②8s时,
 的浓度不同的原因是
的浓度不同的原因是(3)一定条件下,NO的初始浓度为
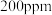 时,不同反应时间,深度氧化器中
时,不同反应时间,深度氧化器中 的浓度随
的浓度随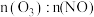 的变化如图所示。反应过程中
的变化如图所示。反应过程中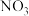 的浓度极低。
的浓度极低。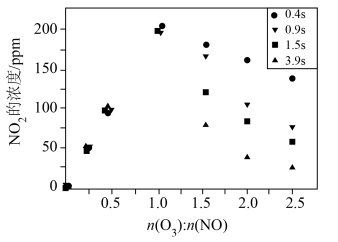
 时,深度氧化器中发生的反应主要是
时,深度氧化器中发生的反应主要是②
 时,
时, 的浓度随
的浓度随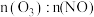 变化的原因是
变化的原因是(4)
 且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是
且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是(5)深度氧化后的烟气通过吸收器完全转化为硝酸盐产品,产品浓度的测定方法如下。
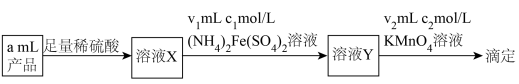
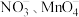 的还原产物分别是
的还原产物分别是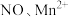 。产品中
。产品中 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
名校
2 . 金属矿物常以硫化物形式存在,如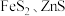 等。
等。
Ⅰ.掺烧 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸
(1)已知: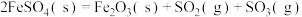 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在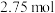 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。
① 与
与 反应的热化学方程式为
反应的热化学方程式为_________ 。
②将 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括_________ (填字母)。
 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染
(2) 常带一定量的结晶水。
常带一定量的结晶水。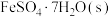 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。
_________  。
。
②为维持炉内温度基本不变, 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比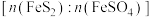 应
应_________ 。(填“增大”“减小”或“不变”)。
Ⅱ.浸出法处理
(3) 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:
ⅰ.
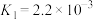
ⅱ.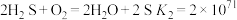
①平衡常数 的表达式为
的表达式为_________ 。
②仅发生反应ⅰ时, 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:_________ 。
(4)从平衡移动角度解释通入 在
在 酸浸过程中的作用:
酸浸过程中的作用:_________ 。
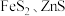 等。
等。Ⅰ.掺烧
 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸(1)已知:
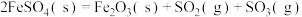 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在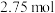 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。①
 与
与 反应的热化学方程式为
反应的热化学方程式为②将
 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染(2)
 常带一定量的结晶水。
常带一定量的结晶水。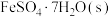 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。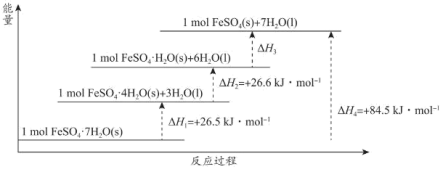

 。
。②为维持炉内温度基本不变,
 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比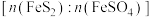 应
应Ⅱ.浸出法处理

(3)
 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:ⅰ.

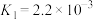
ⅱ.
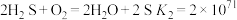
①平衡常数
 的表达式为
的表达式为②仅发生反应ⅰ时,
 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:(4)从平衡移动角度解释通入
 在
在 酸浸过程中的作用:
酸浸过程中的作用:
您最近一年使用:0次
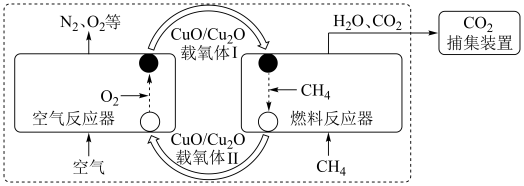
3 . 我国科学家设计的化学链重整联合CO2捕集制H2系统如下图所示:
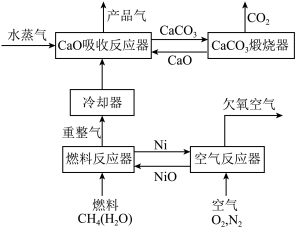
(1)空气反应器中发生___________ 反应(填“吸热”或“放热”)。
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有___________ 。
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =___________ 。
② 反应温度对H2产率(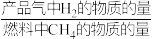 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
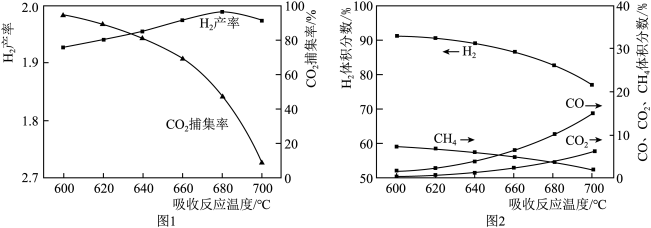
结合化学方程式说明图1中温度升高CO2捕集率降低的原因___________ ;解释图2中温度升高H2体积分数降低的原因___________ 。
(4)燃料反应器和吸收反应器中加入水蒸气的作用___________ 。

(1)空气反应器中发生
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =
② 反应温度对H2产率(
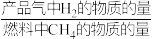 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
结合化学方程式说明图1中温度升高CO2捕集率降低的原因
(4)燃料反应器和吸收反应器中加入水蒸气的作用
您最近一年使用:0次
名校
解题方法
4 . 将 作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、
作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、 资源化利用等显著优势。
资源化利用等显著优势。
(1)①查阅资料,计算 氧化
氧化 脱氢反应的反应热
脱氢反应的反应热
i.查阅______ 的燃烧热数据(填化学式)。
ii.查阅水的汽化热:
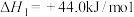 。
。
利用上述数据,得如下热化学方程式:
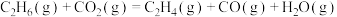
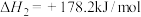
②检验产物有乙烯生成的操作和现象______ 。
(2)结合键能数据分析 氧化
氧化 脱氢反应的挑战和难点
脱氢反应的挑战和难点______ 。
(3)推测 催化
催化 氧化
氧化 脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
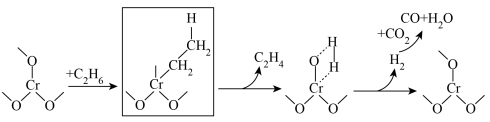
(4)分析投料体积比对反应的影响(650℃,0.1MPa, 催化剂)
催化剂)
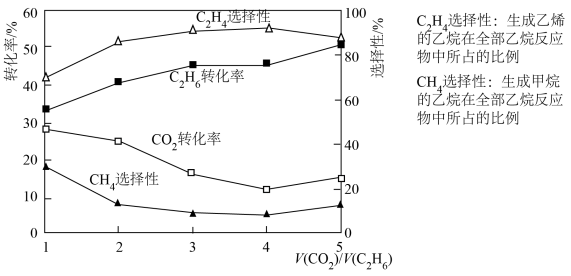
①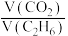 从1提高到5,
从1提高到5, 转化率从33.3%增加到50.5%,简述
转化率从33.3%增加到50.5%,简述 转化率增加的原因
转化率增加的原因______ 。(体积比为3和4时乙烷转化率基本相同)
②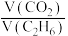 从4提高到5,副反应的化学方程式可能是
从4提高到5,副反应的化学方程式可能是______ 。
 作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、
作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、 资源化利用等显著优势。
资源化利用等显著优势。(1)①查阅资料,计算
 氧化
氧化 脱氢反应的反应热
脱氢反应的反应热i.查阅
ii.查阅水的汽化热:

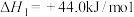 。
。利用上述数据,得如下热化学方程式:
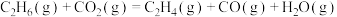
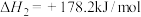
②检验产物有乙烯生成的操作和现象
(2)结合键能数据分析
 氧化
氧化 脱氢反应的挑战和难点
脱氢反应的挑战和难点键 |
|
|
|
键能 | 347.7 | 413.4 | 745 |
(3)推测
 催化
催化 氧化
氧化 脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
(4)分析投料体积比对反应的影响(650℃,0.1MPa,
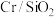 催化剂)
催化剂)
①
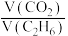 从1提高到5,
从1提高到5, 转化率从33.3%增加到50.5%,简述
转化率从33.3%增加到50.5%,简述 转化率增加的原因
转化率增加的原因②
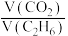 从4提高到5,副反应的化学方程式可能是
从4提高到5,副反应的化学方程式可能是
您最近一年使用:0次
名校
5 . 氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g) 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为_______ 。在一定条件下氨的平衡含量如表:
①该反应为_______ (填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是_______ 。
(2)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。

①曲线a对应的温度是____________ 。
②M、N、Q点平衡常数K的大小关系是______________ 。
(3)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为_______ 。

(4)NH3转化为NO是工业制取硝酸的重要一步。已知:100kPa、298K时:
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=—1268kJ/mol
2N2(g)+6H2O(g) ΔH=—1268kJ/mol
2NO(g) N2(g)+O2(g) ΔH=—180.5kJ/mol
N2(g)+O2(g) ΔH=—180.5kJ/mol
请写出NH3转化为NO的热化学方程式_______ 。
(1)反应N2(g)+3H2(g)
 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
(2)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。

①曲线a对应的温度是
②M、N、Q点平衡常数K的大小关系是
(3)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为

(4)NH3转化为NO是工业制取硝酸的重要一步。已知:100kPa、298K时:
4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH=—1268kJ/mol
2N2(g)+6H2O(g) ΔH=—1268kJ/mol2NO(g)
 N2(g)+O2(g) ΔH=—180.5kJ/mol
N2(g)+O2(g) ΔH=—180.5kJ/mol请写出NH3转化为NO的热化学方程式
您最近一年使用:0次
2022-12-01更新
|
194次组卷
|
6卷引用:北京市房山区2022届高三第二次模拟测试化学试题
名校
解题方法
6 . 煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s) CaO(s)+CO2(g) △H1=+178.30kJ/mol
CaO(s)+CO2(g) △H1=+178.30kJ/mol
②CaO(s)+SO2(g)+0.5O2(g) CaSO4(s) △H2=-501.92kJ/mol
CaSO4(s) △H2=-501.92kJ/mol
③CO(g)+0.5O2(g) CO2(g) △H3
CO2(g) △H3
④CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol
CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol
(1)温度升高,反应①的化学平衡常数____ (填“增大”“减小”或“不变”)。
(2)△H3=____ kJ/mol。
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:____ 。
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去。
(4)将煤打成煤浆加入电解槽的目的是____ 。
(5)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:____ 。
FeS2+·OH=Fe3++SO +H2O+_____。
+H2O+_____。
(6)对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。

pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;____ 。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)
 CaO(s)+CO2(g) △H1=+178.30kJ/mol
CaO(s)+CO2(g) △H1=+178.30kJ/mol②CaO(s)+SO2(g)+0.5O2(g)
 CaSO4(s) △H2=-501.92kJ/mol
CaSO4(s) △H2=-501.92kJ/mol③CO(g)+0.5O2(g)
 CO2(g) △H3
CO2(g) △H3④CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol
CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol(1)温度升高,反应①的化学平衡常数
(2)△H3=
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去。
(4)将煤打成煤浆加入电解槽的目的是
(5)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:
FeS2+·OH=Fe3++SO
 +H2O+_____。
+H2O+_____。(6)对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。

pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;
您最近一年使用:0次
7 . 将天然气(主要成分为CH4)中的CO2、H2S资源化转化在能源利用、环境保护等方面意义重大。
(1)CO2转化为CO、H2S转化为S的反应如下:
i.2CO2(g)=2CO(g)+O2(g) △H1=+566kJ/mol
ii.2H2S(g)+O2(g)=2H2O(l)+2S(s) △H2=﹣530kJ/mol
iii.CO2、H2S转化生成CO、S等物质的热化学方程式是___________ 。
(2)CO2性质稳定,是一种“惰性”分子。对于反应ⅲ,通过设计合适的催化剂可以降低______ ,提高反应速率。
a.活化能 b.△H c.平衡常数
(3)我国科学家研制新型催化剂,设计协同转化装置实现反应ⅲ,工作原理如下所示。
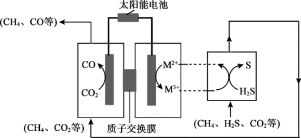
【方案1】若M3+/M2+=Fe3+/Fe2+
①所含Fe3+、Fe2+的溶液需为较强的酸性,原因是___________ 。
②结合反应式说明生成S、CO的原理:___________ 。
【方案2】若M3+/M2+=EDTA-Fe3+/EDTA-Fe2+(配合物)
已知:电解效率η的定义:
③测得η(EDTA-Fe3+)≈100%,η(CO)≈80%。阴极放电的物质有___________ 。
④为进一步确认CO2、H2S能协同转化,对CO的来源分析如下:
来源1:CO2通过电极反应产生CO
来源2:电解质(含碳元素)等物质发生降解,产生CO
设计实验探究,证实来源2不成立。实验方案是___________ 。
结论:方案2明显优于方案1,该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
(1)CO2转化为CO、H2S转化为S的反应如下:
i.2CO2(g)=2CO(g)+O2(g) △H1=+566kJ/mol
ii.2H2S(g)+O2(g)=2H2O(l)+2S(s) △H2=﹣530kJ/mol
iii.CO2、H2S转化生成CO、S等物质的热化学方程式是
(2)CO2性质稳定,是一种“惰性”分子。对于反应ⅲ,通过设计合适的催化剂可以降低
a.活化能 b.△H c.平衡常数
(3)我国科学家研制新型催化剂,设计协同转化装置实现反应ⅲ,工作原理如下所示。

【方案1】若M3+/M2+=Fe3+/Fe2+
①所含Fe3+、Fe2+的溶液需为较强的酸性,原因是
②结合反应式说明生成S、CO的原理:
【方案2】若M3+/M2+=EDTA-Fe3+/EDTA-Fe2+(配合物)
已知:电解效率η的定义:

③测得η(EDTA-Fe3+)≈100%,η(CO)≈80%。阴极放电的物质有
④为进一步确认CO2、H2S能协同转化,对CO的来源分析如下:
来源1:CO2通过电极反应产生CO
来源2:电解质(含碳元素)等物质发生降解,产生CO
设计实验探究,证实来源2不成立。实验方案是
结论:方案2明显优于方案1,该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
您最近一年使用:0次
2022-01-16更新
|
387次组卷
|
3卷引用:北京市朝阳区2021-2022学年高三上学期期末考试化学试题
名校
8 . 某天然气含CH4和一定量的CO2。以天然气为原料制备苯和氢气的工艺流程如下图所示:_______ 。
(2)由甲烷制备苯的过程中存在如下反应:
芳构化反应:6CH4(g) C6H6(g)+9H2(g) ΔH1
C6H6(g)+9H2(g) ΔH1
积碳反应:CH4(g) C(s)+2H2(g) ΔH2
C(s)+2H2(g) ΔH2
若要用ΔH1计算ΔH2,则还需要利用_______ 反应的ΔH。
(3)已知不同温度和压强下,甲烷芳构化反应中甲烷的平衡转化率如图所示:_______ 0(填“>”或“<”)
②P1、P2的大小关系是_______ ,理由是_______ 。
(4)在适宜温度下,以金属Mo作催化剂,由甲烷制备苯,几个小时后,单位时间内苯的产量迅速下降,主要原因是_______ 。

(2)由甲烷制备苯的过程中存在如下反应:
芳构化反应:6CH4(g)
 C6H6(g)+9H2(g) ΔH1
C6H6(g)+9H2(g) ΔH1积碳反应:CH4(g)
 C(s)+2H2(g) ΔH2
C(s)+2H2(g) ΔH2若要用ΔH1计算ΔH2,则还需要利用
(3)已知不同温度和压强下,甲烷芳构化反应中甲烷的平衡转化率如图所示:

②P1、P2的大小关系是
(4)在适宜温度下,以金属Mo作催化剂,由甲烷制备苯,几个小时后,单位时间内苯的产量迅速下降,主要原因是
您最近一年使用:0次
2022-01-14更新
|
369次组卷
|
5卷引用:北京市丰台区2021-2022学年高三上学期期末考试化学试题
北京市丰台区2021-2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题北京市第五十五中学2023-2024学年高二下学期期中调研化学试题山东省临沂市沂水县2022-2023学年高二上学期学科素养(期中)检测化学试题
9 . 化学链燃烧( )是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集
)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集 。基于
。基于 载氧体的甲烷化学链燃烧技术示意图如下。
载氧体的甲烷化学链燃烧技术示意图如下。
空气反应器与燃料反应器中发生的反应分别为:
①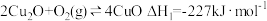
②
(1)反应

_______  。
。
(2)反应②的平衡常数表达式
_______ 。
(3)氧的质量分数:载氧体Ⅰ_______ (填“>”“=”或“<”)载氧体Ⅱ。
(4)往盛有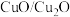 载氧体的刚性密闭容器中充入空气【氧气的物质的量分数
载氧体的刚性密闭容器中充入空气【氧气的物质的量分数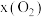 为21%】,发生反应①。平衡时
为21%】,发生反应①。平衡时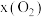 随反应温度T变化的曲线如图所示。
随反应温度T变化的曲线如图所示。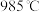 时
时 的平衡转化率
的平衡转化率
_______ (保留2位有效数字)。
(5)根据下图,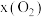 随温度升高而增大的原因是
随温度升高而增大的原因是_______ 。反应温度必须控制在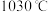 以下,原因是
以下,原因是_______ 。

(6)载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的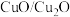 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。
由表中数据判断:使用_______ (填“氧化铝”或“膨润土”)掺杂的载氧体反应较快;使用氧化铝或者膨润土掺杂的载氧体,单位时间内燃料反应器释放的热量分别为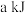 、
、 ,则a
,则a_______ b(填“>”“=”或“<”)。
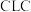 )是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集
)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集 。基于
。基于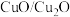 载氧体的甲烷化学链燃烧技术示意图如下。
载氧体的甲烷化学链燃烧技术示意图如下。
空气反应器与燃料反应器中发生的反应分别为:
①
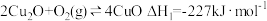
②

(1)反应


 。
。(2)反应②的平衡常数表达式

(3)氧的质量分数:载氧体Ⅰ
(4)往盛有
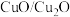 载氧体的刚性密闭容器中充入空气【氧气的物质的量分数
载氧体的刚性密闭容器中充入空气【氧气的物质的量分数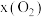 为21%】,发生反应①。平衡时
为21%】,发生反应①。平衡时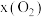 随反应温度T变化的曲线如图所示。
随反应温度T变化的曲线如图所示。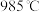 时
时 的平衡转化率
的平衡转化率
(5)根据下图,
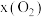 随温度升高而增大的原因是
随温度升高而增大的原因是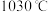 以下,原因是
以下,原因是
(6)载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的
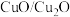 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。| 载氧体掺杂物质 | 氧化铝 | 膨润土 |
活化能/ |  | 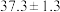 |
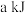 、
、 ,则a
,则a
您最近一年使用:0次
2021-11-09更新
|
5531次组卷
|
7卷引用:北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题
北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题2021年新高考福建化学高考真题(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编福建省龙岩第一中学2021-2022学年高二下学期开学考试(实验班)化学试题(已下线)专题17 原理综合题(已下线)专题17 原理综合题福建省福州市福建师范大学附属中学2022-2023学年高二下学期期末化学试题
名校
解题方法
10 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
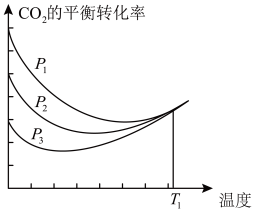
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
2021-04-04更新
|
1237次组卷
|
10卷引用:北京市丰台区2021届高三一模化学试题
北京市丰台区2021届高三一模化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)河北省武邑中学2021届高考七模化学试题黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期末考试化学试题山东省烟台市龙口市2023-2024学年高二上学期10月统考化学试题云南省保山市腾冲市第八中学2020-2021学年高二下学期期中考试化学试卷