将天然气(主要成分为CH4)中的CO2、H2S资源化转化在能源利用、环境保护等方面意义重大。
(1)CO2转化为CO、H2S转化为S的反应如下:
i.2CO2(g)=2CO(g)+O2(g) △H1=+566kJ/mol
ii.2H2S(g)+O2(g)=2H2O(l)+2S(s) △H2=﹣530kJ/mol
iii.CO2、H2S转化生成CO、S等物质的热化学方程式是___________ 。
(2)CO2性质稳定,是一种“惰性”分子。对于反应ⅲ,通过设计合适的催化剂可以降低______ ,提高反应速率。
a.活化能 b.△H c.平衡常数
(3)我国科学家研制新型催化剂,设计协同转化装置实现反应ⅲ,工作原理如下所示。
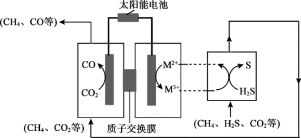
【方案1】若M3+/M2+=Fe3+/Fe2+
①所含Fe3+、Fe2+的溶液需为较强的酸性,原因是___________ 。
②结合反应式说明生成S、CO的原理:___________ 。
【方案2】若M3+/M2+=EDTA-Fe3+/EDTA-Fe2+(配合物)
已知:电解效率η的定义:
③测得η(EDTA-Fe3+)≈100%,η(CO)≈80%。阴极放电的物质有___________ 。
④为进一步确认CO2、H2S能协同转化,对CO的来源分析如下:
来源1:CO2通过电极反应产生CO
来源2:电解质(含碳元素)等物质发生降解,产生CO
设计实验探究,证实来源2不成立。实验方案是___________ 。
结论:方案2明显优于方案1,该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
(1)CO2转化为CO、H2S转化为S的反应如下:
i.2CO2(g)=2CO(g)+O2(g) △H1=+566kJ/mol
ii.2H2S(g)+O2(g)=2H2O(l)+2S(s) △H2=﹣530kJ/mol
iii.CO2、H2S转化生成CO、S等物质的热化学方程式是
(2)CO2性质稳定,是一种“惰性”分子。对于反应ⅲ,通过设计合适的催化剂可以降低
a.活化能 b.△H c.平衡常数
(3)我国科学家研制新型催化剂,设计协同转化装置实现反应ⅲ,工作原理如下所示。

【方案1】若M3+/M2+=Fe3+/Fe2+
①所含Fe3+、Fe2+的溶液需为较强的酸性,原因是
②结合反应式说明生成S、CO的原理:
【方案2】若M3+/M2+=EDTA-Fe3+/EDTA-Fe2+(配合物)
已知:电解效率η的定义:

③测得η(EDTA-Fe3+)≈100%,η(CO)≈80%。阴极放电的物质有
④为进一步确认CO2、H2S能协同转化,对CO的来源分析如下:
来源1:CO2通过电极反应产生CO
来源2:电解质(含碳元素)等物质发生降解,产生CO
设计实验探究,证实来源2不成立。实验方案是
结论:方案2明显优于方案1,该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
更新时间:2022-01-16 08:40:03
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】油气开采、石油化工、煤化工等行业的废气中普遍含有 ,需要对
,需要对 回收处理并加以利用。
回收处理并加以利用。
已知:①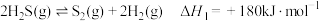
②
③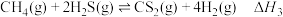
回答下列问题:
(1)反应③的
___________ 。
(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
(3)在不同温度、反应压强为 ,进料
,进料 的物质的量分数为
的物质的量分数为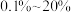 的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为
的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为___________ 。温度一定时,H2S的物质的量分数越大,H2S分解的平衡转化率越小,原因是___________ 。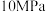 时,向恒压密闭容器中充入
时,向恒压密闭容器中充入 发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表
发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表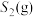 的是曲线
的是曲线___________ (填“I”“II”或“III”)。X点对应温度下,反应①的压强平衡常数
___________ 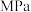 。
。
(5)反应①的速率方程为 ,
,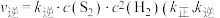 为速率常数)。
为速率常数)。
①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=___________ 。
②已知: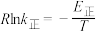 (式中,R为常数,
(式中,R为常数,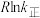 单位为
单位为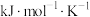 ,温度
,温度 单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度(
单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度( )关系如图3所示。相同条件下,催化效率较高的是
)关系如图3所示。相同条件下,催化效率较高的是___________ (填“Catl”或“Cat2”),判断依据是___________ 。在催化剂Cat2作用下,正反应的活化能为___________  。
。
 ,需要对
,需要对 回收处理并加以利用。
回收处理并加以利用。已知:①
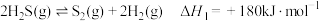
②

③
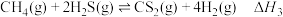
回答下列问题:
(1)反应③的

(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
A.断裂 键的同时断裂 键的同时断裂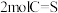 键 键 |
| B.恒容恒温条件下,反应体系的气体压强不再变化 |
| C.恒容条件下,反应体系的气体密度不再变化 |
D.反应速率: |
(3)在不同温度、反应压强为
 ,进料
,进料 的物质的量分数为
的物质的量分数为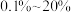 的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为
的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为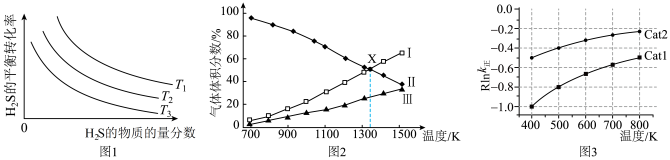
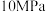 时,向恒压密闭容器中充入
时,向恒压密闭容器中充入 发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表
发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表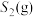 的是曲线
的是曲线
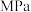 。
。(5)反应①的速率方程为
 ,
,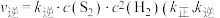 为速率常数)。
为速率常数)。①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=
②已知:
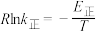 (式中,R为常数,
(式中,R为常数,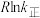 单位为
单位为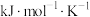 ,温度
,温度 单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度(
单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度( )关系如图3所示。相同条件下,催化效率较高的是
)关系如图3所示。相同条件下,催化效率较高的是 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】肼( )是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
)是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
(1)火箭发射可以用肼(液态)作燃料, 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。
已知: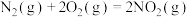
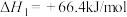
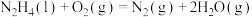
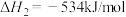
请写出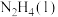 与
与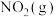 反应的热化学方程式
反应的热化学方程式______ 。
(2)向恒容密闭容器内加入一定量 ,一定条件下体系中存在以下平衡:
,一定条件下体系中存在以下平衡:
Ⅰ.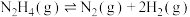
Ⅱ.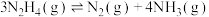
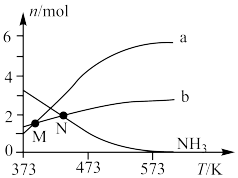
在较高温度肼几乎分解完全,分解产物的物质的量随温度变化如图:______ 。
②在较高温度肼几乎分解完全的原因可能是______ 。
③N点时,体系内 为
为______ 。
(3) 是二元弱碱,
是二元弱碱, 在水溶液中存在如下两步电离:
在水溶液中存在如下两步电离:
①
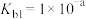 ;
;
②__________________________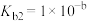 。
。
①写出 在水溶液中的第②步电离方程式:
在水溶液中的第②步电离方程式:______ 。
②25℃时,向 的水溶液中加入稀硫酸,欲使
的水溶液中加入稀硫酸,欲使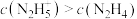 ,同时
,同时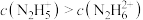 ,应控制溶液的
,应控制溶液的 范围为
范围为______ (用含a、b的式子表示)。
(4)利用 燃料电池电解
燃料电池电解 溶液并制备
溶液并制备 ,装置如图所示(
,装置如图所示( 均为石墨电极,假设各装置在工作过程中溶液体积不变)。
均为石墨电极,假设各装置在工作过程中溶液体积不变)。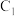 电极反应式为
电极反应式为______ 。
②若甲装置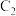 电极上消耗标准状况下1.12L的
电极上消耗标准状况下1.12L的 ,理论上丙装置阳极室溶液质量减少
,理论上丙装置阳极室溶液质量减少______ g。
 )是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
)是一种强还原性的高能物质,在航天、能源等领域有广泛应用。(1)火箭发射可以用肼(液态)作燃料,
 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。已知:
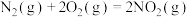
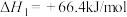
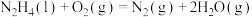
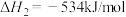
请写出
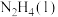 与
与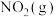 反应的热化学方程式
反应的热化学方程式(2)向恒容密闭容器内加入一定量
 ,一定条件下体系中存在以下平衡:
,一定条件下体系中存在以下平衡:Ⅰ.
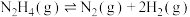
Ⅱ.
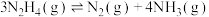
在较高温度肼几乎分解完全,分解产物的物质的量随温度变化如图:
②在较高温度肼几乎分解完全的原因可能是
③N点时,体系内
 为
为(3)
 是二元弱碱,
是二元弱碱, 在水溶液中存在如下两步电离:
在水溶液中存在如下两步电离:①

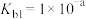 ;
;②__________________________
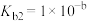 。
。①写出
 在水溶液中的第②步电离方程式:
在水溶液中的第②步电离方程式:②25℃时,向
 的水溶液中加入稀硫酸,欲使
的水溶液中加入稀硫酸,欲使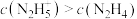 ,同时
,同时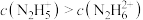 ,应控制溶液的
,应控制溶液的 范围为
范围为(4)利用
 燃料电池电解
燃料电池电解 溶液并制备
溶液并制备 ,装置如图所示(
,装置如图所示(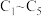 均为石墨电极,假设各装置在工作过程中溶液体积不变)。
均为石墨电极,假设各装置在工作过程中溶液体积不变)。
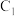 电极反应式为
电极反应式为②若甲装置
 电极上消耗标准状况下1.12L的
电极上消耗标准状况下1.12L的 ,理论上丙装置阳极室溶液质量减少
,理论上丙装置阳极室溶液质量减少
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
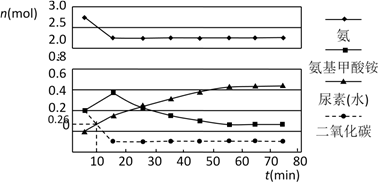
已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________ 步反应决定,总反应进行到_________ min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________ 。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
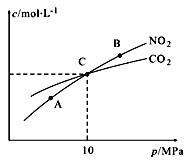
①A、B两点的浓度平衡常数关系:Kc(A)_______ Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)
②计算C点时该反应的压强平衡常数Kp(C)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
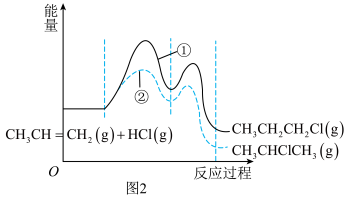
【推荐1】丙烯 是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。回答下列问题:
是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。回答下列问题:
(1)已知 经验公式为
经验公式为 (
( 为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应
为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应 在某条件下的
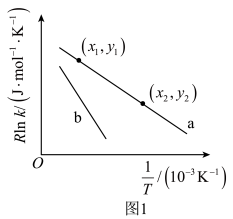
在某条件下的 经验公式的实验数据如图1中曲线a所示,其活化能为
经验公式的实验数据如图1中曲线a所示,其活化能为_______  (用含x1、x2、y1、y2的代数式表示),当其实验数据发生变化如图1中曲线b所示,则可能的原因是
(用含x1、x2、y1、y2的代数式表示),当其实验数据发生变化如图1中曲线b所示,则可能的原因是_______ 。
(2)一定条件下, 与
与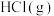 发生反应有①、②两种可能,反应进程中的能量变化如图2所示。保持其他条件不变,若要提高某时刻产物中
发生反应有①、②两种可能,反应进程中的能量变化如图2所示。保持其他条件不变,若要提高某时刻产物中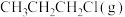 的比例,可采用的措施是_______(填标号)。
的比例,可采用的措施是_______(填标号)。
 是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。回答下列问题:
是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。回答下列问题:(1)已知
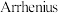 经验公式为
经验公式为 (
( 为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应
为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应 在某条件下的
在某条件下的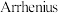 经验公式的实验数据如图1中曲线a所示,其活化能为
经验公式的实验数据如图1中曲线a所示,其活化能为 (用含x1、x2、y1、y2的代数式表示),当其实验数据发生变化如图1中曲线b所示,则可能的原因是
(用含x1、x2、y1、y2的代数式表示),当其实验数据发生变化如图1中曲线b所示,则可能的原因是
(2)一定条件下,
 与
与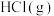 发生反应有①、②两种可能,反应进程中的能量变化如图2所示。保持其他条件不变,若要提高某时刻产物中
发生反应有①、②两种可能,反应进程中的能量变化如图2所示。保持其他条件不变,若要提高某时刻产物中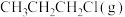 的比例,可采用的措施是_______(填标号)。
的比例,可采用的措施是_______(填标号)。
| A.适当提高反应温度 | B.改变催化剂 |
| C.适当降低反应温度 | D.改变反应物浓度 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】某小组探究Cu与 反应,发现有趣的现象。室温下,
反应,发现有趣的现象。室温下, 的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
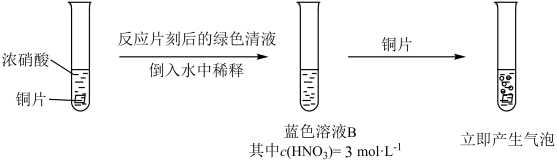
回答下列问题:
(1)探究溶液B遇铜片立即发生反应的原因。
①假设1:_____________ 对该反应有催化作用。
实验验证:向溶液A中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2: 对该反应有催化作用。
对该反应有催化作用。
方案Ⅰ:向盛有铜片的溶液A中通入少量 ,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴
,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴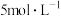 的硝酸,没有明显变化。补充该实验的目的是
的硝酸,没有明显变化。补充该实验的目的是_____________ 。
方案Ⅱ:向溶液B中通入氮气数分钟得溶液C。相同条件下,铜片与A、B、C三份溶液的反应速率: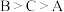 ,该实验能够证明假设2成立的理由是
,该实验能够证明假设2成立的理由是_________________ 。
③查阅资料: 溶于水可以生成
溶于水可以生成 和
和___________________ 。
向盛有铜片的溶液A中加入,铜片上立即产生气泡,实验证明 对该反应也有催化作用。
对该反应也有催化作用。
结论: 和
和 均对Cu与
均对Cu与 的反应有催化作用。
的反应有催化作用。
(2)试从结构角度解释 在金属表面得电子的能力强于
在金属表面得电子的能力强于 的原因
的原因________________ 。
(3)Cu与稀硝酸反应中 参与的可能催化过程如下。将ii补充完整。
参与的可能催化过程如下。将ii补充完整。
i.
ii.______________________
iii.
(4)探究 的性质。
的性质。
将一定质量的 放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至
放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至 时,剩余固体质量变为原来的
时,剩余固体质量变为原来的 ,则剩余固体的化学式可能为
,则剩余固体的化学式可能为______________ 。
 反应,发现有趣的现象。室温下,
反应,发现有趣的现象。室温下, 的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
回答下列问题:
(1)探究溶液B遇铜片立即发生反应的原因。
①假设1:
实验验证:向溶液A中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2:
 对该反应有催化作用。
对该反应有催化作用。方案Ⅰ:向盛有铜片的溶液A中通入少量
 ,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴
,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴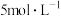 的硝酸,没有明显变化。补充该实验的目的是
的硝酸,没有明显变化。补充该实验的目的是方案Ⅱ:向溶液B中通入氮气数分钟得溶液C。相同条件下,铜片与A、B、C三份溶液的反应速率:
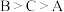 ,该实验能够证明假设2成立的理由是
,该实验能够证明假设2成立的理由是③查阅资料:
 溶于水可以生成
溶于水可以生成 和
和向盛有铜片的溶液A中加入,铜片上立即产生气泡,实验证明
 对该反应也有催化作用。
对该反应也有催化作用。结论:
 和
和 均对Cu与
均对Cu与 的反应有催化作用。
的反应有催化作用。(2)试从结构角度解释
 在金属表面得电子的能力强于
在金属表面得电子的能力强于 的原因
的原因(3)Cu与稀硝酸反应中
 参与的可能催化过程如下。将ii补充完整。
参与的可能催化过程如下。将ii补充完整。i.

ii.
iii.

(4)探究
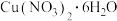 的性质。
的性质。将一定质量的
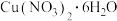 放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至
放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至 时,剩余固体质量变为原来的
时,剩余固体质量变为原来的 ,则剩余固体的化学式可能为
,则剩余固体的化学式可能为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】 在生产、环保等方面有广泛应用,但其也是一种致癌物。回答下列问题:
在生产、环保等方面有广泛应用,但其也是一种致癌物。回答下列问题:
(1) 中V的化合价为
中V的化合价为_____ 。
(2) 和Al在高温下反应生成V和
和Al在高温下反应生成V和 ,反应的化学方程式为
,反应的化学方程式为_____ 。
(3)接触法制备硫酸工业中, 常作
常作 催化氧化反应的催化剂,如图所示。
催化氧化反应的催化剂,如图所示。

①总反应分两步进行:
第I步: ;
;
第Ⅱ步:_____ (补充化学方程式)。
②速控反应是_____ (填“I”或“Ⅱ”)。
③下列有关 作用的叙述错误的是
作用的叙述错误的是_____ (填标号)。
A.改变反应历程,降低 的值
的值
B.能提高反应物的活化分子百分率
C.能提高反应速率和 的平衡转化率
的平衡转化率
(4)已知 与烧碱的反应为
与烧碱的反应为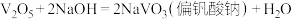 ,
, 不能与酸反应生成盐和水。由此可知
不能与酸反应生成盐和水。由此可知 是
是_____ (填标号)。
A酸性氧化物 B.碱性氧化物 C.两性氧化物
(5)一定条件下 能生成多钒酸铵,如
能生成多钒酸铵,如 (六钒酸铵)、
(六钒酸铵)、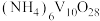 (十钒酸铵)、
(十钒酸铵)、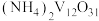 (十二钒酸铵)等。工业上以多钒酸铵为原料,用CO或
(十二钒酸铵)等。工业上以多钒酸铵为原料,用CO或 还原可以制得
还原可以制得 。
。
① 生成
生成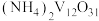 的反应属于
的反应属于_____ (填“氧化还原反应”或“非氧化还原反应”)。
②用CO还原 的化学方程式为
的化学方程式为_____ 。
③用 还原
还原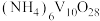 ,氧化产物与还原产物的物质的量之比为
,氧化产物与还原产物的物质的量之比为_____ 。
 在生产、环保等方面有广泛应用,但其也是一种致癌物。回答下列问题:
在生产、环保等方面有广泛应用,但其也是一种致癌物。回答下列问题:(1)
 中V的化合价为
中V的化合价为(2)
 和Al在高温下反应生成V和
和Al在高温下反应生成V和 ,反应的化学方程式为
,反应的化学方程式为(3)接触法制备硫酸工业中,
 常作
常作 催化氧化反应的催化剂,如图所示。
催化氧化反应的催化剂,如图所示。
①总反应分两步进行:
第I步:
 ;
;第Ⅱ步:
②速控反应是
③下列有关
 作用的叙述错误的是
作用的叙述错误的是A.改变反应历程,降低
 的值
的值B.能提高反应物的活化分子百分率
C.能提高反应速率和
 的平衡转化率
的平衡转化率(4)已知
 与烧碱的反应为
与烧碱的反应为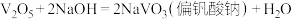 ,
, 不能与酸反应生成盐和水。由此可知
不能与酸反应生成盐和水。由此可知 是
是A酸性氧化物 B.碱性氧化物 C.两性氧化物
(5)一定条件下
 能生成多钒酸铵,如
能生成多钒酸铵,如 (六钒酸铵)、
(六钒酸铵)、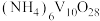 (十钒酸铵)、
(十钒酸铵)、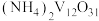 (十二钒酸铵)等。工业上以多钒酸铵为原料,用CO或
(十二钒酸铵)等。工业上以多钒酸铵为原料,用CO或 还原可以制得
还原可以制得 。
。①
 生成
生成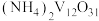 的反应属于
的反应属于②用CO还原
 的化学方程式为
的化学方程式为③用
 还原
还原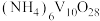 ,氧化产物与还原产物的物质的量之比为
,氧化产物与还原产物的物质的量之比为
您最近一年使用:0次
【推荐1】锑白( )可用作白色颜料和阻燃剂,在消防、有机合成催化、玻璃工业等领域有广泛应用。利用锑矿粉(主要成分为
)可用作白色颜料和阻燃剂,在消防、有机合成催化、玻璃工业等领域有广泛应用。利用锑矿粉(主要成分为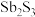 、
、 )制取锑白的流程如下:
)制取锑白的流程如下:
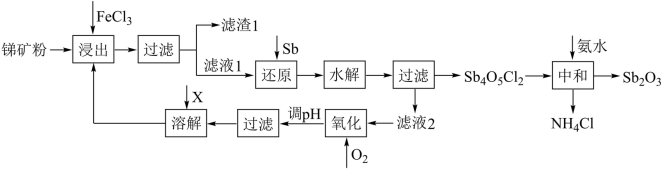
(1)“滤渣1”的主要成分有S、______ ,“滤液1”的主要成分有Sb3+,“浸出”时主要反应的离子方程式为_______ 。
(2)“水解”前需确保“还原”进行完全,可选择的检验试剂是_______ 。
(3)“水解”时需先将还原液稀释,其目的是_______ 。
(4)物质X的化学式是_______ ﹔“滤液2”电解后的产物可直接返回“浸出”工序,则电解时,阳极的电极反应式为_______ 。
(5)“中和”时温度不宜过高,原因是_______ ;“中和”反应的化学方程式为_______ 。
 )可用作白色颜料和阻燃剂,在消防、有机合成催化、玻璃工业等领域有广泛应用。利用锑矿粉(主要成分为
)可用作白色颜料和阻燃剂,在消防、有机合成催化、玻璃工业等领域有广泛应用。利用锑矿粉(主要成分为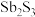 、
、 )制取锑白的流程如下:
)制取锑白的流程如下:
(1)“滤渣1”的主要成分有S、
(2)“水解”前需确保“还原”进行完全,可选择的检验试剂是
(3)“水解”时需先将还原液稀释,其目的是
(4)物质X的化学式是
(5)“中和”时温度不宜过高,原因是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】SO2是一种大气污染物。某工厂废气中含有大量的SO2,可用如图所示装置(均为惰性电极)吸收,同时可获得俗称“工业盐”的NaNO2。
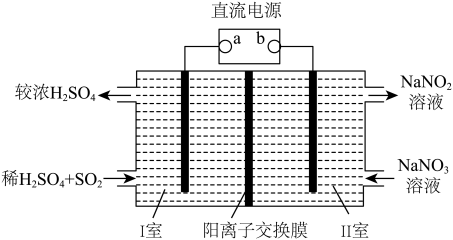
回答下列问题:
(1)a极为直流电源的_____ (填“正”或“负”)极,电解时阳极的电极反应式为_____ 。
(2)该装置工作一段时间后,II室中出口溶液相对于入口溶液的pH将_____ (填“增大”“减小”或“不变”),原因是______ (用离子方程式表示)。
(3)取一定体积的II室出口溶液,其中含有amolNaNO2,加入bLcmol•L-1的NaNO2溶液后,混合溶液呈中性(温度始终保持25℃),则加入NaNO2溶液过程中水的电离平衡_____ (填“正向”或“逆向”)移动,25℃时,Ka(NaNO2)=_____ (用含a、b、c的代数式表示)。

回答下列问题:
(1)a极为直流电源的
(2)该装置工作一段时间后,II室中出口溶液相对于入口溶液的pH将
(3)取一定体积的II室出口溶液,其中含有amolNaNO2,加入bLcmol•L-1的NaNO2溶液后,混合溶液呈中性(温度始终保持25℃),则加入NaNO2溶液过程中水的电离平衡
您最近一年使用:0次
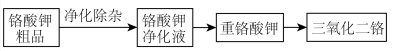
【推荐3】三氧化二铬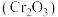 是重要的有机反应催化剂,一种利用铬酸钾
是重要的有机反应催化剂,一种利用铬酸钾 粗品制备
粗品制备 的流程示意图如下。
的流程示意图如下。
已知:Ⅰ. 粗品中含有
粗品中含有 、
、 等杂质
等杂质
Ⅱ.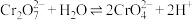

Ⅲ. 易溶于水,
易溶于水,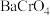 难溶于水
难溶于水
(1)净化除杂
向 粗品中加入
粗品中加入 溶液,生成
溶液,生成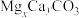 沉淀以除去
沉淀以除去 、
、 。反应的离子方程式是
。反应的离子方程式是_______ 。
(2)制备
①向 净化液中通入过量的
净化液中通入过量的 可制得
可制得 。反应的化学方程式是
。反应的化学方程式是_______ 。
②电解 净化液也可制得
净化液也可制得 ,装置示意图如图。
,装置示意图如图。

ⅰ.阴极室中获得的产品有 和
和_______ 。
ⅱ.结合化学用语说明制备 的原理:
的原理:_______ 。
ⅲ.取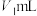 某
某 溶液稀释至
溶液稀释至 ,移取
,移取 稀释液于锥形瓶中,加入过量的
稀释液于锥形瓶中,加入过量的 溶液,滴加2~3滴酚酞溶液,用
溶液,滴加2~3滴酚酞溶液,用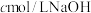 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。则
。则 溶液的物质的量浓度为
溶液的物质的量浓度为_______ 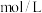 。
。
(3)制备
在热压反应釜中,将蔗糖 与
与 的混合溶液加热至120℃,可获得
的混合溶液加热至120℃,可获得 ,同时生成
,同时生成 、
、 。若生成
。若生成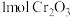 ,理论上消耗蔗糖的物质的量至少是
,理论上消耗蔗糖的物质的量至少是_______ mol。
(4)应用
 催化丙烷脱氢生成丙炔,过程中会发生副反应形成积炭。
催化丙烷脱氢生成丙炔,过程中会发生副反应形成积炭。
①该脱氢反应的两种可能的反应过程a、b如图所示。
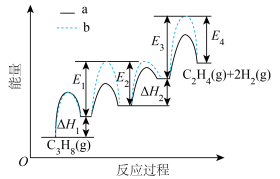
ⅰ.相同条件下,反应速率更快的是_______ (填“a”或“b”)。
ⅱ.该脱氢反应的焓变的计算式为_______ 。
②温度升高到一定程度时,相同时间内,丙炔的产量降低,原因是_______ (答1个)。
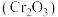 是重要的有机反应催化剂,一种利用铬酸钾
是重要的有机反应催化剂,一种利用铬酸钾 粗品制备
粗品制备 的流程示意图如下。
的流程示意图如下。
已知:Ⅰ.
 粗品中含有
粗品中含有 、
、 等杂质
等杂质Ⅱ.
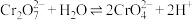

Ⅲ.
 易溶于水,
易溶于水,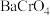 难溶于水
难溶于水(1)净化除杂
向
 粗品中加入
粗品中加入 溶液,生成
溶液,生成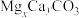 沉淀以除去
沉淀以除去 、
、 。反应的离子方程式是
。反应的离子方程式是(2)制备

①向
 净化液中通入过量的
净化液中通入过量的 可制得
可制得 。反应的化学方程式是
。反应的化学方程式是②电解
 净化液也可制得
净化液也可制得 ,装置示意图如图。
,装置示意图如图。
ⅰ.阴极室中获得的产品有
 和
和ⅱ.结合化学用语说明制备
 的原理:
的原理:ⅲ.取
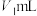 某
某 溶液稀释至
溶液稀释至 ,移取
,移取 稀释液于锥形瓶中,加入过量的
稀释液于锥形瓶中,加入过量的 溶液,滴加2~3滴酚酞溶液,用
溶液,滴加2~3滴酚酞溶液,用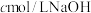 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。则
。则 溶液的物质的量浓度为
溶液的物质的量浓度为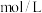 。
。(3)制备

在热压反应釜中,将蔗糖
 与
与 的混合溶液加热至120℃,可获得
的混合溶液加热至120℃,可获得 ,同时生成
,同时生成 、
、 。若生成
。若生成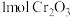 ,理论上消耗蔗糖的物质的量至少是
,理论上消耗蔗糖的物质的量至少是(4)应用

 催化丙烷脱氢生成丙炔,过程中会发生副反应形成积炭。
催化丙烷脱氢生成丙炔,过程中会发生副反应形成积炭。①该脱氢反应的两种可能的反应过程a、b如图所示。

ⅰ.相同条件下,反应速率更快的是
ⅱ.该脱氢反应的焓变的计算式为
②温度升高到一定程度时,相同时间内,丙炔的产量降低,原因是
您最近一年使用:0次
【推荐1】I.习总书记曾提出“绿水青山就是金山银山”的科学论断,研究二氧化碳的资源化利用具有重要的意义。请回答下列问题:
(1)已知下列热化学方程式:
①
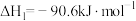
②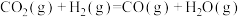
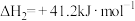
则CO2与H2反应生成甲醇气体和水蒸气的热化学方程式为:_______ 。
(2)一定温度和压强为1MPa条件下,将 和
和 按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:
按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:
a. ;
;
b. ;
;
10min两个反应均达到平衡时,CO2平衡转化率为60%,CH4选择性为50%,[CH4的选择性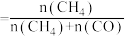 ]。该温度下,反应b的Kp=
]。该温度下,反应b的Kp=_______ (保留两位有效数字),已知Kp是用反应体系中气体物质的分压来表示的平衡常数,气体分压=总压×气体物质的量分数),用CH4的分压变化表示反应a在10分钟内达到平衡的平均速率为_______  (保留两位有效数字)。
(保留两位有效数字)。
II.燃煤排放的烟气含有和NOx,形成酸雨、污染大气。采用化学吸收剂对烟气进行脱硫、脱硝,对环境保护有着重要的意义。回答下列问题:
(3)在不同温度下, 溶液脱硫、脱硝的反应中,
溶液脱硫、脱硝的反应中, 和NO的平衡分压
和NO的平衡分压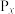 如图所示。
如图所示。
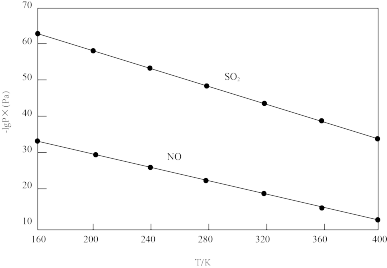
由图分析可知。反应温度升高,脱硫、脱硝反应的平衡常数均_______ (填“增大”“不变”或“减小”)。原因可能是_______ (写出一条原因即可)。
(4)以连二亚硫酸根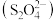 为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
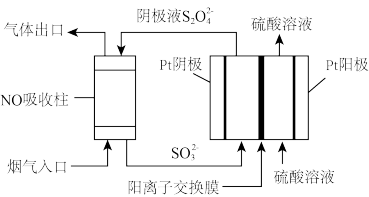
①阴极区的电极反应式为_______ 。
②NO吸收转化后的主要产物为N2,若通电时电路中转移了0.5mole—,则此通电过程中理论上吸收的NO在标准状况下的体积为_______ L。
(1)已知下列热化学方程式:
①

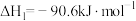
②
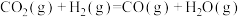
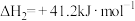
则CO2与H2反应生成甲醇气体和水蒸气的热化学方程式为:
(2)一定温度和压强为1MPa条件下,将
 和
和 按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:
按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:a.
 ;
;b.
 ;
;10min两个反应均达到平衡时,CO2平衡转化率为60%,CH4选择性为50%,[CH4的选择性
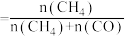 ]。该温度下,反应b的Kp=
]。该温度下,反应b的Kp= (保留两位有效数字)。
(保留两位有效数字)。II.燃煤排放的烟气含有和NOx,形成酸雨、污染大气。采用化学吸收剂对烟气进行脱硫、脱硝,对环境保护有着重要的意义。回答下列问题:
(3)在不同温度下,
 溶液脱硫、脱硝的反应中,
溶液脱硫、脱硝的反应中, 和NO的平衡分压
和NO的平衡分压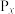 如图所示。
如图所示。
由图分析可知。反应温度升高,脱硫、脱硝反应的平衡常数均
(4)以连二亚硫酸根
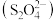 为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
①阴极区的电极反应式为
②NO吸收转化后的主要产物为N2,若通电时电路中转移了0.5mole—,则此通电过程中理论上吸收的NO在标准状况下的体积为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】苯甲醇和苯甲酸均是重要的化工原料,有着广泛的用途。可用Cannizzaro反应来制备,涉及的反应如下:
b.实验步骤:
①250mL仪器A中加入10.0g氢氧化钠和10mL水。溶解并冷却至室温后,加入苯甲醛10.6g,搅拌,数分钟后原料凝结成固体,呈现微黄色,后逐渐变为淡粉色,于避光处放置一段时间。
②取适量水溶解,转移至分液漏斗,乙醚萃取3次,每次25mL。初次醚层呈红褐色,水层微浑浊,萃取若干次后基本澄清。合并醚层,倒入分液漏斗中,先用10mL饱和亚硫酸氢钠洗涤;再用20mL碳酸氢钠洗涤,放出少量气泡;最后用10mL水洗。醚层盛放在干燥的具塞瓶中,加入适量无水硫酸钠过滤。
③醚层滤液转至蒸馏瓶中,先常压蒸馏、旋转蒸发蒸去大部分乙醚,最后经过操作收集到无色透明馏分(苯甲醇)3.68g。
④水层边搅拌边加入浓盐酸,至刚好变蓝,析出大量白色粉末状固体。冷却至室温,抽滤,压干,得苯甲酸粗品。再经过操作B,得精制的苯甲酸片状白色晶体4.38g。
(1)仪器A的名称是___________ ;
(2)写出该过程可能发生副反应的化学方程式:___________ ;
(3)步骤②中,无水硫酸钠的作用___________ ;
(4)步骤④中,操作B的名称是___________ ;
(5)计算苯甲酸的产率:___________ (保留3位有效数字)。
Ⅱ.电化学方法合成
近期,清华大学段吴泓副教授课题组首次利用此反应机理,利用糠醛创制了一种新型可充放电的“生物质电池”,该电池在充电过程中,可生产高附加值糠醇,而放电过程中则生产糠酸,其原理可用下图表示:___________ ;
(7)对比以上两种合成方法,指出电化学有机合成的优点:___________ 。
2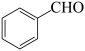 +NaOH
+NaOH
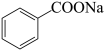
 +
+
 +HCl
+HCl
 +NaCl
+NaCl

| 物质名称 | 相对分子质量 | 密度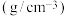 | 沸点(℃) | 溶解性 | |
| 水 | 醚 | ||||
| 苯甲醛 | 106 | 1.04 | 179.6 | 微溶 | 易溶 |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶 | 易溶 |
| 苯甲醇 | 108 | 1.04 | 205.7 | 微溶 | 易溶 |
| 乙醚 | 74 | 0.71 | 34.6 | 难溶 | —— |
①250mL仪器A中加入10.0g氢氧化钠和10mL水。溶解并冷却至室温后,加入苯甲醛10.6g,搅拌,数分钟后原料凝结成固体,呈现微黄色,后逐渐变为淡粉色,于避光处放置一段时间。
②取适量水溶解,转移至分液漏斗,乙醚萃取3次,每次25mL。初次醚层呈红褐色,水层微浑浊,萃取若干次后基本澄清。合并醚层,倒入分液漏斗中,先用10mL饱和亚硫酸氢钠洗涤;再用20mL碳酸氢钠洗涤,放出少量气泡;最后用10mL水洗。醚层盛放在干燥的具塞瓶中,加入适量无水硫酸钠过滤。
③醚层滤液转至蒸馏瓶中,先常压蒸馏、旋转蒸发蒸去大部分乙醚,最后经过操作收集到无色透明馏分(苯甲醇)3.68g。
④水层边搅拌边加入浓盐酸,至刚好变蓝,析出大量白色粉末状固体。冷却至室温,抽滤,压干,得苯甲酸粗品。再经过操作B,得精制的苯甲酸片状白色晶体4.38g。
(1)仪器A的名称是
(2)写出该过程可能发生副反应的化学方程式:
(3)步骤②中,无水硫酸钠的作用
(4)步骤④中,操作B的名称是
(5)计算苯甲酸的产率:
Ⅱ.电化学方法合成
近期,清华大学段吴泓副教授课题组首次利用此反应机理,利用糠醛创制了一种新型可充放电的“生物质电池”,该电池在充电过程中,可生产高附加值糠醇,而放电过程中则生产糠酸,其原理可用下图表示:

(7)对比以上两种合成方法,指出电化学有机合成的优点:
您最近一年使用:0次
【推荐3】氮的化合物既是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3催化还原法:原理如图所示
①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为___________ 。
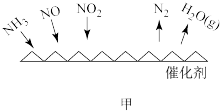
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_________ ;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是__________ 。
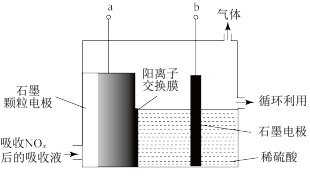
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为__________ 。
(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
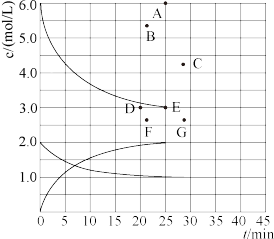
①下列能说明反应达到平衡状态的是____ (选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为___ (选填字母)。
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)⇌N2O4(g) ∆H=-56.9kJ‧mol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
①计算0~20min时,v(N2O4)=____________ 。
②已知该反应v正(NO2)=k1‧c2(NO2),v逆(N2O4)=k2‧c(N2O4),其中k1、k2为速率常数,则373K时,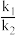 =
=_________ ;改变温度至T1时,k1=k2,则T1_______ 373K(填“>”“<”或“=”)。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3催化还原法:原理如图所示


①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为

(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。

①下列能说明反应达到平衡状态的是
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)⇌N2O4(g) ∆H=-56.9kJ‧mol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=
②已知该反应v正(NO2)=k1‧c2(NO2),v逆(N2O4)=k2‧c(N2O4),其中k1、k2为速率常数,则373K时,
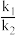 =
=
您最近一年使用:0次



