Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
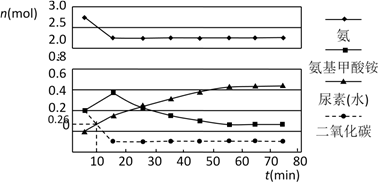
已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________ 步反应决定,总反应进行到_________ min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________ 。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
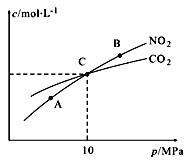
①A、B两点的浓度平衡常数关系:Kc(A)_______ Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)
②计算C点时该反应的压强平衡常数Kp(C)=
16-17高二下·福建泉州·期中 查看更多[2]
更新时间:2017-12-23 11:02:30
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】丁二烯、异丁烯均是重要的有机化工原料,广泛用于有机合成和精细化工。
I.正丁烷催化氧化制1.3-丁二烯的一种反应途径如图所示。
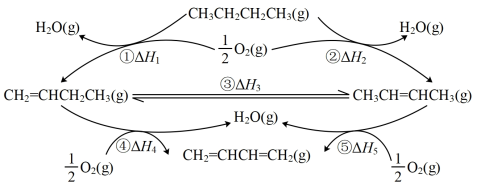
(1)已知: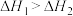 ,则
,则
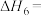
______ ,相同条件下,稳定性:1-丁烯______ (填“>”、“<”或“=”)2-丁烯。
(2)在某恒温恒容密闭容器中通入等物质的量的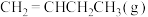 和
和 ,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。
,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。
II.正丁烷脱氢异构制异丁烯。
温度为T℃,向体积不等的恒容密闭容器中均充入1 mol正丁烷,发生反应:

 ,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。
,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。
(3)A点时
______ (填“>”、“=”或“<”,同) ;正反应速率:
;正反应速率:
______ 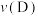 。
。
(4)若C点为平衡点且容器总压强为0.4 MPa,则该条件下,反应的平衡常数
______ MPa(以分压表示的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
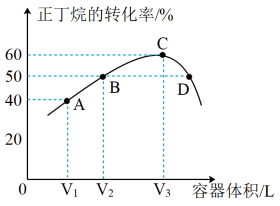
(5)向A点对应的反应体系中再充入一定量的正丁烷,达到平衡时,正丁烷的转化率______ (填“增大”、“减小”或“不变”)。
(6)
______ 。
I.正丁烷催化氧化制1.3-丁二烯的一种反应途径如图所示。

(1)已知:
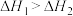 ,则
,则
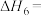
(2)在某恒温恒容密闭容器中通入等物质的量的
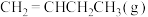 和
和 ,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。
,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。| A.混合气体的密度不再改变 |
| B.混合气体平均摩尔质量不再改变 |
C.丁二烯和 的物质的量之比不再改变 的物质的量之比不再改变 |
D.1-丁烯和 的物质的量之比不再改变 的物质的量之比不再改变 |
II.正丁烷脱氢异构制异丁烯。
温度为T℃,向体积不等的恒容密闭容器中均充入1 mol正丁烷,发生反应:

 ,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。
,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。(3)A点时

 ;正反应速率:
;正反应速率:
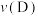 。
。(4)若C点为平衡点且容器总压强为0.4 MPa,则该条件下,反应的平衡常数

 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
(5)向A点对应的反应体系中再充入一定量的正丁烷,达到平衡时,正丁烷的转化率
(6)

您最近一年使用:0次
【推荐2】近两年来,碳中和连续成为两会期间最受关注的议题之一, 的回收和利用对于改善环境,实现绿色发展至关重要。
的回收和利用对于改善环境,实现绿色发展至关重要。
(1) 甲烷化反应最早由化学家PaulSabatier提出。已知:
甲烷化反应最早由化学家PaulSabatier提出。已知:
反应Ⅰ.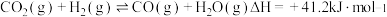
反应Ⅱ.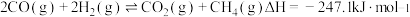
① 的结构式为
的结构式为_______ 。
② 甲烷化反应是
甲烷化反应是_______ (填“吸热”或“放热”)反应。
③反应Ⅰ的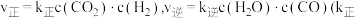 和
和 为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
_______ (填“增大”、“不变”或“减小”)。
(2)一定条件下, 与
与 反应可合成乙烯:
反应可合成乙烯: 。该反应分两步进行:
。该反应分两步进行:
ⅰ.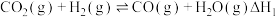
ⅱ.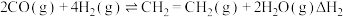
 ,压强恒定为
,压强恒定为 时,将
时,将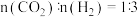 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。
 的平衡转化率为
的平衡转化率为_______ ,反应ⅰ的平衡常数
_______ ( 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3)一种以 和甲醇为原料,利用
和甲醇为原料,利用 和
和 纳米片
纳米片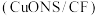 作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。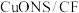 为
为_______ 极,电解过程中阴极的电极反应式为_______ 。
②设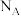 为阿伏加德罗常数的值,当电路中转移
为阿伏加德罗常数的值,当电路中转移 电子时,装置中生成
电子时,装置中生成 和
和 的数目共为
的数目共为_______ 。
 的回收和利用对于改善环境,实现绿色发展至关重要。
的回收和利用对于改善环境,实现绿色发展至关重要。(1)
 甲烷化反应最早由化学家PaulSabatier提出。已知:
甲烷化反应最早由化学家PaulSabatier提出。已知:反应Ⅰ.
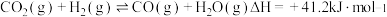
反应Ⅱ.
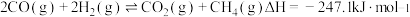
①
 的结构式为
的结构式为②
 甲烷化反应是
甲烷化反应是③反应Ⅰ的
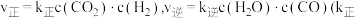 和
和 为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
(2)一定条件下,
 与
与 反应可合成乙烯:
反应可合成乙烯: 。该反应分两步进行:
。该反应分两步进行:ⅰ.
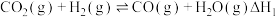
ⅱ.
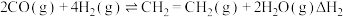
 ,压强恒定为
,压强恒定为 时,将
时,将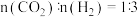 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示。| 组分 |  |  |  |
物质的量分数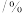 | 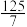 | 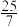 | 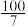 |
 的平衡转化率为
的平衡转化率为
 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。(3)一种以
 和甲醇为原料,利用
和甲醇为原料,利用 和
和 纳米片
纳米片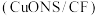 作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。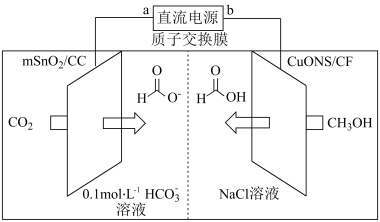
 为
为②设
 为阿伏加德罗常数的值,当电路中转移
为阿伏加德罗常数的值,当电路中转移 电子时,装置中生成
电子时,装置中生成 和
和 的数目共为
的数目共为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】氨气是一种重要的化工产品,有广泛用途,工业上可以由氢气和氮气合成。
(1)已知键能:N N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
①氮气、氢气合成氨的热化学方程式是______________ 。
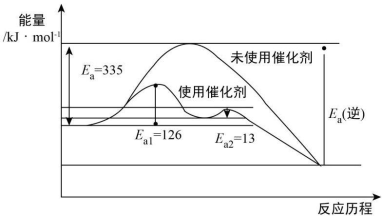
②未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后正反应的总活化能为_______ kJ·mol-1。
(2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。

①曲线a、b对应温度较高的是________ (填“a”或“b”)
②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)___ mol·L-1·min-1。
③关于工业合成氨的反应,下列叙述正确的是_______ (填字母)。
A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率
B.使州催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R)
④列出R点平衡常数的计算式Kp=____ (MPa)-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。不要求计算结果)
(1)已知键能:N
 N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。①氮气、氢气合成氨的热化学方程式是

②未使用催化剂时,逆反应的活化能Ea(逆)=
(2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。

①曲线a、b对应温度较高的是
②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)
③关于工业合成氨的反应,下列叙述正确的是
A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率
B.使州催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R)
④列出R点平衡常数的计算式Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。回答下列问题:
(1)CO2与H2合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
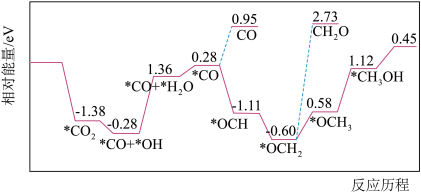
容易得到的副产物有CO和CH2O,其中相对较多的副产物为__ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中__ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(2)恒压(容器的容积可变)下,0.2molCO2与0.6molH2在催化剂作用下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
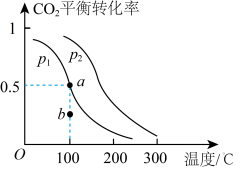
压强p1__ (填“<”或“>”)p2。
②在p1、100℃条件下,b点时v正__ (填“<"或“>”)v逆。
③已知:反应速率v=v正-v逆=k正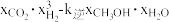 ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的 =
=__ (保留3位有效数字)。
(3)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应(Ⅰ)、(Ⅱ)的lgKP(KP为以分压表示的平衡常数)与T的关系如图所示。
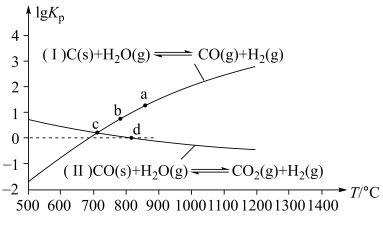
反应(Ⅱ)的△H__ (填“大于”“等于”或“小于”)0。
②c点时,反应C(s)+CO2(g) 2CO(g)的KP=
2CO(g)的KP=__ (填数值)。
③在恒容密闭容器中充入0.5molCO、2molH2O(g)只发生反应(Ⅱ),图中d点处达到平衡时,CO的转化率为__ ;达到平衡时,向容器中再充入0.5molCO、2molH2O(g),重新达到平衡时,CO的平衡转化率__ (填“增大”“减小”或“不变”)。
(1)CO2与H2合成甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
容易得到的副产物有CO和CH2O,其中相对较多的副产物为
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(2)恒压(容器的容积可变)下,0.2molCO2与0.6molH2在催化剂作用下发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
压强p1
②在p1、100℃条件下,b点时v正
③已知:反应速率v=v正-v逆=k正
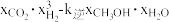 ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的 =
=(3)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应(Ⅰ)、(Ⅱ)的lgKP(KP为以分压表示的平衡常数)与T的关系如图所示。

反应(Ⅱ)的△H
②c点时,反应C(s)+CO2(g)
 2CO(g)的KP=
2CO(g)的KP=③在恒容密闭容器中充入0.5molCO、2molH2O(g)只发生反应(Ⅱ),图中d点处达到平衡时,CO的转化率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】“双碳”目标大背景下,采取高效经济方式利用 对人类社会发展具有重要意义。二氧化碳加氢合成甲醇是重要途径。以
对人类社会发展具有重要意义。二氧化碳加氢合成甲醇是重要途径。以 和
和 为原料合成甲醇主要发生反应I和反应II(不考虑其他反应):
为原料合成甲醇主要发生反应I和反应II(不考虑其他反应):
I.

II.
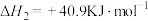
回答以下问题:
(1)已知:
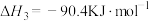 ,则反应I的
,则反应I的
_______ 。
(2)有利于提高 平衡转化率的措施有_______(填标号)。
平衡转化率的措施有_______(填标号)。
(3)实验测得 平衡转化率(曲线
平衡转化率(曲线 )和平衡时
)和平衡时 的选择性(曲线
的选择性(曲线 )随温度变化如图所示。(已知:
)随温度变化如图所示。(已知: 的选择性
的选择性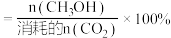 )
)
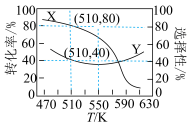
① 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为_______ 。
②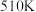 时,往恒容密闭容器中按
时,往恒容密闭容器中按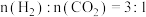 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内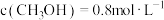 ,则反应
,则反应 的平衡常数
的平衡常数
_______ (列计算式)。
(4) 和
和 在某催化剂表面合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
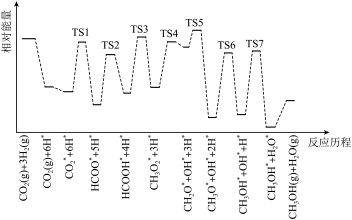
①气体在催化剂表面的吸附是_______ (填“吸热”或“放热”)过程。
②该反应历程中反应速率最快步骤的化学方程式为_______ 。
(5)甲醇脱水可制得二甲醚: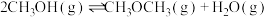
 。实验测得:
。实验测得: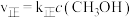 ,
,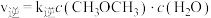 ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入
温度下,向2L恒容密闭容器中加入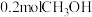 ,起始压强为
,起始压强为 ,
, 时该反应达到平衡。此时测得
时该反应达到平衡。此时测得 的体积分数为
的体积分数为 ,则平衡时
,则平衡时 的转化率
的转化率
_______ :当温度改变为 时,
时,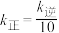 ,则
,则
_______  (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
 对人类社会发展具有重要意义。二氧化碳加氢合成甲醇是重要途径。以
对人类社会发展具有重要意义。二氧化碳加氢合成甲醇是重要途径。以 和
和 为原料合成甲醇主要发生反应I和反应II(不考虑其他反应):
为原料合成甲醇主要发生反应I和反应II(不考虑其他反应):I.


II.

回答以下问题:
(1)已知:

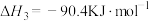 ,则反应I的
,则反应I的
(2)有利于提高
 平衡转化率的措施有_______(填标号)。
平衡转化率的措施有_______(填标号)。A.增大 投料比 投料比 | B.增大压强 |
| C.使用高效催化剂 | D.及时将 分离 分离 |
(3)实验测得
 平衡转化率(曲线
平衡转化率(曲线 )和平衡时
)和平衡时 的选择性(曲线
的选择性(曲线 )随温度变化如图所示。(已知:
)随温度变化如图所示。(已知: 的选择性
的选择性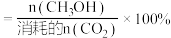 )
)
①
 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为②
 时,往恒容密闭容器中按
时,往恒容密闭容器中按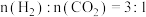 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内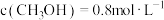 ,则反应
,则反应 的平衡常数
的平衡常数
(4)
 和
和 在某催化剂表面合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
①气体在催化剂表面的吸附是
②该反应历程中反应速率最快步骤的化学方程式为
(5)甲醇脱水可制得二甲醚:
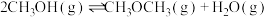
 。实验测得:
。实验测得: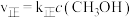 ,
,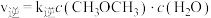 ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入
温度下,向2L恒容密闭容器中加入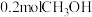 ,起始压强为
,起始压强为 ,
, 时该反应达到平衡。此时测得
时该反应达到平衡。此时测得 的体积分数为
的体积分数为 ,则平衡时
,则平衡时 的转化率
的转化率
 时,
时,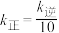 ,则
,则
 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
您最近一年使用:0次
【推荐3】碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知25℃, 时:
时:
① 葡萄糖
葡萄糖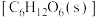 完全燃烧生成
完全燃烧生成 和
和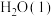 ,放出
,放出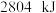 热量。
热量。
②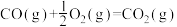
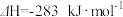 。
。
回答问题:
(1)25℃时, 与
与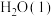 经光合作用生成葡萄糖
经光合作用生成葡萄糖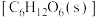 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2)25℃, 时,气态分子断开
时,气态分子断开 化学键的焓变称为键焓。已知
化学键的焓变称为键焓。已知 、
、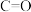 键的键焓分别为
键的键焓分别为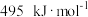 、
、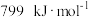 ,
,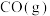 分子中碳氧键的键焓为
分子中碳氧键的键焓为___________  。
。
(3)溶于水的 只有部分转化为
只有部分转化为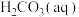 ,大部分以水合
,大部分以水合 的形式存在,水合
的形式存在,水合 可用
可用 表示。已知25℃时,
表示。已知25℃时,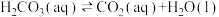 的平衡常数
的平衡常数 ,正反应的速率可表示为
,正反应的速率可表示为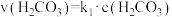 ,逆反应的速率可表示为
,逆反应的速率可表示为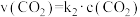 ,则
,则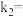
___________ (用含 的代数式表示)。
的代数式表示)。
(4)25℃时,潮湿的石膏雕像表面会发生反应: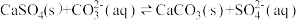 ,其平衡常数
,其平衡常数
___________ 。[已知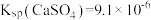 ,
, ]
]
(5)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因___________ 。
 时:
时:①
 葡萄糖
葡萄糖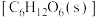 完全燃烧生成
完全燃烧生成 和
和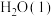 ,放出
,放出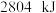 热量。
热量。②
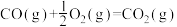
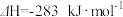 。
。回答问题:
(1)25℃时,
 与
与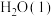 经光合作用生成葡萄糖
经光合作用生成葡萄糖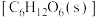 和
和 的热化学方程式为
的热化学方程式为(2)25℃,
 时,气态分子断开
时,气态分子断开 化学键的焓变称为键焓。已知
化学键的焓变称为键焓。已知 、
、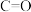 键的键焓分别为
键的键焓分别为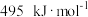 、
、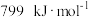 ,
,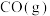 分子中碳氧键的键焓为
分子中碳氧键的键焓为 。
。(3)溶于水的
 只有部分转化为
只有部分转化为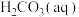 ,大部分以水合
,大部分以水合 的形式存在,水合
的形式存在,水合 可用
可用 表示。已知25℃时,
表示。已知25℃时,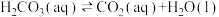 的平衡常数
的平衡常数 ,正反应的速率可表示为
,正反应的速率可表示为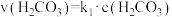 ,逆反应的速率可表示为
,逆反应的速率可表示为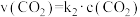 ,则
,则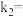
 的代数式表示)。
的代数式表示)。(4)25℃时,潮湿的石膏雕像表面会发生反应:
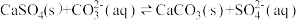 ,其平衡常数
,其平衡常数
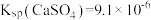 ,
, ]
](5)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】实现二氧化碳选择性、稳定性加氢合成甲醇是“甲醇经济”理念下的一个重要成果。由CO2和H2合成CH3OH的反应过程如下:
I.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+40.9kJ·mol-1
CO(g)+H2O(g) △H1=+40.9kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1
回答下列问题:
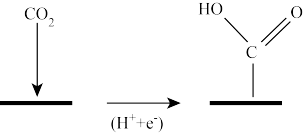
(1)如图是一种特定条件下反应I机理中的第一步变化,则碳原子的杂化类型从____ 变为___ 。
(2)写出由CO2和H2合成CH3OH的热化学方程式为____ 。
(3)恒压条件下,按n(CO2):n(H2)=1:3投料时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出H2O)
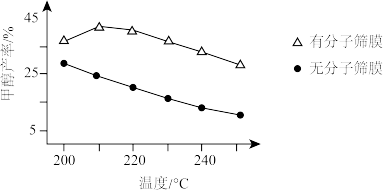
①根据图中数据,恒压条件下采用有分子筛膜时的最佳反应温度为____ ℃。
②有分子筛膜时甲醇产率高的原因是____ 。
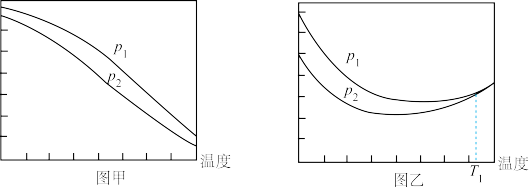
(4)不同压强下,依然按n(CO2):n(H2)=1:3投料,测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
已知:CO2的平衡转化率=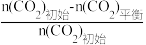 ×100%
×100%
CH3OH的平衡产率= ×100%
×100%
①压强:p1____ p2(填“>”“=”或“<”),判断依据是____ 。
②纵坐标表示CO2平衡转化率的是图____ (填“甲”或“乙”)。
③图乙中T1温度时,两条曲线几乎交于一点的原因是____ 。
I.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+40.9kJ·mol-1
CO(g)+H2O(g) △H1=+40.9kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1回答下列问题:
(1)如图是一种特定条件下反应I机理中的第一步变化,则碳原子的杂化类型从

(2)写出由CO2和H2合成CH3OH的热化学方程式为
(3)恒压条件下,按n(CO2):n(H2)=1:3投料时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出H2O)

①根据图中数据,恒压条件下采用有分子筛膜时的最佳反应温度为
②有分子筛膜时甲醇产率高的原因是
(4)不同压强下,依然按n(CO2):n(H2)=1:3投料,测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。

已知:CO2的平衡转化率=
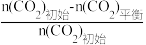 ×100%
×100%CH3OH的平衡产率=
 ×100%
×100%①压强:p1
②纵坐标表示CO2平衡转化率的是图
③图乙中T1温度时,两条曲线几乎交于一点的原因是
您最近一年使用:0次
【推荐2】丙烯是重要的化工原料,可以用于生产丙醇,卤代烃和塑料。因此生产丙烯具有重要的经济效益和社会价值。用二氧化碳氧化丙烷可以制丙烯,丙烷经催化脱氢也可制备丙烯:C3H8 C3H6+H2。
C3H6+H2。
(1)用二氧化碳氧化丙烷制丙烯主要反应如下:
I.C3H8(g)+CO2(g) C3H6(g)+CO(g)+H2O(g) ∆H1=+47 kJ/mol
C3H6(g)+CO(g)+H2O(g) ∆H1=+47 kJ/mol
II.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2=-76 kJ/mol
CO(g)+H2O(g) ∆H2=-76 kJ/mol
III.丙烷经催化脱氢制丙烯的热化学方程式为:___________ 。
(2)将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,在600℃时经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
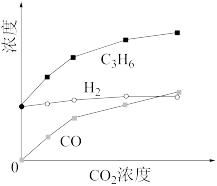
根据上图分析,如果只根据反应III C3H8(g) C3H6(g)+H2(g),生成的C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,推测可能的原因:
C3H6(g)+H2(g),生成的C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,推测可能的原因:___________ ;其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率___________ (填“越大”,“越小”,“无影响”),该反应的平衡常数___________ (填“增大”,“减小”,“不变”)。
(3)C3H8(g) C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为P1和P2时,测得丙烷及丙烯的物质的量分数如图所示:
C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为P1和P2时,测得丙烷及丙烯的物质的量分数如图所示:
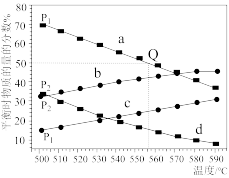
图中a,b,c,d代表丙烷或丙烯,则a,d代表___________ ,P1___________ P2(填“大于”“小于”“等于”);若P1=0.2MPa,起始时充入一定量的丙烷在恒压条件下发生反应,计算Q点对应温度下丙烷的转化率为___________ (保留一位小数),该反应的平衡常数KP=___________ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
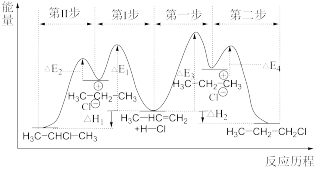
(4)丙烯与HCl发生加成反应,生成CH3CHClCH3和CH3CH2CH2Cl两种产物,其能量与反应历程如图所示。其中正确的说法是___________。
 C3H6+H2。
C3H6+H2。(1)用二氧化碳氧化丙烷制丙烯主要反应如下:
I.C3H8(g)+CO2(g)
 C3H6(g)+CO(g)+H2O(g) ∆H1=+47 kJ/mol
C3H6(g)+CO(g)+H2O(g) ∆H1=+47 kJ/molII.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2=-76 kJ/mol
CO(g)+H2O(g) ∆H2=-76 kJ/molIII.丙烷经催化脱氢制丙烯的热化学方程式为:
(2)将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,在600℃时经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。

根据上图分析,如果只根据反应III C3H8(g)
 C3H6(g)+H2(g),生成的C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,推测可能的原因:
C3H6(g)+H2(g),生成的C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,推测可能的原因:(3)C3H8(g)
 C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为P1和P2时,测得丙烷及丙烯的物质的量分数如图所示:
C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为P1和P2时,测得丙烷及丙烯的物质的量分数如图所示:
图中a,b,c,d代表丙烷或丙烯,则a,d代表
(4)丙烯与HCl发生加成反应,生成CH3CHClCH3和CH3CH2CH2Cl两种产物,其能量与反应历程如图所示。其中正确的说法是___________。

| A.丙烯与HCl发生的反应是放热反应,所以能自发进行 |
| B.合成CH3CHClCH3的反应中,第I步反应为整个反应的决速步骤 |
| C.从能量角度看,较稳定的产物是CH3CHClCH3 |
| D.总反应CH2=CH-CH3(g)+HCl(g)=CH3CH2CH2Cl(g)的∆H=∆E3-∆E4 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①在一定条件下,在一个容积固定为2L的密闭容器中充入0.8molNO和1.20molCO,开始反应至3min时测得CO的转化率为20%,则用N2表示的平均反应速率为v(N2)=_______ 。
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),
则该反应平衡常数的表达式Kp=_______ 。
③该反应在低温下能自发进行,该反应的△H_______ 0(选填“>”、“=”或“<”)。
④在某一绝热,恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知t2-t1=t3-t2)。则下列说法不正确的是_______ 。(填编号)
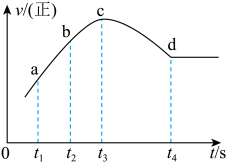
A.反应在c点未达到平衡状态 B.反应速率a点小于b点
C.反应物浓度a点大于b点 D.NO的转化率t1-t2=t2-t3
(2)使用甲醇汽油可能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g) CH3OH(g),到达平衡时,测得CO、H2、CH3OH 分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)
CH3OH(g),到达平衡时,测得CO、H2、CH3OH 分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正) _______ v(逆)(选填‘‘>”、“<’’或“=”),判断的理由_______ 。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
已知一定条件下,该反应中CO的平衡转化率随温度、投料比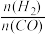 的变化曲线如图:
的变化曲线如图:


①a、b、c按从大到小的顺序排序为_______ 。
②某温度下,将2.0mol CO(g)和4.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如上图所示,关于温度和压强的关系判断正确的是_______ ;
A.p3>p2,T3>T2 B.p1>p3,T1>T3
C.p2>p4,T4>T2 D.p1>p4,T2>T3
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_______ 。
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积百分含量增大
E.混合气体的密度减小
F.氢气的转化率减小
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g)+N2(g)
2CO2(g)+N2(g)①在一定条件下,在一个容积固定为2L的密闭容器中充入0.8molNO和1.20molCO,开始反应至3min时测得CO的转化率为20%,则用N2表示的平均反应速率为v(N2)=
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),
则该反应平衡常数的表达式Kp=
③该反应在低温下能自发进行,该反应的△H
④在某一绝热,恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知t2-t1=t3-t2)。则下列说法不正确的是

A.反应在c点未达到平衡状态 B.反应速率a点小于b点
C.反应物浓度a点大于b点 D.NO的转化率t1-t2=t2-t3
(2)使用甲醇汽油可能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)
 CH3OH(g),到达平衡时,测得CO、H2、CH3OH 分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)
CH3OH(g),到达平衡时,测得CO、H2、CH3OH 分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正) (3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比
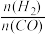 的变化曲线如图:
的变化曲线如图:

①a、b、c按从大到小的顺序排序为
②某温度下,将2.0mol CO(g)和4.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如上图所示,关于温度和压强的关系判断正确的是
A.p3>p2,T3>T2 B.p1>p3,T1>T3
C.p2>p4,T4>T2 D.p1>p4,T2>T3
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积百分含量增大
E.混合气体的密度减小
F.氢气的转化率减小
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】国家主席习近平指出,为推动实现碳达峰碳中和目标,我国将陆续发布重点领域和行业碳达峰实施方案和一系列支撑保障措施,构建起碳达峰、碳中和“ ”政策体系。二氧化碳加氢可转化为二甲醚,既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
”政策体系。二氧化碳加氢可转化为二甲醚,既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
(1)制取二甲醚的热化学方程式为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H,则∆H=
CH3OCH3(g)+3H2O(g) ∆H,则∆H=_______ 。
已知:① CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=—49.0kJ∙mol-1
CH3OH(g)+H2O(g) ∆H1=—49.0kJ∙mol-1
② 2 CH3OH(g) CH3OCH3(g)+H2O(g) ∆H2=—23.5kJ∙mol-1
CH3OCH3(g)+H2O(g) ∆H2=—23.5kJ∙mol-1
(2)往一容积为 的恒容密闭容器中通入
的恒容密闭容器中通入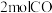 和
和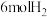 ,一定温度下发生反应:2CO2(g)+6H2(g)
,一定温度下发生反应:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),起始总压为
CH3OCH3(g)+3H2O(g),起始总压为 ,
, 时达到化学平衡状态,测得CH3OCH3的物质的量分数为12.5%。
时达到化学平衡状态,测得CH3OCH3的物质的量分数为12.5%。
① 达到化学平衡状态时,下列有关叙述正确的是_______ (填字母序号)。
a.容器内气体压强不再发生改变
b.反应达到平衡状态和未达平衡状态时,混合气体的密度不同
c.向容器内再通入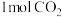 和
和 ,重新达平衡后CH3OCH3体积分数增大
,重新达平衡后CH3OCH3体积分数增大
d.向容器内通入少量氦气,则平衡向正反应方向移动
②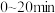 内,用
内,用 表示的平均反应速率
表示的平均反应速率
_______ ,CO2的平衡转化率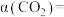
_______ (保留三位有效数字);该温度下,反应的平衡常数KP=_______ (用含 的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③升高温度,二甲醚的平衡产率_______ (填“增大”、“减小”或“不变”),简述理由:_______ 。
 ”政策体系。二氧化碳加氢可转化为二甲醚,既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
”政策体系。二氧化碳加氢可转化为二甲醚,既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:(1)制取二甲醚的热化学方程式为:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ∆H,则∆H=
CH3OCH3(g)+3H2O(g) ∆H,则∆H=已知:① CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1=—49.0kJ∙mol-1
CH3OH(g)+H2O(g) ∆H1=—49.0kJ∙mol-1② 2 CH3OH(g)
 CH3OCH3(g)+H2O(g) ∆H2=—23.5kJ∙mol-1
CH3OCH3(g)+H2O(g) ∆H2=—23.5kJ∙mol-1(2)往一容积为
 的恒容密闭容器中通入
的恒容密闭容器中通入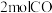 和
和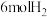 ,一定温度下发生反应:2CO2(g)+6H2(g)
,一定温度下发生反应:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),起始总压为
CH3OCH3(g)+3H2O(g),起始总压为 ,
, 时达到化学平衡状态,测得CH3OCH3的物质的量分数为12.5%。
时达到化学平衡状态,测得CH3OCH3的物质的量分数为12.5%。① 达到化学平衡状态时,下列有关叙述正确的是
a.容器内气体压强不再发生改变
b.反应达到平衡状态和未达平衡状态时,混合气体的密度不同
c.向容器内再通入
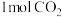 和
和 ,重新达平衡后CH3OCH3体积分数增大
,重新达平衡后CH3OCH3体积分数增大d.向容器内通入少量氦气,则平衡向正反应方向移动
②
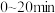 内,用
内,用 表示的平均反应速率
表示的平均反应速率
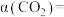
 的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。③升高温度,二甲醚的平衡产率
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】可再生能源实验室提出了一种生物油制氢的技术路线:先将生物质原料经快速热解得到热解油,然后再将生物油重整制取氢气。乙酸和苯酚是生物油的两种主要组分。
某研究团队分别以乙酸和苯酚为生物油模拟物进行蒸汽催化重整实验。其中乙酸重整制氢的工艺主要包含如下反应:
I.乙酸分解:

Ⅱ.水煤气变换:

Ⅲ.甲烷化反应: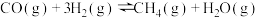

回答下列问题:
(1)①乙酸重整制氢的总反应

_______ 。
②若忽略过程反应,只考虑乙酸重整的总反应,欲提高反应速率和乙酸的转化率,若只改变条件,可采取的措施(温度改变除外)为_______ 。
(2)乙酸重整工艺中在催化剂表面会出现积碳的现象,积碳主要来源于CO的歧化反应: 。对CO歧化反应进行独立研究:T℃时,向一个1L恒容密闭容器中充入0.7molCO,测得平衡后
。对CO歧化反应进行独立研究:T℃时,向一个1L恒容密闭容器中充入0.7molCO,测得平衡后 的气体体积分数为40%,则该温度下,CO的平衡转化率和平衡常数K为:
的气体体积分数为40%,则该温度下,CO的平衡转化率和平衡常数K为:_______ (要求写出计算过程)。
(3)水油比(S/B,即起始水和乙酸的质量比)对乙酸重整反应的影响如图所示:

请结合相关原理解释当水油比从2到6时, 和
和 产率变化的原因:
产率变化的原因:_______ 。
(4)下图所示为乙酸在Co基催化剂下的反应路径和能垒数据(单位:eV):

①该条件下, 更容易断裂的是
更容易断裂的是_______ 键(填“C—C”、“C—H”、“C=O”、“O—H”、“C—O”),从 到
到 的历程中,决速步骤为
的历程中,决速步骤为_______ (填序号)。
②若反应⑤可表示为 ,反应⑥同时生成了CO*,则反应⑥可表示为
,反应⑥同时生成了CO*,则反应⑥可表示为_______ 。
某研究团队分别以乙酸和苯酚为生物油模拟物进行蒸汽催化重整实验。其中乙酸重整制氢的工艺主要包含如下反应:
I.乙酸分解:


Ⅱ.水煤气变换:


Ⅲ.甲烷化反应:
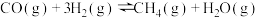

回答下列问题:
(1)①乙酸重整制氢的总反应


②若忽略过程反应,只考虑乙酸重整的总反应,欲提高反应速率和乙酸的转化率,若只改变条件,可采取的措施(温度改变除外)为
(2)乙酸重整工艺中在催化剂表面会出现积碳的现象,积碳主要来源于CO的歧化反应:
 。对CO歧化反应进行独立研究:T℃时,向一个1L恒容密闭容器中充入0.7molCO,测得平衡后
。对CO歧化反应进行独立研究:T℃时,向一个1L恒容密闭容器中充入0.7molCO,测得平衡后 的气体体积分数为40%,则该温度下,CO的平衡转化率和平衡常数K为:
的气体体积分数为40%,则该温度下,CO的平衡转化率和平衡常数K为:(3)水油比(S/B,即起始水和乙酸的质量比)对乙酸重整反应的影响如图所示:

请结合相关原理解释当水油比从2到6时,
 和
和 产率变化的原因:
产率变化的原因:(4)下图所示为乙酸在Co基催化剂下的反应路径和能垒数据(单位:eV):

①该条件下,
 更容易断裂的是
更容易断裂的是 到
到 的历程中,决速步骤为
的历程中,决速步骤为②若反应⑤可表示为
 ,反应⑥同时生成了CO*,则反应⑥可表示为
,反应⑥同时生成了CO*,则反应⑥可表示为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】含铁化合物是重要的基础材料。请问答:
(1)高炉炼铁中发生的基本反应之一为:
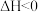
①在1100℃时,K=0.263,若此时测得高炉中 ,
, ,判断反应速率v(正)
,判断反应速率v(正)_______ v(逆),理由是_______ 。
②下列说法不正确的是_______ 。
A.须采用高温高压的反应条件使FeO还原为Fe
B.粉碎FeO能增大接触面积从而提高反应速率
C.平衡时提高CO气体的分压有利于提高Fe的产量
D.加入CaCO3(s)后因分解产生CO2,平衡一定逆向移动
(2)根据氯化铁溶液回答下列问题:
①不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是_______ (填化学式)。
②在配制FeCl3溶液时,加入盐酸的目的是_______ 。
(1)高炉炼铁中发生的基本反应之一为:

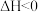
①在1100℃时,K=0.263,若此时测得高炉中
 ,
, ,判断反应速率v(正)
,判断反应速率v(正)②下列说法不正确的是
A.须采用高温高压的反应条件使FeO还原为Fe
B.粉碎FeO能增大接触面积从而提高反应速率
C.平衡时提高CO气体的分压有利于提高Fe的产量
D.加入CaCO3(s)后因分解产生CO2,平衡一定逆向移动
(2)根据氯化铁溶液回答下列问题:
①不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是
②在配制FeCl3溶液时,加入盐酸的目的是
您最近一年使用:0次



