我国科学家设计的化学链重整联合CO2捕集制H2系统如下图所示:
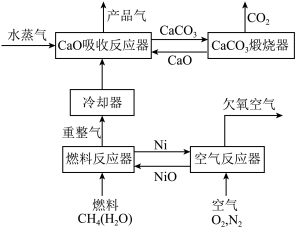
(1)空气反应器中发生___________ 反应(填“吸热”或“放热”)。
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有___________ 。
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =___________ 。
② 反应温度对H2产率(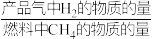 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
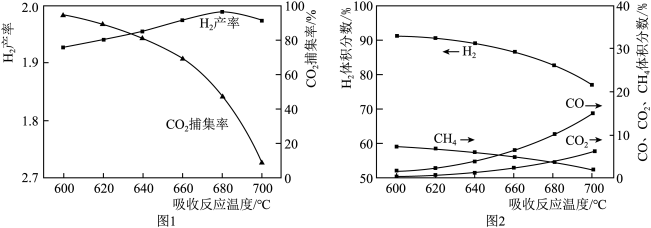
结合化学方程式说明图1中温度升高CO2捕集率降低的原因___________ ;解释图2中温度升高H2体积分数降低的原因___________ 。
(4)燃料反应器和吸收反应器中加入水蒸气的作用___________ 。

(1)空气反应器中发生
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =
② 反应温度对H2产率(
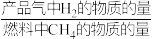 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
结合化学方程式说明图1中温度升高CO2捕集率降低的原因
(4)燃料反应器和吸收反应器中加入水蒸气的作用
更新时间:2024-04-06 08:32:24
|
相似题推荐
【推荐1】钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
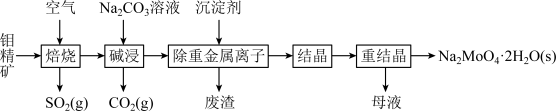
(1)提高焙烧效率的方法有:_____________ (写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________ 。氧化产物是________________ 。
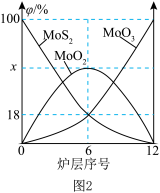
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________ 。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________ 。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为______________________ 。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________ 。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕

(1)提高焙烧效率的方法有:
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是

(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
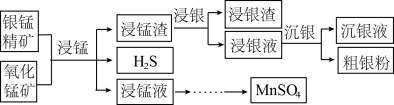
【推荐2】以银锰精矿(主要含 、
、 、
、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下。
)为原料联合提取银和锰的一种流程示意图如下。
已知:酸性条件下, 的氧化性强于
的氧化性强于 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。“浸锰”过程中,发生了反应
的形式残留于浸锰渣中。“浸锰”过程中,发生了反应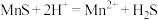 ,其平衡常数K与
,其平衡常数K与 、
、 、
、 的代数关系式为
的代数关系式为
_______ 。
(2)“浸银”时,使用过量 、
、 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以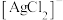 形式浸出。
形式浸出。
①“浸银”反应的离子方程式为_______ 。
②结合平衡移动原理,解释浸出剂中 、
、 的作用是
的作用是_______ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①“沉银”过程中主要反应的离子方程式为_______ 。
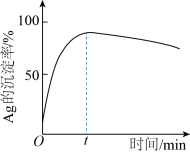
②一定温度下, 的沉淀率随反应时间的变化如图所示。解释t分钟后
的沉淀率随反应时间的变化如图所示。解释t分钟后 的沉淀率逐渐减小的原因是
的沉淀率逐渐减小的原因是_______ 。
(4)“浸锰”过程中产生的 可用于“浸银”,生产中需要测定
可用于“浸银”,生产中需要测定 的浓度来确定其用量。测定方法:准确量取20.00
的浓度来确定其用量。测定方法:准确量取20.00 浸取液置于250
浸取液置于250 锥形瓶中,加入适量稀硫酸,滴加稍过量的
锥形瓶中,加入适量稀硫酸,滴加稍过量的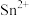 溶液(
溶液(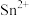 将
将 还原为
还原为 ),充分反应后,除去过量的
),充分反应后,除去过量的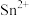 。用
。用
 溶液滴定至终点(滴定过程中
溶液滴定至终点(滴定过程中 与
与 反应生成
反应生成 和
和 ),消耗
),消耗 溶液12.00
溶液12.00 。计算浸取液中
。计算浸取液中 的浓度
的浓度_______ (写出计算过程)。
 、
、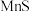 、
、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下。
)为原料联合提取银和锰的一种流程示意图如下。
已知:酸性条件下,
 的氧化性强于
的氧化性强于 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。“浸锰”过程中,发生了反应
的形式残留于浸锰渣中。“浸锰”过程中,发生了反应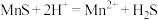 ,其平衡常数K与
,其平衡常数K与 、
、 、
、 的代数关系式为
的代数关系式为
(2)“浸银”时,使用过量
 、
、 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以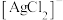 形式浸出。
形式浸出。①“浸银”反应的离子方程式为
②结合平衡移动原理,解释浸出剂中
 、
、 的作用是
的作用是(3)“沉银”过程中需要过量的铁粉作为还原剂。
①“沉银”过程中主要反应的离子方程式为
②一定温度下,
 的沉淀率随反应时间的变化如图所示。解释t分钟后
的沉淀率随反应时间的变化如图所示。解释t分钟后 的沉淀率逐渐减小的原因是
的沉淀率逐渐减小的原因是
(4)“浸锰”过程中产生的
 可用于“浸银”,生产中需要测定
可用于“浸银”,生产中需要测定 的浓度来确定其用量。测定方法:准确量取20.00
的浓度来确定其用量。测定方法:准确量取20.00 浸取液置于250
浸取液置于250 锥形瓶中,加入适量稀硫酸,滴加稍过量的
锥形瓶中,加入适量稀硫酸,滴加稍过量的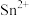 溶液(
溶液(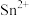 将
将 还原为
还原为 ),充分反应后,除去过量的
),充分反应后,除去过量的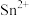 。用
。用
 溶液滴定至终点(滴定过程中
溶液滴定至终点(滴定过程中 与
与 反应生成
反应生成 和
和 ),消耗
),消耗 溶液12.00
溶液12.00 。计算浸取液中
。计算浸取液中 的浓度
的浓度
您最近半年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
(1)BF2的结构式为____________ 。
(2)D和F的氢化物中沸点较高的是______________ (填化学式)。
(3)实验室制取G2气体的离子方程式为_____________________________________________ 。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_________________________________________________________ 。
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为__________________________________________________________ 。
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为__________________________________________________________ 。
(7)上述元素可组成盐Q:CA4E(FD4)2。向盛有20 mL 0.5 mol/L Q溶液的烧杯中加入12 mL 2.0 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ 。
| B | ||
| F |
(2)D和F的氢化物中沸点较高的是
(3)实验室制取G2气体的离子方程式为
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为
(7)上述元素可组成盐Q:CA4E(FD4)2。向盛有20 mL 0.5 mol/L Q溶液的烧杯中加入12 mL 2.0 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】2021年6月17日,搭载神舟十二号载人飞船的长征二号F摇十二运载火箭,在酒泉卫星发射中心发射。该运载火箭推进物分为偏二甲基肼( ),四氧化二氮和液氢、液氧两种。
),四氧化二氮和液氢、液氧两种。
(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
由以上数据可求得
___________ 。
(2)在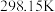 、
、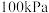 条件下,
条件下,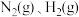 和
和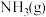 的摩尔热容分别为29.1,28.9和
的摩尔热容分别为29.1,28.9和 (已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。
(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。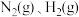 合成
合成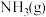 的能量随温度T的变化示意图合理的是___________。
的能量随温度T的变化示意图合理的是___________。
(3)甲烷水蒸气催化重整是制高纯氢的方法之一、反应器中存在如下反应:
ⅰ.
ⅱ.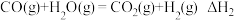
ⅲ.
ⅳ.
ⅳ为积炭反应,利用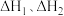 和
和 ,可计算
,可计算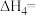
___________ 。
(4) 液态偏二甲基肼与足量液态四氧化二氮完全反应生成
液态偏二甲基肼与足量液态四氧化二氮完全反应生成 和
和 ,放出
,放出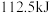 的热量,写出上述反应的热化学方程式
的热量,写出上述反应的热化学方程式___________ 。
(5)对 和
和 反应的说法正确的是___________(填字母)。
反应的说法正确的是___________(填字母)。
(6)如图为甲烷燃料电池

①下列有关说法正确的是___________ (填字母)。
A.燃料电池将电能转变为化学能
B.负极的电极反应式为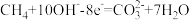
C.正极的电极反应式为
D.通入甲烷的电极发生还原反应
②当消耗甲烷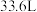 (标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为
(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为___________  。
。
 ),四氧化二氮和液氢、液氧两种。
),四氧化二氮和液氢、液氧两种。(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
| 化学键 |  | 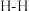 |  |
键能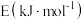 | 946.0 | 436.0 | 390.8 |

(2)在
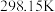 、
、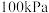 条件下,
条件下,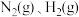 和
和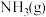 的摩尔热容分别为29.1,28.9和
的摩尔热容分别为29.1,28.9和 (已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。
(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。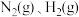 合成
合成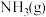 的能量随温度T的变化示意图合理的是___________。
的能量随温度T的变化示意图合理的是___________。A. | B.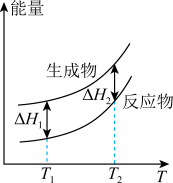 |
C.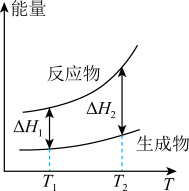 | D.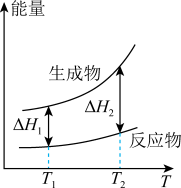 |
ⅰ.

ⅱ.
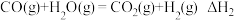
ⅲ.

ⅳ.

ⅳ为积炭反应,利用
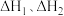 和
和 ,可计算
,可计算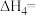
(4)
 液态偏二甲基肼与足量液态四氧化二氮完全反应生成
液态偏二甲基肼与足量液态四氧化二氮完全反应生成 和
和 ,放出
,放出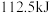 的热量,写出上述反应的热化学方程式
的热量,写出上述反应的热化学方程式(5)对
 和
和 反应的说法正确的是___________(填字母)。
反应的说法正确的是___________(填字母)。| A.偏二甲肼是比液氢更环保的燃料 | B. 即是氧化产物,又是还原产物 即是氧化产物,又是还原产物 |
C.偏二甲基肼的燃烧热为 | D.偏二甲肼在四氧化二氮中的燃烧是放热反应 |

①下列有关说法正确的是
A.燃料电池将电能转变为化学能
B.负极的电极反应式为
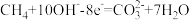
C.正极的电极反应式为

D.通入甲烷的电极发生还原反应
②当消耗甲烷
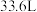 (标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为
(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为 。
。
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】丁二烯、异丁烯均是重要的有机化工原料,广泛用于有机合成和精细化工。
I.正丁烷催化氧化制1.3-丁二烯的一种反应途径如图所示。
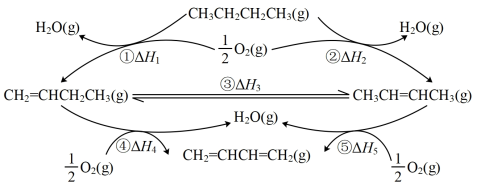
(1)已知: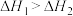 ,则
,则
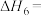
______ ,相同条件下,稳定性:1-丁烯______ (填“>”、“<”或“=”)2-丁烯。
(2)在某恒温恒容密闭容器中通入等物质的量的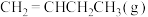 和
和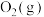 ,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。
,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。
II.正丁烷脱氢异构制异丁烯。
温度为T℃,向体积不等的恒容密闭容器中均充入1 mol正丁烷,发生反应:

 ,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。
,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。
(3)A点时
______ (填“>”、“=”或“<”,同) ;正反应速率:
;正反应速率:
______ 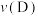 。
。
(4)若C点为平衡点且容器总压强为0.4 MPa,则该条件下,反应的平衡常数
______ MPa(以分压表示的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
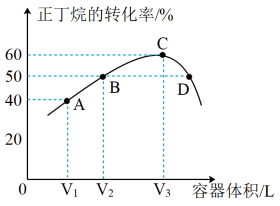
(5)向A点对应的反应体系中再充入一定量的正丁烷,达到平衡时,正丁烷的转化率______ (填“增大”、“减小”或“不变”)。
(6)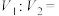
______ 。
I.正丁烷催化氧化制1.3-丁二烯的一种反应途径如图所示。

(1)已知:
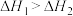 ,则
,则
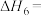
(2)在某恒温恒容密闭容器中通入等物质的量的
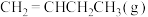 和
和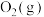 ,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。
,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。| A.混合气体的密度不再改变 |
| B.混合气体平均摩尔质量不再改变 |
C.丁二烯和 的物质的量之比不再改变 的物质的量之比不再改变 |
D.1-丁烯和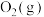 的物质的量之比不再改变 的物质的量之比不再改变 |
II.正丁烷脱氢异构制异丁烯。
温度为T℃,向体积不等的恒容密闭容器中均充入1 mol正丁烷,发生反应:

 ,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。
,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。(3)A点时

 ;正反应速率:
;正反应速率:
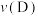 。
。(4)若C点为平衡点且容器总压强为0.4 MPa,则该条件下,反应的平衡常数

 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
(5)向A点对应的反应体系中再充入一定量的正丁烷,达到平衡时,正丁烷的转化率
(6)
您最近半年使用:0次
【推荐3】铁的化合物在工业中有重要价值。回答下列问题:
(1)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①
②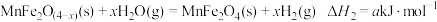
③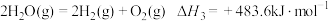
则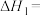
_______ (用含a、x的代数式表示)。
(2) 是一种重要的催化剂,制取反应为
是一种重要的催化剂,制取反应为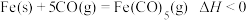 。在1L恒容密闭容器中加入足量铁粉和0.24molCO。
。在1L恒容密闭容器中加入足量铁粉和0.24molCO。
①0~30min内在T温度下进行反应,测得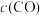 、
、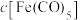 随时间的变化关系,以及30min和40min开始随条件的变化关系如图所示。0~20min内用
随时间的变化关系,以及30min和40min开始随条件的变化关系如图所示。0~20min内用 表示的平均反应速率为
表示的平均反应速率为_______  ;若平衡时体系总压强为p,则用气体分压表示的压强平衡常数
;若平衡时体系总压强为p,则用气体分压表示的压强平衡常数
_______ 。
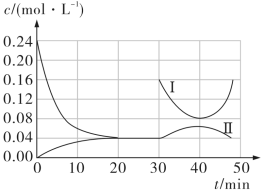
②30min时改变的条件是_______ 。40min后曲线Ⅱ下降的原因是_______ 。
(3)磷酸铁锂(LiFePO4)是一种重要的锂离子电池正极材料。LiFePO4的晶胞结构示意图如图-1所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。

①图-2中x=_______ ;
②请写出图-3到图-2的电极方程式:_______ (不含x)。
(1)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①

②
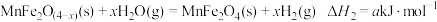
③
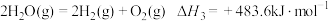
则
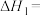
(2)
 是一种重要的催化剂,制取反应为
是一种重要的催化剂,制取反应为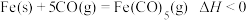 。在1L恒容密闭容器中加入足量铁粉和0.24molCO。
。在1L恒容密闭容器中加入足量铁粉和0.24molCO。①0~30min内在T温度下进行反应,测得
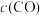 、
、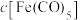 随时间的变化关系,以及30min和40min开始随条件的变化关系如图所示。0~20min内用
随时间的变化关系,以及30min和40min开始随条件的变化关系如图所示。0~20min内用 表示的平均反应速率为
表示的平均反应速率为 ;若平衡时体系总压强为p,则用气体分压表示的压强平衡常数
;若平衡时体系总压强为p,则用气体分压表示的压强平衡常数

②30min时改变的条件是
(3)磷酸铁锂(LiFePO4)是一种重要的锂离子电池正极材料。LiFePO4的晶胞结构示意图如图-1所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。

①图-2中x=
②请写出图-3到图-2的电极方程式:
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】工业废水中常含有一定量的 ,会危害生态系统,必须进行处理。常将
,会危害生态系统,必须进行处理。常将 转化为纺织印染中的媒染剂
转化为纺织印染中的媒染剂 ,变废为宝。该法用酸性含铬废液(含
,变废为宝。该法用酸性含铬废液(含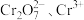 及少量
及少量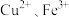 等)制备
等)制备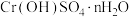 晶体,工艺流程如下:
晶体,工艺流程如下:
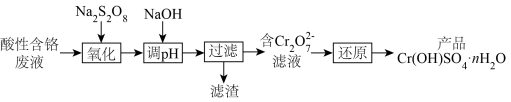
常温下, 金属离子形成氢氧化物沉淀的
金属离子形成氢氧化物沉淀的 范围如表。已知:
范围如表。已知:
回答下列问题
(1)“氧化”时,
①将 先氧化为
先氧化为 的目的是
的目的是_______ 。
②加入的 (
( 为+6价)中,
为+6价)中,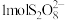 含有过氧键数目为
含有过氧键数目为_______ 。
③完成下列离子方程式:_______ 。

(2)“调 ”时,加入
”时,加入 至溶液呈碱性,但
至溶液呈碱性,但 不能大于9的原因是
不能大于9的原因是_______ ;
(3)“过滤”时,滤渣的主要成分是_______ 。(填化学式)
(4)“还原”时,还原剂将 还原为
还原为 ,最适合的还原剂是_______。
,最适合的还原剂是_______。
(5)从 溶液得到
溶液得到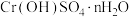 晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
 ,会危害生态系统,必须进行处理。常将
,会危害生态系统,必须进行处理。常将 转化为纺织印染中的媒染剂
转化为纺织印染中的媒染剂 ,变废为宝。该法用酸性含铬废液(含
,变废为宝。该法用酸性含铬废液(含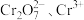 及少量
及少量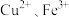 等)制备
等)制备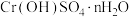 晶体,工艺流程如下:
晶体,工艺流程如下:
常温下,
 金属离子形成氢氧化物沉淀的
金属离子形成氢氧化物沉淀的 范围如表。已知:
范围如表。已知:
| 离子 | 开始沉淀的 | 完全沉淀的 |
 | 1.4 | 3.0 |
 | 4.2 | 6.7 |
 | 4.0 | 6.8 |
(1)“氧化”时,
①将
 先氧化为
先氧化为 的目的是
的目的是②加入的
 (
( 为+6价)中,
为+6价)中,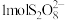 含有过氧键数目为
含有过氧键数目为③完成下列离子方程式:

(2)“调
 ”时,加入
”时,加入 至溶液呈碱性,但
至溶液呈碱性,但 不能大于9的原因是
不能大于9的原因是(3)“过滤”时,滤渣的主要成分是
(4)“还原”时,还原剂将
 还原为
还原为 ,最适合的还原剂是_______。
,最适合的还原剂是_______。A. | B. | C. | D. |
(5)从
 溶液得到
溶液得到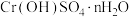 晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。乙醇与水催化重整制氢发生以下反应:
反应Ⅰ: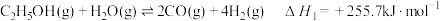
反应Ⅱ: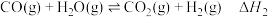
回答下列问题:
(1)①已知反应Ⅲ: ,则
,则
______ 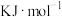 。
。
②反应I能自发进行的条件为______ 。
(2)压强为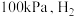 的平衡产率与温度、起始时
的平衡产率与温度、起始时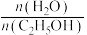 的关系如图所示,每条曲线表示
的关系如图所示,每条曲线表示
相同 的平衡产率。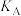
______ 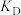 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
② 的产率:B点
的产率:B点______ C点(填“>”、“=”或“<”);
③A、B两点 产率相等的原因是
产率相等的原因是______ 。
(3)压强为 下,
下, 和
和 发生上述反应,平衡时
发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:CO的选择性
的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:CO的选择性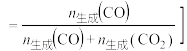
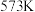 时,10分钟反应达到平衡,则乙醇的物质的量的变化量
时,10分钟反应达到平衡,则乙醇的物质的量的变化量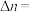
______ mol。
②表示 选择性的曲线是
选择性的曲线是______ (填标号)。
③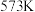 时,反应II的
时,反应II的
______ (保留三位有效数字)。
反应Ⅰ:
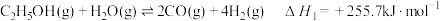
反应Ⅱ:
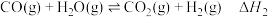
回答下列问题:
(1)①已知反应Ⅲ:
 ,则
,则
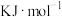 。
。②反应I能自发进行的条件为
(2)压强为
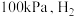 的平衡产率与温度、起始时
的平衡产率与温度、起始时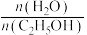 的关系如图所示,每条曲线表示
的关系如图所示,每条曲线表示
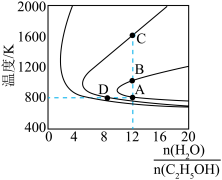
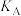
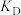 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②
 的产率:B点
的产率:B点③A、B两点
 产率相等的原因是
产率相等的原因是(3)压强为
 下,
下, 和
和 发生上述反应,平衡时
发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:CO的选择性
的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:CO的选择性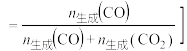
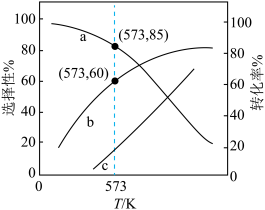
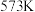 时,10分钟反应达到平衡,则乙醇的物质的量的变化量
时,10分钟反应达到平衡,则乙醇的物质的量的变化量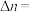
②表示
 选择性的曲线是
选择性的曲线是③
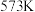 时,反应II的
时,反应II的
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】醛类物质的用途广泛。如,甲醛蒸气可对空气消毒、甲醛溶液可用于生物标本的防腐等;脂肪醛类一般具有麻醉、催眠作用等。回答下列问题:
Ⅰ. 与
与 反应用
反应用 催化的机理如图所示。
催化的机理如图所示。
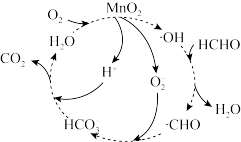
(1)在 ,催化下,
,催化下, 转化成
转化成 ,
, 被氧化成
被氧化成___________ (填离子符号)。
(2)该催化反应的总反应方程式为___________ 。
(3)已知 的两步电离常数分别为
的两步电离常数分别为 、
、 ,当溶液中
,当溶液中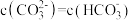 时,溶液
时,溶液
___________ 。
Ⅱ.利用乙二醛 催化氧化法合成乙醛酸的反应原理为:
催化氧化法合成乙醛酸的反应原理为:

可能发生副反应有: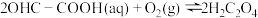 (草酸)
(草酸)
在反应瓶内加入含 (乙二醛)的反应液
(乙二醛)的反应液 ,加热至45~60℃,通入氧气并保持氧气压强为
,加热至45~60℃,通入氧气并保持氧气压强为 ,反应
,反应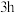 达平衡状态,得到的混合液中含
达平衡状态,得到的混合液中含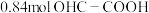 (乙醛酸),
(乙醛酸), (草酸),
(草酸),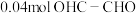 (乙二醛)(溶液体积变化可忽略不计)。
(乙二醛)(溶液体积变化可忽略不计)。
(1)草酸的平均生成速率为___________  。
。
(2)通过化学反应原理分析,增大压强有利于加快反应速率,对于乙二醛的转化率的影响是___________ (填“增大”或“减小”)。
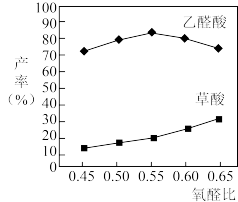
(3)如图所示为起始时氧醛比[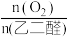 ]对乙醛酸产率的影响,则选择最佳氧醛比为
]对乙醛酸产率的影响,则选择最佳氧醛比为___________ 。
(4)已知: 为二元弱酸,
为二元弱酸,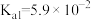 ,
,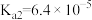 ,向
,向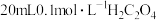 溶液中滴加
溶液中滴加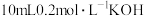 溶液。溶液中
溶液。溶液中
___________  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
Ⅰ.
 与
与 反应用
反应用 催化的机理如图所示。
催化的机理如图所示。
(1)在
 ,催化下,
,催化下, 转化成
转化成 ,
, 被氧化成
被氧化成(2)该催化反应的总反应方程式为
(3)已知
 的两步电离常数分别为
的两步电离常数分别为 、
、 ,当溶液中
,当溶液中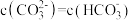 时,溶液
时,溶液
Ⅱ.利用乙二醛
 催化氧化法合成乙醛酸的反应原理为:
催化氧化法合成乙醛酸的反应原理为:
可能发生副反应有:
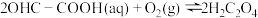 (草酸)
(草酸)在反应瓶内加入含
 (乙二醛)的反应液
(乙二醛)的反应液 ,加热至45~60℃,通入氧气并保持氧气压强为
,加热至45~60℃,通入氧气并保持氧气压强为 ,反应
,反应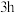 达平衡状态,得到的混合液中含
达平衡状态,得到的混合液中含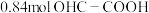 (乙醛酸),
(乙醛酸), (草酸),
(草酸),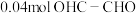 (乙二醛)(溶液体积变化可忽略不计)。
(乙二醛)(溶液体积变化可忽略不计)。(1)草酸的平均生成速率为
 。
。(2)通过化学反应原理分析,增大压强有利于加快反应速率,对于乙二醛的转化率的影响是
(3)如图所示为起始时氧醛比[
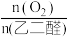 ]对乙醛酸产率的影响,则选择最佳氧醛比为
]对乙醛酸产率的影响,则选择最佳氧醛比为
(4)已知:
 为二元弱酸,
为二元弱酸,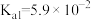 ,
,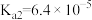 ,向
,向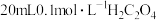 溶液中滴加
溶液中滴加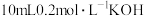 溶液。溶液中
溶液。溶液中
 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
您最近半年使用:0次
【推荐1】氮氧化物是大气污染物,其来源之一是汽车尾气的排放。
I.研究氮氧化物的反应机理,对消除环境污染有重要意义。在空气中NO与O2反应转化成NO2更易引发光化学烟雾,已知反应2NO(g)+O2(g) 2NO2(g)反应的历程为:第一步:2NO(g)
2NO2(g)反应的历程为:第一步:2NO(g) N2O2(g)快,第二步:N2O2(g)+O2(g)
N2O2(g)快,第二步:N2O2(g)+O2(g) 2NO2(g)慢,下列有关说法不正确的是
2NO2(g)慢,下列有关说法不正确的是____ 。
A. 2NO(g)+O2(g) 2NO2(g)的K=K1(第一步反应的平衡常数)×K2(第二步反应的平衡常数)
2NO2(g)的K=K1(第一步反应的平衡常数)×K2(第二步反应的平衡常数)
B.第一步反应的活化能E1大于第二步反应的活化能E2
C.第二步中的N2O2和O2的碰撞只部分有效
D. 2NO(g)+O2(g) 2NO2(g)的△S<0,该反应能自发进行,说明一定是放热反应
2NO2(g)的△S<0,该反应能自发进行,说明一定是放热反应
II.目前汽车尾气中的NO处理有以下几种方法:
(1)①已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol,C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=__________ 。
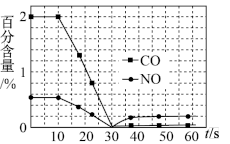
②某兴趣小组对某汽车冷启动时的尾气催化处理过程中CO、NO百分含量随时间变化加以分析,结果如图1所示,前0-10s阶段CO、NO百分含量没明显变化的原因是___________________ 。
③某温度℃下,向2L密闭容器中充入一定量NO和CO,在
 时刻达到平衡状态,此时n(CO)=1mol,n(NO)=2mol,n(N2)=2mol,在该温度下平衡常数K=
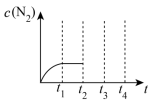
时刻达到平衡状态,此时n(CO)=1mol,n(NO)=2mol,n(N2)=2mol,在该温度下平衡常数K=_______ 。若保持体积不变,再向容器中充入2mol NO和2mol CO2,则此时v正______ v逆(填“>”、“=”或“<”);若在 时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下,
时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下, 时刻达到新的平衡状态,则请在下图中补充画出
时刻达到新的平衡状态,则请在下图中补充画出 时段N2物质的量浓度的变化趋势曲线。
时段N2物质的量浓度的变化趋势曲线。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度十倍),装置如右图所示,固体电解质可传导O2-。
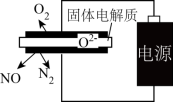
①阴极的电极反应式为________ 。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)____ (用反应式表示)。
I.研究氮氧化物的反应机理,对消除环境污染有重要意义。在空气中NO与O2反应转化成NO2更易引发光化学烟雾,已知反应2NO(g)+O2(g)
 2NO2(g)反应的历程为:第一步:2NO(g)
2NO2(g)反应的历程为:第一步:2NO(g) N2O2(g)快,第二步:N2O2(g)+O2(g)
N2O2(g)快,第二步:N2O2(g)+O2(g) 2NO2(g)慢,下列有关说法不正确的是
2NO2(g)慢,下列有关说法不正确的是A. 2NO(g)+O2(g)
 2NO2(g)的K=K1(第一步反应的平衡常数)×K2(第二步反应的平衡常数)
2NO2(g)的K=K1(第一步反应的平衡常数)×K2(第二步反应的平衡常数)B.第一步反应的活化能E1大于第二步反应的活化能E2
C.第二步中的N2O2和O2的碰撞只部分有效
D. 2NO(g)+O2(g)
 2NO2(g)的△S<0,该反应能自发进行,说明一定是放热反应
2NO2(g)的△S<0,该反应能自发进行,说明一定是放热反应II.目前汽车尾气中的NO处理有以下几种方法:
(1)①已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol,C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=②某兴趣小组对某汽车冷启动时的尾气催化处理过程中CO、NO百分含量随时间变化加以分析,结果如图1所示,前0-10s阶段CO、NO百分含量没明显变化的原因是

③某温度℃下,向2L密闭容器中充入一定量NO和CO,在

 时刻达到平衡状态,此时n(CO)=1mol,n(NO)=2mol,n(N2)=2mol,在该温度下平衡常数K=
时刻达到平衡状态,此时n(CO)=1mol,n(NO)=2mol,n(N2)=2mol,在该温度下平衡常数K= 时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下,
时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下, 时刻达到新的平衡状态,则请在下图中补充画出
时刻达到新的平衡状态,则请在下图中补充画出 时段N2物质的量浓度的变化趋势曲线。
时段N2物质的量浓度的变化趋势曲线。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度十倍),装置如右图所示,固体电解质可传导O2-。

①阴极的电极反应式为
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)已知反应CO(g)+2H2(g) CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
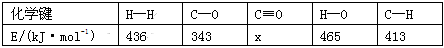
则x=______________________ 。
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g) HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
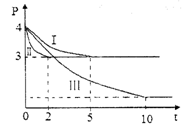
①Ⅱ和Ⅰ相比,改变的反应条件是____________________ 。
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时速率v(HCOOCH3)=__________ 。
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) =__________ 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正)_____ v(逆)(填“﹥”“﹤”“﹦”),原因是_________________ 。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1______ T3(填“﹥”“﹤”“﹦”),判断的理由是________________ 。
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
2NO+2CO N2+ 2CO2(有CO) 2NO
N2+ 2CO2(有CO) 2NO N2+ O2(无CO)
N2+ O2(无CO)
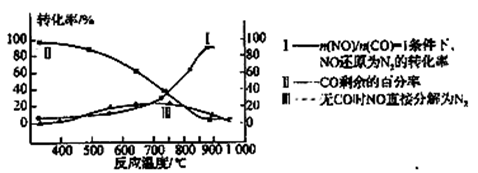
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____________________ 。
②在n(NO)/n(CO)=1的条件下,应控制的最佳温度在___ 左右.
A.670K B.770K C.870K D.970K.
(1)已知反应CO(g)+2H2(g)
 CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
则x=
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g)
 HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
①Ⅱ和Ⅰ相比,改变的反应条件是
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时速率v(HCOOCH3)=
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) =
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
2NO+2CO
 N2+ 2CO2(有CO) 2NO
N2+ 2CO2(有CO) 2NO N2+ O2(无CO)
N2+ O2(无CO)
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为
②在n(NO)/n(CO)=1的条件下,应控制的最佳温度在
A.670K B.770K C.870K D.970K.
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化-碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、浯化能数据如下:
反应I: NO(g)+O3(g) ⇌NO2(g)+ O2(g) △H1=-200.9kJ/mol' Ea1=3.2 kJ/mol.
反应Ⅱ:SO2(g))+ O3(g)⇌SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2= 58 kJ/mol
已知该体系中温度80℃以上臭氧发生分解反应:2O3(g) ⇌3O2(g) 请回答:
(1)已知反应I在低温下自发进行,则该反应的熵变△S___________ 0(填“大于”或“小于”)。
(2)其它条件不变,每次向反应器中充入含1.0 mol NO、10 mol SO2的模拟烟气和2.0 molO3,改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:
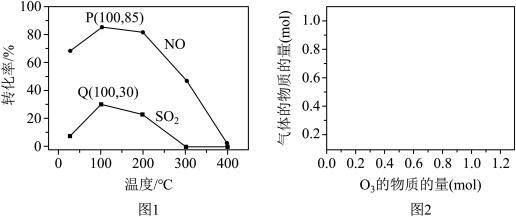
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_________ 。
②100℃、反应相同时间t时O3的分解率达10%,则体系中剩余O3的物质的量是______ mol。
③下列说法正确的是_______ 。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
(3)150℃条件下,向反应器中充入含1molNO、1molSO2的模拟烟气,在图2中分别画出NO和SO2的物质的量随O3量的变化曲线。________
(4)工业上可以通过电解NO制备NH4NO3,原理如图3所示。写出电解过程阳极的电极反应式_______ 。
反应I: NO(g)+O3(g) ⇌NO2(g)+ O2(g) △H1=-200.9kJ/mol' Ea1=3.2 kJ/mol.
反应Ⅱ:SO2(g))+ O3(g)⇌SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2= 58 kJ/mol
已知该体系中温度80℃以上臭氧发生分解反应:2O3(g) ⇌3O2(g) 请回答:
(1)已知反应I在低温下自发进行,则该反应的熵变△S
(2)其它条件不变,每次向反应器中充入含1.0 mol NO、10 mol SO2的模拟烟气和2.0 molO3,改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:

①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因
②100℃、反应相同时间t时O3的分解率达10%,则体系中剩余O3的物质的量是
③下列说法正确的是
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
(3)150℃条件下,向反应器中充入含1molNO、1molSO2的模拟烟气,在图2中分别画出NO和SO2的物质的量随O3量的变化曲线。
(4)工业上可以通过电解NO制备NH4NO3,原理如图3所示。写出电解过程阳极的电极反应式

您最近半年使用:0次



