A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
(1)BF2的结构式为____________ 。
(2)D和F的氢化物中沸点较高的是______________ (填化学式)。
(3)实验室制取G2气体的离子方程式为_____________________________________________ 。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_________________________________________________________ 。
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为__________________________________________________________ 。
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为__________________________________________________________ 。
(7)上述元素可组成盐Q:CA4E(FD4)2。向盛有20 mL 0.5 mol/L Q溶液的烧杯中加入12 mL 2.0 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ 。
| B | ||
| F |
(2)D和F的氢化物中沸点较高的是
(3)实验室制取G2气体的离子方程式为
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为
(7)上述元素可组成盐Q:CA4E(FD4)2。向盛有20 mL 0.5 mol/L Q溶液的烧杯中加入12 mL 2.0 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
15-16高三上·重庆·阶段练习 查看更多[4]
(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(押题专练)湖北省襄阳市第四中学2017-2018学年高一3月月考化学试题(已下线)二轮复习 专题7 物质结构与元素周期律 押题专练2016届重庆市巴蜀中学高三上一诊模拟理综化学试卷
更新时间:2016-12-09 10:29:09
|
相似题推荐
【推荐1】I.在容器为1L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图1所示。回答下列问题:
2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图1所示。回答下列问题:
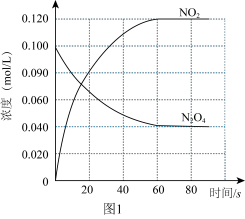
(1)100℃时,在0~60s时段,反应速率v(N2O4)为______ mol/(L·s),反应的平衡常数K为_______ 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol/(L·s)平均速率降低,经10s又达到平衡.T_____ 100℃(填“大于”或“小于”),判断理由是_________ 。
Ⅱ.利用LiOH和钴氧化物可制备锂离子电池。正极材料LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
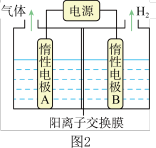
(1)利用如图2所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为_____ 溶液(填化学式),阳极电极反应式为__________________ 。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钻氧化物的艺流程如图3:
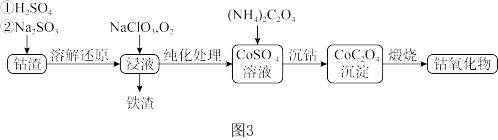
Co(OH)3在酸溶并发生氧化还原反应时的离子方程式为______________________ 。在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体的质量为2.73g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_____________ 。
 2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图1所示。回答下列问题:
2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图1所示。回答下列问题:
(1)100℃时,在0~60s时段,反应速率v(N2O4)为
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol/(L·s)平均速率降低,经10s又达到平衡.T
Ⅱ.利用LiOH和钴氧化物可制备锂离子电池。正极材料LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图2所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为

(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钻氧化物的艺流程如图3:

Co(OH)3在酸溶并发生氧化还原反应时的离子方程式为
您最近一年使用:0次
【推荐2】某易溶于水的无色晶体X由四种短周期元素组成,阴、阳离子数之比为1∶2.在一定条件可发生如下转化(所加试剂均足量)
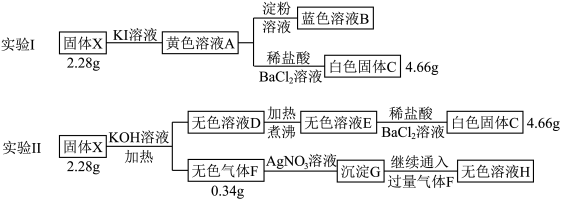
(1)组成X的四种元素为___________ ;X的化学式为___________ 。
(2)无色溶液H中所含的阳离子为___________ (用化学式表示)。
(3)写出由固体X到黄色溶液A的化学方程式___________ 。
(4)固体X可与 溶液反应得到紫色溶液,写出反应的离子方程式
溶液反应得到紫色溶液,写出反应的离子方程式___________ 。
(5)请设计实验,检验黄色溶液A中的阳离子( 除外)
除外)___________ 。

(1)组成X的四种元素为
(2)无色溶液H中所含的阳离子为
(3)写出由固体X到黄色溶液A的化学方程式
(4)固体X可与
 溶液反应得到紫色溶液,写出反应的离子方程式
溶液反应得到紫色溶液,写出反应的离子方程式(5)请设计实验,检验黄色溶液A中的阳离子(
 除外)
除外)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】草酸钻可用于指示剂和催化剂。工业上用水钻矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 的工艺流程如图所示:
的工艺流程如图所示:
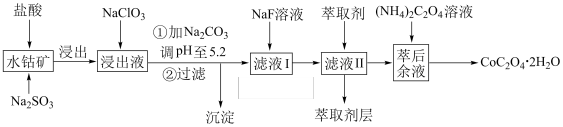
已知:①浸出液含有的阳离子主要有 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;
②酸性条件下, 不会氧化
不会氧化 ,
, 转化为
转化为 ;
;
③部分阳离子的氢氧化物沉淀时溶液的pH如下表:
(1)浸出过程中加入 的主要目的是
的主要目的是_______ , 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)向浸出液中加入 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)“加 调pH至5.2”,过滤所得沉淀的成分为
调pH至5.2”,过滤所得沉淀的成分为_______ (填化学式)。
(4)向滤液Ⅰ中加入NaF溶液得到沉淀的主要成分是_______ (填化学式)。
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜pH范围是_______ (填字母)。
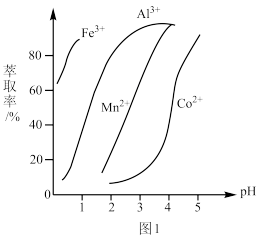
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(6) (
( )热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后在空气中加热。A、B、C均为纯净物。
)热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后在空气中加热。A、B、C均为纯净物。
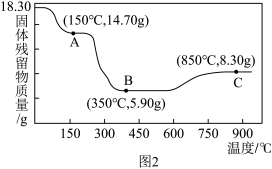
①用化学方程式表示A点到B点的物质变化_______ 。
②C点所示产物的化学式是_______ 。
 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 的工艺流程如图所示:
的工艺流程如图所示:
已知:①浸出液含有的阳离子主要有
 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;②酸性条件下,
 不会氧化
不会氧化 ,
,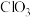 转化为
转化为 ;
;③部分阳离子的氢氧化物沉淀时溶液的pH如下表:
| 沉淀物 |  |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
 的主要目的是
的主要目的是 发生反应的离子方程式为
发生反应的离子方程式为(2)向浸出液中加入
 发生反应的离子方程式为
发生反应的离子方程式为(3)“加
 调pH至5.2”,过滤所得沉淀的成分为
调pH至5.2”,过滤所得沉淀的成分为(4)向滤液Ⅰ中加入NaF溶液得到沉淀的主要成分是
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜pH范围是

a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(6)
 (
(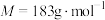 )热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后在空气中加热。A、B、C均为纯净物。
)热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后在空气中加热。A、B、C均为纯净物。
①用化学方程式表示A点到B点的物质变化
②C点所示产物的化学式是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】Ⅰ.硫元素在人类生命活动以及生产生活中均发挥了重要作用,常见的硫磺皂、二硫化硒洗发水、葡萄酒中都有硫元素的身影。人类对硫元素的探索也在历史上留下了浓墨重彩的一笔,例如黑火药的发明、“绿矾油”的提炼……
(1)硫磺皂的主要成分是脂肪酸钠、硫单质,硫磺皂是最便宜的除螨杀菌药皂。请猜测硫磺皂的颜色___________ ,写出硫离子的电子式___________ 。
(2)下列各反应中,能证明氯气的氧化性比硫的氧化性强的反应是________
①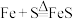

②
③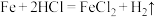
 跟浓
跟浓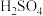 常温下发生钝化
常温下发生钝化
(3)在酿酒时人工添加 有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入
有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入 ,请用化学方程式表示该反应机理
,请用化学方程式表示该反应机理___________ 。
(4)发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总 小于
小于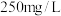 ,若在室温下,每升溶液中最多通入
,若在室温下,每升溶液中最多通入___________  。(室温下
。(室温下 )
)
(5)向 溶液中通入
溶液中通入 至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是_________
至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是_________
(6)在古代中国,稀硫酸被称为“绿矾油”。关于浓硫酸和稀硫酸的说法,错误的是_______
(7)常温下,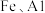 在浓硫酸中钝化,浓硫酸表现了______
在浓硫酸中钝化,浓硫酸表现了______
Ⅱ.某校化学兴趣小组同学取锌粒与浓 充分反应制取
充分反应制取 气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。
气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。
为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究。
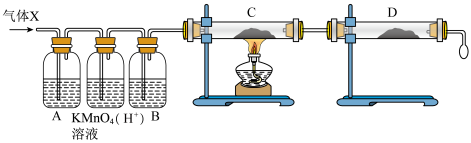
(8)杂质气体可能是___________ ,酸性 溶液的作用
溶液的作用___________ ;B中添加的试剂是___________ 。
(9)装置C中所装药品为___________ ,D中所装药品为___________ ,可证实气体X中混有较多量某杂质气体的实验现象是___________ 。
(1)硫磺皂的主要成分是脂肪酸钠、硫单质,硫磺皂是最便宜的除螨杀菌药皂。请猜测硫磺皂的颜色
(2)下列各反应中,能证明氯气的氧化性比硫的氧化性强的反应是________
①
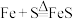

②

③
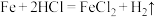
 跟浓
跟浓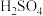 常温下发生钝化
常温下发生钝化| A.只有① | B.只有② | C.①② | D.①②③ |
(3)在酿酒时人工添加
 有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入
有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入 ,请用化学方程式表示该反应机理
,请用化学方程式表示该反应机理(4)发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总
 小于
小于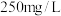 ,若在室温下,每升溶液中最多通入
,若在室温下,每升溶液中最多通入 。(室温下
。(室温下 )
)(5)向
 溶液中通入
溶液中通入 至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是_________
至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是_________A. | B. | C. | D. |
(6)在古代中国,稀硫酸被称为“绿矾油”。关于浓硫酸和稀硫酸的说法,错误的是_______
A.都有 分子 分子 | B.都有氧化性 |
| C.都能和铁、铝反应 | D.密度都比水大 |
(7)常温下,
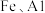 在浓硫酸中钝化,浓硫酸表现了______
在浓硫酸中钝化,浓硫酸表现了______| A.难挥发性 | B.吸水性 | C.脱水性 | D.强氧化性 |
Ⅱ.某校化学兴趣小组同学取锌粒与浓
 充分反应制取
充分反应制取 气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。
气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究。

(8)杂质气体可能是
 溶液的作用
溶液的作用(9)装置C中所装药品为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】低浓度SO2废气的处理是工业难题,工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
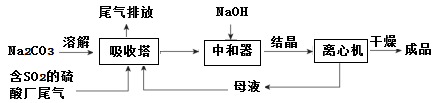
(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合
理措施______________ 、_______________ 。(写出两条)
(2)中和器中发生的主要反应的离子方程式是_____________________ 。
(3)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。
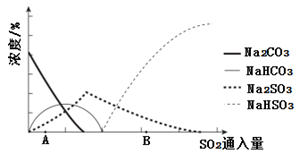
①则初期反应(图中A点以前)的化学方程式是__________________ 。
②通过电解法可分离图中B点NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如下:
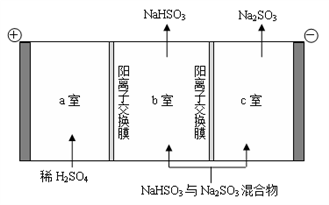
简述分离NaHSO3与Na2SO3混合物的原理___________________ 。
(4)下图是亚硫酸钠的溶解度曲线(温度在33℃前后对应不同物质),下列说法正确的是______
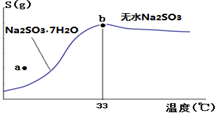
A.a点时溶液为不饱和溶液
B.b点时Na2SO3·7H2O和无水Na2SO3共存
C.制备无水Na2SO3,应该在95~100℃加热浓缩,冷却至室温结晶
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是__________
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4

(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合
理措施
(2)中和器中发生的主要反应的离子方程式是
(3)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。

①则初期反应(图中A点以前)的化学方程式是
②通过电解法可分离图中B点NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如下:

简述分离NaHSO3与Na2SO3混合物的原理
(4)下图是亚硫酸钠的溶解度曲线(温度在33℃前后对应不同物质),下列说法正确的是

A.a点时溶液为不饱和溶液
B.b点时Na2SO3·7H2O和无水Na2SO3共存
C.制备无水Na2SO3,应该在95~100℃加热浓缩,冷却至室温结晶
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2 等)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:
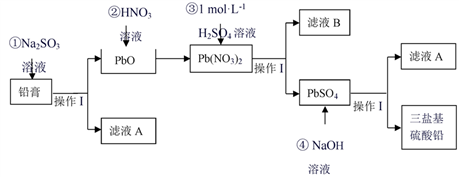
(1)铅膏中加入Na2SO3溶液所发生的离子方程式_____________ 。
(2)操作I的名称__________ 。用18.4 mol • L-1H2SO4 配制100 mL1 mol • L-1H2SO4溶液需要用到的仪器有量筒、烧杯、玻璃棒、胶头滴管、__________ 。
(3)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有蒸发浓缩、______ 、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是__________ 。
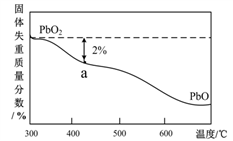
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重2.0% ( ×100%)的残留固体,若a点固体表示为PbOx或mPbO • nPbO2,
×100%)的残留固体,若a点固体表示为PbOx或mPbO • nPbO2,
列式计算x值_________ 和m:n值__________ 。

(1)铅膏中加入Na2SO3溶液所发生的离子方程式
(2)操作I的名称
(3)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有蒸发浓缩、
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重2.0% (
 ×100%)的残留固体,若a点固体表示为PbOx或mPbO • nPbO2,
×100%)的残留固体,若a点固体表示为PbOx或mPbO • nPbO2,列式计算x值

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应。
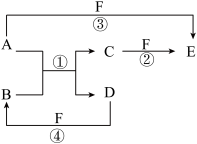
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是___ 。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是___ 。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则C的电子式是___ ,反应③的化学方程式是___ 。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,B的结构式是___ ,反应④的化学方程式是___ 。

(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则C的电子式是
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,B的结构式是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐2】W、X、Y、Z是原子序数依次增大的四种短周期元素。W的气态氢化物能使紫色石蕊溶液变蓝,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,W、X、Y、Z的最外层电子数之和为16。
(1)W单质的电子式是____________ 。
(2)请用化学用语解释W的气态氢化物能使紫色石蕊溶液变蓝的原因:________________ 。
(3)已知As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是_______________ 。
(4)W的最高价氧化物的水化物与Y的氢氧化物发生反应的离子方程式是___________________ 。
(5)X与Z的单质之间发生反应的化学方程式是________________ 。
(6)已知Q与Z是位于相邻周期的同主族元素。某温度下,两种元素的气态单质与H2发生化合反应生成气态氢化物的平衡常数分别为KQ= 5.6×107,KZ = 9.7×1012。Q的元素符号是__________ ,理由是____________ 。
(1)W单质的电子式是
(2)请用化学用语解释W的气态氢化物能使紫色石蕊溶液变蓝的原因:
(3)已知As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是
(4)W的最高价氧化物的水化物与Y的氢氧化物发生反应的离子方程式是
(5)X与Z的单质之间发生反应的化学方程式是
(6)已知Q与Z是位于相邻周期的同主族元素。某温度下,两种元素的气态单质与H2发生化合反应生成气态氢化物的平衡常数分别为KQ= 5.6×107,KZ = 9.7×1012。Q的元素符号是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。
(1)D的原子结构示意图为_______ ,丙的电子式为_______ ,E在周期表中的位置为_______ 。
(2)下列说法正确的有_______
① 化合物乙为正四面体形分子,是由极性键构成的非极性分子
② C、D、E、F原子半径由大到小的顺序为 C> D >E> F
③ B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④ 化合物甲和化合物丙都含有离子键和共价键
(3)已知通常状况下1g F在空气中完全燃烧放出a kJ的热量,请写出表示F燃烧热的热化学方程式_______ 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应_______ 。
(4)写出一个由以上元素构成的10e-微粒与18e-微粒反应的离子方程式:_______ 。
(1)D的原子结构示意图为
(2)下列说法正确的有
① 化合物乙为正四面体形分子,是由极性键构成的非极性分子
② C、D、E、F原子半径由大到小的顺序为 C> D >E> F
③ B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④ 化合物甲和化合物丙都含有离子键和共价键
(3)已知通常状况下1g F在空气中完全燃烧放出a kJ的热量,请写出表示F燃烧热的热化学方程式
(4)写出一个由以上元素构成的10e-微粒与18e-微粒反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】A、B、C、D、E五种元素均为短周期元素,其原子序数依次增大。A元素原子的核外电子数、电子层数和最外层电子 数均相等;B、C、D、E四种元素在元素周期表中的相对位置如图I如示。另有甲、乙、M、W、X、Y、Z七种物质均由A、C、D 三种元素中的若干种组成(只有M中同时含有三种元素),其中甲、乙为非金属单质,W由A和C组成,分子中含有18个电子,X分子中含有10个电子,它们之间的相互转化关系如图Ⅱ所示。请回答下列问题:
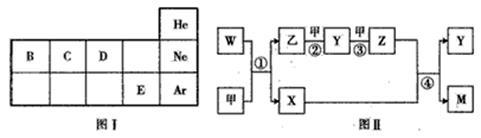
(1)用电子式表示乙的形成过程_______________ ,Y的分子式为__________ ,W的结构式为___________ 。
(2)反应④的化学方程式为_________________________ 。
(3)工业上常用浓氨水检查E2的管道是否泄漏,反应的方程式为______________ 。
(4)W—空气燃料电池是一种碱性燃料电池,电解质溶液是20%——30%的KOH溶液。该燃料电池的负极反应式为_______________________ 。

(1)用电子式表示乙的形成过程
(2)反应④的化学方程式为
(3)工业上常用浓氨水检查E2的管道是否泄漏,反应的方程式为
(4)W—空气燃料电池是一种碱性燃料电池,电解质溶液是20%——30%的KOH溶液。该燃料电池的负极反应式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐2】A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构。
(1)试判断A、B、C、D四种元素的名称。A__________ ,B__________ ,C__________ ,D__________ 。
(2)由B、D两种元素组成的D2B2型化合物的电子式为______________ ,CB2的电子式为_______________ 。
(3)如右图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到_____________ ,原因是_________________ 。
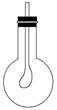
(1)试判断A、B、C、D四种元素的名称。A
(2)由B、D两种元素组成的D2B2型化合物的电子式为
(3)如右图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
真题
【推荐3】甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙丁戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。
请回答下列问题
(1)戊离子的结构示意图为_______ 。
(2)写出乙的单质的电子式:_______ 。
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2 :4,反应中被氧化的物质与被还原的物质的物质的量之比为________ 。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:_________ 。
(5)按右图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:_______ 。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是__________ 。

请回答下列问题
(1)戊离子的结构示意图为
(2)写出乙的单质的电子式:
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2 :4,反应中被氧化的物质与被还原的物质的物质的量之比为
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:
(5)按右图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:

您最近一年使用:0次



