名校
1 . 氧、硫、硒( )、碲(
)、碲( )、钋(
)、钋(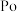 )是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
)是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
(1) 在周期表中的位置为
在周期表中的位置为_______ 。
(2)某温度时,该族单质与 反应生成气态
反应生成气态 的热化学方程式如下:
的热化学方程式如下:
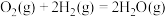

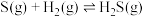


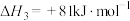
①硫和硒的氢化物的热稳定性:H2S_____ H2Se (填>、=或<);用原子结构知识解释你的判断结果_______ 。
②写出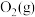 与
与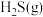 反应生成
反应生成 和
和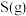 的热化学方程式
的热化学方程式_______ 。
(3)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。

①步骤I反应的离子方程式为_______ 。
②生物浸出时的总反应的氧化剂是_______ 。
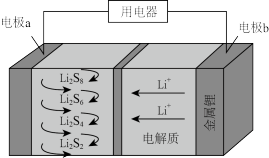
(4)全固态锂硫电池能量密度高,其工作原理如图所示,其中电极 常用掺有石墨烯的
常用掺有石墨烯的 材料,电池反应为:
材料,电池反应为: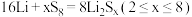 。下列说法
。下列说法错误 的是_______
 )、碲(
)、碲( )、钋(
)、钋( )是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
)是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:(1)
 在周期表中的位置为
在周期表中的位置为(2)某温度时,该族单质与
 反应生成气态
反应生成气态 的热化学方程式如下:
的热化学方程式如下: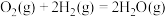

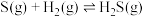


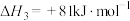
①硫和硒的氢化物的热稳定性:H2S
②写出
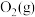 与
与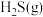 反应生成
反应生成 和
和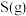 的热化学方程式
的热化学方程式(3)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。

①步骤I反应的离子方程式为
②生物浸出时的总反应的氧化剂是
(4)全固态锂硫电池能量密度高,其工作原理如图所示,其中电极
 常用掺有石墨烯的
常用掺有石墨烯的 材料,电池反应为:
材料,电池反应为: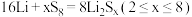 。下列说法
。下列说法
A.电池工作时,正极可发生反应: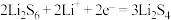 |
B.电池工作时,外电路中流过 电子,负极材料减重 电子,负极材料减重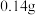 |
C.石墨烯的作用主要是提高电极 的导电性 的导电性 |
D.电池充电时间越长,电池中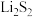 的量越多 的量越多 |
您最近一年使用:0次
2022-07-05更新
|
130次组卷
|
2卷引用:北京市第十二中学2021-2022学年高一下学期6月月考化学试题
名校
解题方法
2 .  分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用
分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用 作为碳源,通过
作为碳源,通过 催化加氢方式,不仅可以减少温室气体的排放,还可以将
催化加氢方式,不仅可以减少温室气体的排放,还可以将 转化为高附加值的化学产品,具有重要的战略意义。
转化为高附加值的化学产品,具有重要的战略意义。
(1) 的结构与
的结构与 相似,写出
相似,写出 的电子式
的电子式_______ 。
(2)一种 直接加氢的反应机理如图a所示。
直接加氢的反应机理如图a所示。

①写出总反应的化学方程式_______ 。
②a、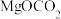 也可以写成
也可以写成 (难溶),写出
(难溶),写出 溶于乙酸的离子方程式
溶于乙酸的离子方程式_______ ;
b、 比
比 更难溶,加热
更难溶,加热 的水溶液可以生成
的水溶液可以生成 ,写出反应的化学方程式
,写出反应的化学方程式_______ 。
(3)①已知:主反应 催化加氢制甲醇是放热反应
催化加氢制甲醇是放热反应

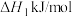

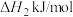
写出 催化加氢制甲醇的热化学方程式
催化加氢制甲醇的热化学方程式_______ ( 用含
用含 和
和 的代数式表示)。
的代数式表示)。
②已知
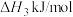 ,则
,则
_______  (填>、<或=)。
(填>、<或=)。
③我国科学家设计了离子液体电还原 合成
合成 工艺,写出碱性条件下
工艺,写出碱性条件下 生成甲醇的电极反应式
生成甲醇的电极反应式_______ 。
 分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用
分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用 作为碳源,通过
作为碳源,通过 催化加氢方式,不仅可以减少温室气体的排放,还可以将
催化加氢方式,不仅可以减少温室气体的排放,还可以将 转化为高附加值的化学产品,具有重要的战略意义。
转化为高附加值的化学产品,具有重要的战略意义。(1)
 的结构与
的结构与 相似,写出
相似,写出 的电子式
的电子式(2)一种
 直接加氢的反应机理如图a所示。
直接加氢的反应机理如图a所示。
①写出总反应的化学方程式
②a、
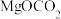 也可以写成
也可以写成 (难溶),写出
(难溶),写出 溶于乙酸的离子方程式
溶于乙酸的离子方程式b、
 比
比 更难溶,加热
更难溶,加热 的水溶液可以生成
的水溶液可以生成 ,写出反应的化学方程式
,写出反应的化学方程式(3)①已知:主反应
 催化加氢制甲醇是放热反应
催化加氢制甲醇是放热反应
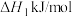

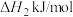
写出
 催化加氢制甲醇的热化学方程式
催化加氢制甲醇的热化学方程式 用含
用含 和
和 的代数式表示)。
的代数式表示)。②已知

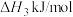 ,则
,则
 (填>、<或=)。
(填>、<或=)。③我国科学家设计了离子液体电还原
 合成
合成 工艺,写出碱性条件下
工艺,写出碱性条件下 生成甲醇的电极反应式
生成甲醇的电极反应式
您最近一年使用:0次
2022-06-19更新
|
146次组卷
|
2卷引用:北京市第十二中学2021-2022学年高一下学期6月月考化学试题
3 . NSR(NO2的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中NO2的排放,其工作原理如图。

(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ·mol-1
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g) △H3=____ 。
(2)①存储阶段:Ba存储NO2后转化为Ba(NO3)2的化学方程式是____ 。
②还原阶段:NO2从Ba(NO3)2中释放,然后在Pt的表面被CO、H2还原为N2。若参加反应的n(CO)=n(H2),则反应的n(CO):n(H2):n(NO2)=____ 。
(3)某实验小组模拟NSR系统中的一个存储、还原过程。让尾气通过NSR反应器,测得过程中出口NO2浓度变化如图。

①t1时刻前,NO2的浓度接近0,原因是____ 。
②t2时刻,切换至贫氧条件,NO2的浓度急剧上升又快速下降的原因是____ 。

(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ·mol-1
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g) △H3=
(2)①存储阶段:Ba存储NO2后转化为Ba(NO3)2的化学方程式是
②还原阶段:NO2从Ba(NO3)2中释放,然后在Pt的表面被CO、H2还原为N2。若参加反应的n(CO)=n(H2),则反应的n(CO):n(H2):n(NO2)=
(3)某实验小组模拟NSR系统中的一个存储、还原过程。让尾气通过NSR反应器,测得过程中出口NO2浓度变化如图。

①t1时刻前,NO2的浓度接近0,原因是
②t2时刻,切换至贫氧条件,NO2的浓度急剧上升又快速下降的原因是
您最近一年使用:0次
2022-06-13更新
|
302次组卷
|
3卷引用:北京市西城区2021届高三一模化学试题
名校
解题方法
4 . Ⅰ.红磷(P)和 可发生反应生成
可发生反应生成 和
和 ,反应中的能量关系如图所示。
,反应中的能量关系如图所示。

(1)写出P(s)和 (g)转化为
(g)转化为 (g)总反应的热化学方程式
(g)总反应的热化学方程式___________ 。
(2)一定条件下,在2L恒温恒容的密闭容器中充入0.1mol 发生反应
发生反应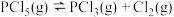 。
。
①下列说法可以判定该反应达到平衡状态的是___________ 。
a.容器内的压强保持不变
b.容器内的混合气体密度保持不变
c. 保持不变
保持不变
d.混合气体的平均相对分子质量保持不变
②若该反应达到平衡时Cl2的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为___________ 。
Ⅱ.氢能源汽车通过燃料电池提供动力。一种燃料电池的结构如图所示。

(3)该电池正极是___________ (填“a”或“b”),电极反应式___________ 。
(4)另一极的电极反应式是___________ 。
 可发生反应生成
可发生反应生成 和
和 ,反应中的能量关系如图所示。
,反应中的能量关系如图所示。
(1)写出P(s)和
 (g)转化为
(g)转化为 (g)总反应的热化学方程式
(g)总反应的热化学方程式(2)一定条件下,在2L恒温恒容的密闭容器中充入0.1mol
 发生反应
发生反应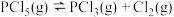 。
。①下列说法可以判定该反应达到平衡状态的是
a.容器内的压强保持不变
b.容器内的混合气体密度保持不变
c.
 保持不变
保持不变d.混合气体的平均相对分子质量保持不变
②若该反应达到平衡时Cl2的体积分数为
 ,则
,则 的平衡转化率为
的平衡转化率为Ⅱ.氢能源汽车通过燃料电池提供动力。一种燃料电池的结构如图所示。

(3)该电池正极是
(4)另一极的电极反应式是
您最近一年使用:0次
名校
解题方法
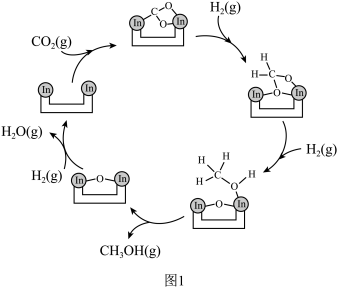
5 . 实现二氧化碳选择性、稳定性加氢合成甲醇是“甲醇经济”理念下的一个重要成果。由CO2和H2合成CH3OH的反应过程如下:
I.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+40.9kJ·mol-1
CO(g)+H2O(g) △H1=+40.9kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1
回答下列问题:
(1)如图是一种特定条件下反应I机理中的第一步变化,则碳原子的杂化类型从____ 变为___ 。
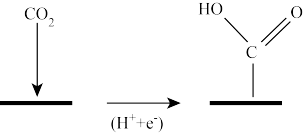
(2)写出由CO2和H2合成CH3OH的热化学方程式为____ 。
(3)恒压条件下,按n(CO2):n(H2)=1:3投料时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出H2O)
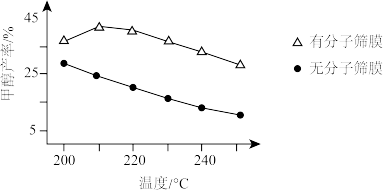
①根据图中数据,恒压条件下采用有分子筛膜时的最佳反应温度为____ ℃。
②有分子筛膜时甲醇产率高的原因是____ 。
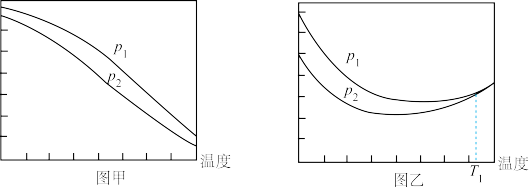
(4)不同压强下,依然按n(CO2):n(H2)=1:3投料,测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
已知:CO2的平衡转化率=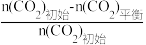 ×100%
×100%
CH3OH的平衡产率= ×100%
×100%
①压强:p1____ p2(填“>”“=”或“<”),判断依据是____ 。
②纵坐标表示CO2平衡转化率的是图____ (填“甲”或“乙”)。
③图乙中T1温度时,两条曲线几乎交于一点的原因是____ 。
I.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+40.9kJ·mol-1
CO(g)+H2O(g) △H1=+40.9kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1回答下列问题:
(1)如图是一种特定条件下反应I机理中的第一步变化,则碳原子的杂化类型从

(2)写出由CO2和H2合成CH3OH的热化学方程式为
(3)恒压条件下,按n(CO2):n(H2)=1:3投料时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出H2O)

①根据图中数据,恒压条件下采用有分子筛膜时的最佳反应温度为
②有分子筛膜时甲醇产率高的原因是
(4)不同压强下,依然按n(CO2):n(H2)=1:3投料,测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。

已知:CO2的平衡转化率=
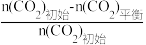 ×100%
×100%CH3OH的平衡产率=
 ×100%
×100%①压强:p1
②纵坐标表示CO2平衡转化率的是图
③图乙中T1温度时,两条曲线几乎交于一点的原因是
您最近一年使用:0次
2022·内蒙古赤峰·模拟预测
解题方法
6 . 已知:2H2O(l)=2H2(g)+O2(g) △H=+571.0kJ·mol-1,两步热循环制H2的过程如图,第一步以太阳能为热源分解Fe3O4,第二步FeO水解获得H2。
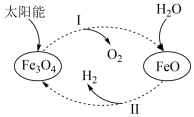
过程I:2Fe3O4(s)=6FeO(s)+O2(g) △HI=+604.8kJ·mol-1
过程II:H2O(l)+3FeO(s)=Fe3O4(s)+H2(g) △HII
下列说法正确的是

过程I:2Fe3O4(s)=6FeO(s)+O2(g) △HI=+604.8kJ·mol-1
过程II:H2O(l)+3FeO(s)=Fe3O4(s)+H2(g) △HII
下列说法正确的是
| A.根据盖斯定律△HI+△HII=0 |
| B.过程I中每生成3molFeO,转移1mol电子 |
| C.过程II在任何温度下均为自发反应 |
| D.整个过程中能量转化形式只存在太阳能转化为化学能 |
您最近一年使用:0次
7 . 一定条件下,二氧化碳可合成低碳烯烃,缓解温室效应、充分利用碳资源。
(1)已知:
①

②

③

④
则
_______ (用 、
、 、
、 表示)。
表示)。
(2)反应④的反应温度、投料比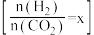 对
对 平衡转化率的影响如图所示。
平衡转化率的影响如图所示。

①a_______ 3(填“>”、“<”或“=”);M、N两点反应的平衡常数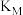
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②300℃,往6L反应容器中加入 、
、 ,反应10min达到平衡。求0到10min氢气的平均反应速率为
,反应10min达到平衡。求0到10min氢气的平均反应速率为_______ 。
(3)中科院兰州化学物理研究所用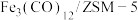 催化
催化 加氢合成低碳烯烃反应,所得产物含
加氢合成低碳烯烃反应,所得产物含 、
、 、
、 等副产物,反应过程如图。
等副产物,反应过程如图。
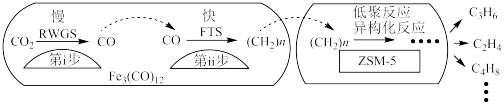
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得 转化率和各产物的物质的量分数如下表。
转化率和各产物的物质的量分数如下表。
①欲提高单位时间内乙烯的产量,在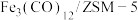 中添加
中添加_______ 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_______ ;
②下列说法正确的是_______ ;
a.第ⅰ步所反应为:
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.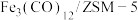 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小
e.添加不同助剂后,反应的平衡常数各不相同
(4)2018年,强碱性电催化还原 制乙烯研究取得突破进展,原理如图所示。
制乙烯研究取得突破进展,原理如图所示。

①b极接的是太阳能电池的_______ 极;
②已知PTFE浸泡了饱和KCl溶液,请写出阴极的电极反应式_______ 。
(1)已知:
①


②


③


④

则

 、
、 、
、 表示)。
表示)。(2)反应④的反应温度、投料比
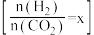 对
对 平衡转化率的影响如图所示。
平衡转化率的影响如图所示。
①a
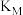
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②300℃,往6L反应容器中加入
 、
、 ,反应10min达到平衡。求0到10min氢气的平均反应速率为
,反应10min达到平衡。求0到10min氢气的平均反应速率为(3)中科院兰州化学物理研究所用
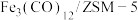 催化
催化 加氢合成低碳烯烃反应,所得产物含
加氢合成低碳烯烃反应,所得产物含 、
、 、
、 等副产物,反应过程如图。
等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得
 转化率和各产物的物质的量分数如下表。
转化率和各产物的物质的量分数如下表。| 助剂 |  转化率(%) 转化率(%) | 各产物在所有产物中的占比(%) | ||
 |  | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
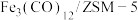 中添加
中添加②下列说法正确的是
a.第ⅰ步所反应为:

b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.
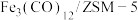 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小e.添加不同助剂后,反应的平衡常数各不相同
(4)2018年,强碱性电催化还原
 制乙烯研究取得突破进展,原理如图所示。
制乙烯研究取得突破进展,原理如图所示。
①b极接的是太阳能电池的
②已知PTFE浸泡了饱和KCl溶液,请写出阴极的电极反应式
您最近一年使用:0次
名校
解题方法
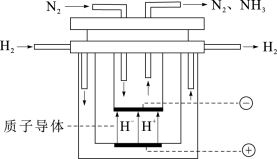
8 . 氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)①反应N2(g)+3H2(g) 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为_____ 。
②实验室检验氨气的方法是____ 。
(2)在一定条件下氨的平衡含量如表。
①该反应为_____ (填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是____ 。
(3)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。
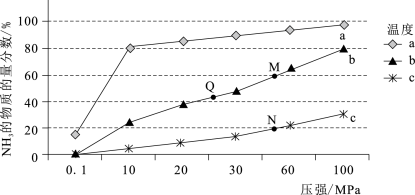
①曲线a对应的温度是____ 。
②M、N、Q点平衡常数K的大小关系是____ 。
(4)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为____ 。
(5)NH3转化为NO是工业制取硝酸的重要一步,已知:100kPa、298K时:
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1268kJ·mol-1
2N2(g)+6H2O(g) △H=-1268kJ·mol-1
2NO(g) N2(g)+O2(g) △H=-180.5kJ·mol-1
N2(g)+O2(g) △H=-180.5kJ·mol-1
请写出NH3转化为NO的热化学方程式____ 。
(1)①反应N2(g)+3H2(g)
 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为②实验室检验氨气的方法是
(2)在一定条件下氨的平衡含量如表。
| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
(3)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。

①曲线a对应的温度是
②M、N、Q点平衡常数K的大小关系是
(4)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为

(5)NH3转化为NO是工业制取硝酸的重要一步,已知:100kPa、298K时:
4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H=-1268kJ·mol-1
2N2(g)+6H2O(g) △H=-1268kJ·mol-12NO(g)
 N2(g)+O2(g) △H=-180.5kJ·mol-1
N2(g)+O2(g) △H=-180.5kJ·mol-1请写出NH3转化为NO的热化学方程式
您最近一年使用:0次
名校
9 .  资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
Ⅰ. 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:
ⅰ.催化剂活化: (无活性)
(无活性) (有活性)
(有活性)
ⅱ. 与
与 在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。同时伴随反应②:
在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。同时伴随反应②:
(1)反应①中每生成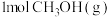 放热49.3kJ,写出其热化学方程式
放热49.3kJ,写出其热化学方程式_______ 。
(2) 与
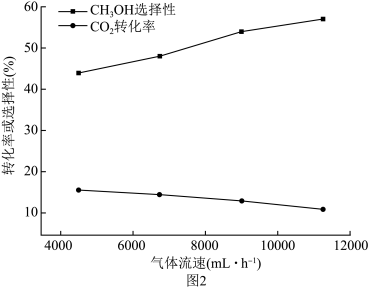
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。已知:
选择性的关系如图2。已知: 选择性=
选择性= ,
, 选择性随流速增大而升高的原因
选择性随流速增大而升高的原因_______ 。同时,流速加快可减少产物中 的积累,减少反应
的积累,减少反应_______ (用化学方程式表示)的发生,减少催化剂的失活,提高甲醇选择性。
(3)对于以上 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。
Ⅱ. 制汽油。我国科学家将
制汽油。我国科学家将 与另一催化剂HZSM联用,可将
与另一催化剂HZSM联用,可将 转化为汽油(以
转化为汽油(以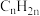 表示)。
表示)。
(4)将催化剂HZSM表面发生的反应补全:_______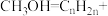 _______。
_______。_______
(5)其他条件不变,向原料气中添加不同量的CO,反应相同时间后,测得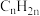 的产量随CO的增加有明显提升。
的产量随CO的增加有明显提升。
原因一: 增大,反应②平衡逆移,
增大,反应②平衡逆移, 、
、 增大,反应①平衡正移,
增大,反应①平衡正移, 增大,生成
增大,生成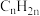 的速率加快。
的速率加快。
原因二:_______,反应①速率加快, 增大,生成
增大,生成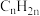 的速率加快。
的速率加快。
补全原因二_______
 资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。Ⅰ.
 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:ⅰ.催化剂活化:
 (无活性)
(无活性) (有活性)
(有活性)ⅱ.
 与
与 在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。同时伴随反应②:
在活化后的催化剂表面可逆的发生反应①,其反应历程如图1。同时伴随反应②: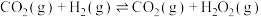
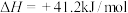

(1)反应①中每生成
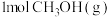 放热49.3kJ,写出其热化学方程式
放热49.3kJ,写出其热化学方程式(2)
 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。已知:
选择性的关系如图2。已知: 选择性=
选择性= ,
, 选择性随流速增大而升高的原因
选择性随流速增大而升高的原因 的积累,减少反应
的积累,减少反应
(3)对于以上
 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。| A.碳的杂化方式发生了改变 | B.反应中经历了In-C、In-O键的形成和断裂 |
C.加压可以提高 的平衡转化率 的平衡转化率 | D.升高温度可以提高甲醇在平衡时的选择性 |
Ⅱ.
 制汽油。我国科学家将
制汽油。我国科学家将 与另一催化剂HZSM联用,可将
与另一催化剂HZSM联用,可将 转化为汽油(以
转化为汽油(以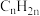 表示)。
表示)。(4)将催化剂HZSM表面发生的反应补全:_______
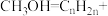 _______。
_______。(5)其他条件不变,向原料气中添加不同量的CO,反应相同时间后,测得
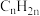 的产量随CO的增加有明显提升。
的产量随CO的增加有明显提升。原因一:
 增大,反应②平衡逆移,
增大,反应②平衡逆移, 、
、 增大,反应①平衡正移,
增大,反应①平衡正移, 增大,生成
增大,生成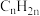 的速率加快。
的速率加快。原因二:_______,反应①速率加快,
 增大,生成
增大,生成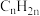 的速率加快。
的速率加快。补全原因二
您最近一年使用:0次
名校
10 . 水分子中存在氢键,氢键的形成赋予物质一些特殊的性质。
下列说法不正确 的是
 |  |
| 水分子中的氢键 | 冰晶体中的孔穴示意图 |
A.水分子间形成氢键,可彼此结合形成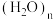 ,氢键可表示为O—H…O ,氢键可表示为O—H…O |
B.冰中的水分子之间最大限度地形成氢键,每个水分子的两个孤电子对和两个氢原子沿着 杂化轨道的方向彼此形成氢键,每1mol冰含有2mol氢键 杂化轨道的方向彼此形成氢键,每1mol冰含有2mol氢键 |
| C.根据冰的升华热为51kJ/mol,冰晶体中范德华力作用能为11 kJ/mol,可推知氢键的作用能为40 kJ/mol |
| D.羊毛纤维(含蛋白质)水洗后会变形,与氢键有关 |
您最近一年使用:0次



