1 . 我国科学家设计的化学链重整联合CO2捕集制H2系统如下图所示:
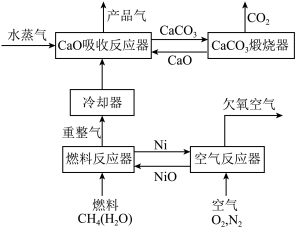
(1)空气反应器中发生___________ 反应(填“吸热”或“放热”)。
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有___________ 。
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =___________ 。
② 反应温度对H2产率(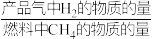 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
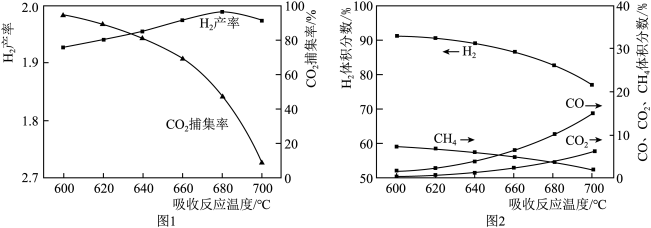
结合化学方程式说明图1中温度升高CO2捕集率降低的原因___________ ;解释图2中温度升高H2体积分数降低的原因___________ 。
(4)燃料反应器和吸收反应器中加入水蒸气的作用___________ 。

(1)空气反应器中发生
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =
② 反应温度对H2产率(
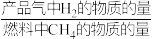 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
结合化学方程式说明图1中温度升高CO2捕集率降低的原因
(4)燃料反应器和吸收反应器中加入水蒸气的作用
您最近一年使用:0次
名校
解题方法
2 . 已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0 kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
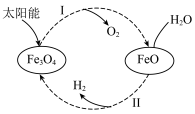
| A.过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子 |
| B.过程Ⅱ的热化学方程式为3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+128.9 kJ/mol |
| C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
| D.铁氧化合物循环制H2具有成本低、产物易分离等优点 |
您最近一年使用:0次
2023-09-19更新
|
359次组卷
|
25卷引用:【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题
【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题海南省海南中学2019-2020学年高二上学期期末考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题10-2020年北京新高考化学模拟试题(已下线)专题九 化学能与热能(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节综合训练高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 第二节综合训练河北省沧州市泊头市第一中学2020-2021学年高二上学期第一次月考化学试题山东省德州市夏津第一中学2020-2021学年高二上学期9月月考化学试题辽源市第五中学2019-2020学年高一下学期第二次月考化学试题湖南省中方一中2020-2021学年高二上学期期中考试化学试题河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研二化学试题河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题(已下线)模块七 化学反应与能量(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)贵州省黔西南州赛文高级中学 2021-2022学年高二上学期期中考试化学试题河北省沧州市泊头市第一中学2021-2022学年高二上学期第一次月考化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用(已下线)题型98 结合反应能量图示或物质循环图示书写热化学方程式山东省烟台市招远第一中学2022-2023学年高一下学期期中考试化学(等级考)试题(已下线)章末综合评价(六)河南省洛阳市宜阳县第一高级中学清北园2023-2024学年高一上学期第七次能力达标测试化学试卷
3 . CO2催化加氢制CH4的反应为: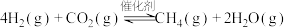 。催化剂上反应过程示意如图1所示。其他条件不变时,CO2的转化率和CH4的选择性(CO2转化为甲烷的量/ CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
。催化剂上反应过程示意如图1所示。其他条件不变时,CO2的转化率和CH4的选择性(CO2转化为甲烷的量/ CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
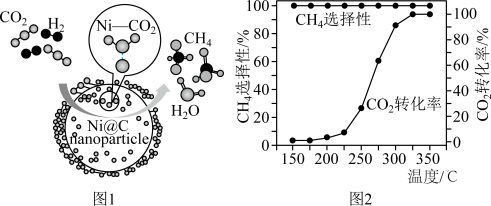
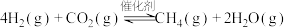 。催化剂上反应过程示意如图1所示。其他条件不变时,CO2的转化率和CH4的选择性(CO2转化为甲烷的量/ CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
。催化剂上反应过程示意如图1所示。其他条件不变时,CO2的转化率和CH4的选择性(CO2转化为甲烷的量/ CO2转化的总量)随温度变化如图2所示。下列说法不正确的是
A.催化剂改变了 中O—C—O键的键角 中O—C—O键的键角 |
| B.150℃到350℃时,基本没有发生副反应 |
C. 催化加氢制 催化加氢制 是一个吸热反应 是一个吸热反应 |
D.结合下列热化学方程式,可以通过盖斯定律计算 加氢制 加氢制 的反应热 的反应热 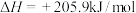 、 、  |
您最近一年使用:0次
2023-03-17更新
|
521次组卷
|
2卷引用:北京市石景山区2022-2023学年高三下学期质量监控(零模)化学试题
名校
解题方法
4 .  、
、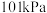 下,①
下,①
②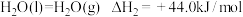
下列说法不正确 的是
 、
、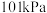 下,①
下,①
②
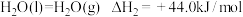
下列说法
| A.液态水变为水蒸气破坏的是分子间作用力 |
| B.水分解为氢气和氧气,断键吸收的总能量大于成键放出的总能量 |
C.标准状况下, 水中含共用电子对总数约为 水中含共用电子对总数约为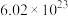 |
D. 、 、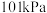 下, 下,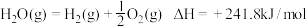 |
您最近一年使用:0次
2023-01-05更新
|
647次组卷
|
4卷引用:北京市石景山区2022-2023学年高三上学期期末考试化学试题
5 . CO2分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用CO2作为碳源,通过CO2催化加氢方式,不仅可以减少温室气体的排放,还可以将CO2转化为高附加值的化学产品,具有重要的战略意义。
(1)若活化CO2,通常需要采取适当的方式使CO2的分子结构从_______ (填分子的空间结构名称)变为弯曲型,便于下一步反应。
(2)一种CO2直接加氢的反应机理如图a所示。

①写出总反应的化学方程式_______ 。
②MgOCO2也可以写成MgCO3,写出CO 的VSEPR模型名称
的VSEPR模型名称_______ 。
(3)①已知:主反应CO2催化加氢制甲醇是放热反应
2H2(g)+O2(g)=2H2O(g) ΔH1
2CH3OH(g)+3O2(g)=4H2O(g)+2CO2(g) ΔH2
写出CO2催化加氢制甲醇的热化学方程式_______ (ΔH用含ΔH1和ΔH2的代数式表示)。
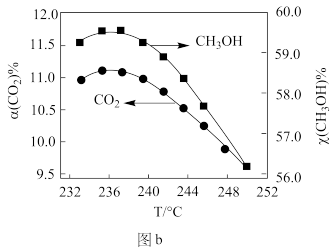
②CO2催化加氢制甲醇过程中的主要竞争反应为:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41kJ/mol,在恒温密闭容器中,维持压强和投料不变,将CO2和H2按一定流速通过反应器,CO2转化率和CH3OH选择性[x(CH3OH)%=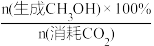 ]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因
]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因_______ 。
③我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式_______ 。
(1)若活化CO2,通常需要采取适当的方式使CO2的分子结构从
(2)一种CO2直接加氢的反应机理如图a所示。

①写出总反应的化学方程式
②MgOCO2也可以写成MgCO3,写出CO
 的VSEPR模型名称
的VSEPR模型名称(3)①已知:主反应CO2催化加氢制甲醇是放热反应
2H2(g)+O2(g)=2H2O(g) ΔH1
2CH3OH(g)+3O2(g)=4H2O(g)+2CO2(g) ΔH2
写出CO2催化加氢制甲醇的热化学方程式
②CO2催化加氢制甲醇过程中的主要竞争反应为:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41kJ/mol,在恒温密闭容器中,维持压强和投料不变,将CO2和H2按一定流速通过反应器,CO2转化率和CH3OH选择性[x(CH3OH)%=
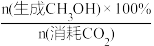 ]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因
]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因
③我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式
您最近一年使用:0次
名校
6 . 已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol
CO(g)+ O2(g)=CO2(g) ΔH2=-283kJ/mol
O2(g)=CO2(g) ΔH2=-283kJ/mol
理论上2mol石墨不充分燃烧,生成等物质的量的CO(g)和CO2(g)放出的热量是
CO(g)+
 O2(g)=CO2(g) ΔH2=-283kJ/mol
O2(g)=CO2(g) ΔH2=-283kJ/mol理论上2mol石墨不充分燃烧,生成等物质的量的CO(g)和CO2(g)放出的热量是
| A.676.5kJ | B.504kJ | C.283kJ | D.110.5kJ |
您最近一年使用:0次
2022-01-17更新
|
482次组卷
|
6卷引用:北京市石景山区2021-2022学年高三上学期期末考试化学试题
北京市石景山区2021-2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)河北省石家庄市第二中学2021-2022学年高一下学期期中考试化学试题北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题山东省临沂市沂水县2022-2023学年高二上学期学科素养(期中)检测化学试题(已下线)第02讲 反应热的计算-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
10-11高三上·北京石景山·期末
名校
7 . 已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=﹣870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=﹣393.5 kJ·mol-1
③H2(g) + O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=﹣870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=﹣393.5 kJ·mol-1
③H2(g) +
 O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为
| A.﹣488.3 kJ·mol-1 | B.﹣224.15 kJ·mol-1 |
| C.488.3 kJ·mol-1 | D.244.15 kJ·mol-1 |
您最近一年使用:0次
2021-11-17更新
|
1507次组卷
|
90卷引用:北京市石景山区2010学年第一学期期末考试试卷
(已下线)北京市石景山区2010学年第一学期期末考试试卷(已下线)2011届浙江金华一中高三上学期期中考试化学试卷(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2011届江西省吉安市高三第三次模拟考试(理综)化学部分(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2012届山东省枣庄十八中高三10月份质量检测化学试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012学年湖南省凤凰县华鑫中学高二上12月月考化学试卷(已下线)2012届北京市密云二中高三10月月考化学试卷(已下线)2010-2011学年安徽省怀宁县高河中学高二下学期第二次月考化学试卷(已下线)2011-2012学年陕西省宝鸡中学高一下学期期中考试化学试卷(已下线)2012-2013学年辽宁省盘锦市第二高级中学高二9月月考化学试卷(已下线)2012-2013学年江西省九江一中高二第一次月考化学试卷(已下线)2012-2013学年重庆市重庆一中高二上学期期中考试理科化学试卷(已下线)2012-2013学年广东省汕头市金山中学高二上学期期末考试化学试卷(已下线)2012-2013学年江苏省新马高级中学高二下学期期末考试化学试卷(已下线)2014年高二化学人教版选修四 4化学反应热的计算练习卷(已下线)2013-2014吉林省长春市十一中高二下学期期末考试化学试卷(已下线)2015届安徽望江中学同步课时练(人教选修4)1.3化学反应热的计算(已下线)2014-2015学年吉林省汪清县第六中学高二上学期期中考试化学试卷(已下线)2014秋安徽省黄山市屯溪一中高二上学期期中考试化学试卷2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷2015-2016学年四川省雅安中学高二上期中考试化学试卷2015-2016学年宁夏育才中学高二上期末考试化学试卷2015-2016学年辽宁省五校协作体高一下学期期中考试化学试卷2017届湖北省松滋市第一中学高三上学期9月月考化学试卷2016-2017学年内蒙古集宁一中高二上期中化学试卷2016-2017学年广西宾阳中学高二上9月月考化学试卷2016-2017学年江西省宜春市奉新一中高二上月考一化学试卷苏教版2017届高三单元精练检测六化学试题苏教版2017届高三单元精练检测六化学试题甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题河南省南阳市七校2017-2018学年高二上学期第一次联考化学试题山东省济南市第一中学2017-2018学年高二10月阶段测试化学试题山东省济南第一中学2017-2018学年高二上学期期中考试化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第二次月考化学试题黑龙江省哈尔滨三中2017-2018学年高二上学期11月第一次验收考试化学试题人教版2017届高三单元精练检测六化学试题(已下线)2018年9月12日 《每日一题》一轮复习-反应热的计算【校级联考】福建省长汀、连城一中等六校2018-2019学年高二年上学期期中考联考化学试题安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点(已下线)2019年4月14日《每日一题》三轮复习—— 每周一测【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期4月月考化学试题【全国百强校】广东省中山市第一中学2018-2019学年高一下学期第二次(5月)段考化学试题(已下线)2019年8月30日 《每日一题》人教选修4——盖斯定律的应用黑龙江省伊春市第二中学2018届高三上学期期中考试化学试题河南省林州市第一中学2019-2020学年高二9月月考化学试题河南林州一中2019-2020学年高二上9月化学测试题辽宁省葫芦岛市第八高级中学2020届高三10月月考化学试题湖北省黄冈市2019-2020学年高二10月月考化学试题海南省东方市八所中学2019-2020学年高二上学期第一次月考化学试题宁夏育才中学2019-2020学年高二上学期第一次月考化学试题陕西省榆林市第二中学2020届高三第四次模拟考试化学试题安徽省肥东县第二中学2019-2020学年高二上学期期中考试化学试题吉林省油田第十一中学2019-2020学年高二上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用甘肃省临夏中学2019-2020学年高二上学期期中考试化学(理)试题山西省祁县第二中学校2019-2020学年高二上学期期中考试化学试题山西省实验中学2020届高三化学复习针对性试题集(四)河南省开封市五县联考2019-2020学年高二上学期期末考试化学试题湖北省咸宁市崇阳一中2019-2020学年高二3月月考化学试题内蒙古自治区呼和浩特市土默特左旗第一中学2019-2020学年高一下学期期末考试化学试题河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题(已下线)1.3.1+盖斯定律-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)【南昌新东方】9.湾里一中 梁莎河南省南阳市第十中学2020-2021学年高二上学期第一次月考化学试题青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题江西宜春市第九中学2020-2021学年高二上学期第一次月考化学试题辽宁省营口市2020-2021学年高二上学期期末考试化学试题江西省抚州市崇仁第二中学2021-2022学年高二上学期第一次月考化学试题广东省深圳市宝安第一外国语学校2021-2022学年高二10月月考化学试题江西省南城第二中学2021-2022学年高二上学期第一次月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期第一次月考化学(理)试题广东省清远市第一中学2021-2022学年高二上学期期中调研考试化学试题山东省泰安肥城市2021-2022学年高二上学期期中考试化学试题山西省太原市第五十六中学2021-2022学年高二上学期10月月考化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题陕西省渭南市咸林中学2021-2022学年高二上学期第三阶段检测化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题陕西省渭南市富平县蓝光中学2021-2022学年高二上学期期末质量检测化学(理)试题山西省太原市第五十六中学2022-2023学年高二上学期10月联考化学试题广东省江门广雅中学2022-2023学年高二上学期期中考试化学试题新疆乌鲁木齐市第八中学2022-2023学年高二下学期第一次质量检测(开学摸底)化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题四川省华蓥中学2023-2024学年高二上学期9月月考化学试题山东省海阳第一中学2023-2024学年高一下学期3月份月考化学试题陕西省西安市周至县第四中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
8 . 正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
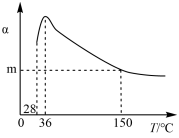
下列说法不正确 的是

名称 | 熔点/℃ | 沸点/℃ | 燃烧热 ∆H /kJ•mol-1 |
正戊烷 | -130 | 36 | –3506.1 |
异戊烷 | -159.4 | 27.8 | –3504.1 |
| A.25 ℃,101 kPa时,正戊烷异构化成异戊烷的热化学反应方程式为:CH3CH2CH2CH2CH3(l) = (CH3)2CHCH2CH3(l) ∆H = –2.0 kJ/mol |
| B.28~36 ℃时,随温度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动 |
| C.36~150 ℃时,随温度升高,正戊烷异构化反应的平衡常数增大 |
| D.150 ℃时,体系压强从100 kPa升高到500 kPa,正戊烷的平衡转化率基本不变 |
您最近一年使用:0次
2021-04-05更新
|
1181次组卷
|
12卷引用:北京市石景山区2021届高三一模化学试题
北京市石景山区2021届高三一模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(01)湖南省长沙市第一中学2021届高三第一次模拟考试化学试题广东省汕头市金山中学2021届高三下学期第三次模拟考试化学试题重庆市西南大学附属中学2020-2021学年高三下学期第六次月考化学试题(已下线)第22讲 化学平衡常数及转化率的计算(精练)-2022年高考化学一轮复习讲练测天津市宁河区芦台第一中学2022届高三下学期线上模拟(一)化学试题湖北省武汉市第一中学2023届高三上学期第一次月考化学试题北京市朝阳区2023届高三下学期三模化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题辽宁省沈阳市东北育才双语学校2023-2024学年高二上学期自主测评化学试题
9 . 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在钢基催化剂上的反应机理相能量图如下:
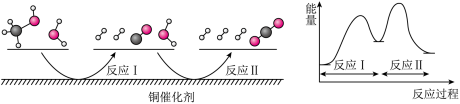
下列说法正确的是( )

下列说法正确的是( )
| A.反应II的热化学方程式为:CO(g)+H2O(g)→H2(g)+CO2(g) -Q kJ(Q>0) |
| B.1 mol CH3OH(g)和l mol H2O(g)的总能量大于l mol CO2(g)和3 mol H2(g)的总能量 |
| C.选择优良的催化剂降低反应I和II的活化能,有利于减少过程中的能耗 |
| D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂 |
您最近一年使用:0次
2020-10-23更新
|
513次组卷
|
22卷引用:北京市石景山区2020届高三第一次模拟化学试题
北京市石景山区2020届高三第一次模拟化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:热化学 电化学天津市红桥区2020届高三第二次模拟考试化学试题北京市北京师范大学燕化附属中学2019-2020 学年高二下学期期末考试化学试题北京市延庆区2019-2020学年高二下学期期末考试化学试题广州市天河中学2019—2020学年高二下学期期末测试化学试卷山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题上海市复旦大学附属中学2021届高三上学期第一次教学质量检测化学试题吉林省长春市第一五一中学2020-2021学年高二上学期第一次月考化学试题(希望班)江西省赣州市十五县市十六校2020-2021学年高二上学期期中联考化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)专题1.1.2 热化学方程式的书写(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)福建省武平县第一中学2021-2022学年高二上学期10月月考化学试题江西省赣州市2021-2022学高三上学期期末考试化学试题北京市日坛中学2021-2022学年高二上学期期中考试化学试题北京市西城区第一六一中学2022届高三考前热身测试化学试题(已下线)第15讲 化学反应的热效应 (练)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省武汉市青山区2021-2022学年高二上学期期末考试化学试题上海行知中学2022-2023学年高三上学期第一次月考化学试题广东省广州市玉岩中学2022-2023学年高二上学期10月月考化学试题河南省鹤壁市高中2022-2023学年高三上学期第三次模拟考试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题16-20)
10 . 已知热化学方程式:
①C(金刚石,s)+O2(g)=CO2(g) ΔH1
②C(石墨,s)+O2(g)=CO2(g) ΔH2
③C(石墨,s)=C(金刚石,s) ΔH3=+1.9kJ∙mol-1
下列说法正确的是( )
①C(金刚石,s)+O2(g)=CO2(g) ΔH1
②C(石墨,s)+O2(g)=CO2(g) ΔH2
③C(石墨,s)=C(金刚石,s) ΔH3=+1.9kJ∙mol-1
下列说法正确的是( )
| A.石墨转化成金刚石的反应是吸热反应 |
| B.金刚石比石墨稳定 |
| C.ΔH3=ΔH1-ΔH2 |
| D.ΔH1>ΔH2 |
您最近一年使用:0次
2020-10-16更新
|
425次组卷
|
23卷引用:北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题
北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题2014-2015学年福建省清流一中高二上学期月考化学理试卷2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷2017届广西桂林市第十八中学高三上第二次月考化学试卷高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第二课时(反应热的计算)河南省郑州市第106中学2018-2019学年高二上学期第一次月考化学试题陕西省汉中中学2018-2019学年高二上学期期中考试化学试题河南省周口中英文学校2019-2020学年高二上学期第一次月考化学试题辽宁省建平第二高级中学2019-2020学年高二上学期9月月考化学试题天津市静海区大邱庄中学等四校2019-2020学年高二10联考化学试题陕西省渭南三贤中学2019-2020学年高二上学期期中考试化学试题云南省玉溪市江川区二中2019-2020学年高二上学期期末考试化学试题(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)陕西省西安市第七十五中学2019-2020学年高二第一次月考化学试题(已下线)湖南省邵东县第一中学2018-2019学年高二上学期第三次月考化学(理)试题陕西省咸阳百灵中学2020-2021学年高二上学期第一次月考化学试题黑龙江伊春林业管理局第二中学2021届高三上学期期中考试化学试题新疆乌苏市第一中学2021-2022学年高二上学期10月月考化学试题(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练四川省南充市第一中学2021-2022学年高一下学期6月月考化学试题新疆石河子第二中学2021-2022学年高二上学期第二次月考化学试题福建省莆田第七中学2021-2022学年高二上学期期末考试化学试题第一章 第二节 反应热的计算



