名校
1 . 高一年级小村同学最近通过学习了解到:“肼”( )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
(1) 属于
属于_______ 化合物(填“离子化合物”或“共价化合物”),所含化学键类型有_______ (填“离子键”或“极性键”或“非极性键”)
(2)已知①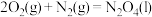
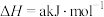
②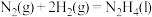
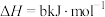
③
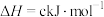
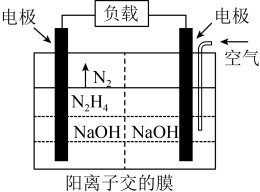
某型号火箭采用液态肼和液态 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式________ 。
(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式________ ,理论上每消耗64 g肼可除去标准状况下
________ L。
(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式_________ 。
 )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。(1)
 属于
属于(2)已知①
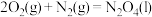
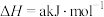
②
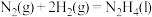
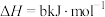
③

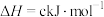
某型号火箭采用液态肼和液态
 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式

(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式

您最近一年使用:0次
名校
解题方法
2 . 载人航天器中,利用萨巴蒂尔反应将航天员呼出的CO2转化为H2O,再通过电解H2O获得O2,实现O2的再生。
已知:①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH=-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) ΔH=+571.6kJ/mol
请回答:
(1)反应②属于_______ (填“吸热”或“放热”)反应。
(2)反应①消耗1mol CO2(g)时,反应_______ (填“吸收”或“放出”)热量,其数值为_______ kJ。
(3)反应②热量变化为571.6kJ时,生成O2(g)的质量为_______ g。
(4)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=_______ kJ/mol。
已知:①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH=-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) ΔH=+571.6kJ/mol
请回答:
(1)反应②属于
(2)反应①消耗1mol CO2(g)时,反应
(3)反应②热量变化为571.6kJ时,生成O2(g)的质量为
(4)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=
您最近一年使用:0次
2022-11-30更新
|
168次组卷
|
4卷引用:北京市北京师范大学燕化附属中学2023-2024学年高一下学期期中考试化学试卷
北京市北京师范大学燕化附属中学2023-2024学年高一下学期期中考试化学试卷 (已下线)综合测试卷-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)贵州省晴隆县第三中学2022-2023学年高二上学期第一次月考化学试题甘肃省白银市会宁县第四中学2023-2024学年高二上学期第一次月考化学试题
解题方法
3 . 二氧化碳的回收利用是环保领域研究热点。
(1)在太阳能的作用下,以CO2为原料制炭黑的流程如图所示。总反应的化学方程式为__ ;

(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
已知298K和101kPa条件下:CO2(g)+3H2(g) CH3OH(g)+H2O(l) ΔH=-akJ/mol;
CH3OH(g)+H2O(l) ΔH=-akJ/mol;
2H2(g)+O2(g)=2H2O(l) ΔH=-bkJ/mol;
CH3OH(g)=CH3OH(l) ΔH=-ckJ/mol;
则CH3OH(l)的标准燃烧热ΔH=__ ;
(3)在催化剂M的作用下,CO2经过催化氢化合成低碳烯烃等。
CO2和H2同时发生下列两个反应:
①2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g) ΔH<0
CH2=CH2(g)+4H2O(g) ΔH<0
②2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
如图是乙烯在相同时间内,不同温度下的产率,当温度高于460℃时乙烯产率降低的原因不可能是__ 。

A.催化剂M的活性降低
B.①反应的平衡常数变大
C.生成甲醚的量增加
(1)在太阳能的作用下,以CO2为原料制炭黑的流程如图所示。总反应的化学方程式为

(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2
 CH3OH+H2O。
CH3OH+H2O。已知298K和101kPa条件下:CO2(g)+3H2(g)
 CH3OH(g)+H2O(l) ΔH=-akJ/mol;
CH3OH(g)+H2O(l) ΔH=-akJ/mol;2H2(g)+O2(g)=2H2O(l) ΔH=-bkJ/mol;
CH3OH(g)=CH3OH(l) ΔH=-ckJ/mol;
则CH3OH(l)的标准燃烧热ΔH=
(3)在催化剂M的作用下,CO2经过催化氢化合成低碳烯烃等。
CO2和H2同时发生下列两个反应:
①2CO2(g)+6H2(g)
 CH2=CH2(g)+4H2O(g) ΔH<0
CH2=CH2(g)+4H2O(g) ΔH<0②2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0如图是乙烯在相同时间内,不同温度下的产率,当温度高于460℃时乙烯产率降低的原因不可能是

A.催化剂M的活性降低
B.①反应的平衡常数变大
C.生成甲醚的量增加
您最近一年使用:0次
解题方法
4 . 依据事实,回答下列问题。
(1)在25℃、101kPa时,1.0gC8H18(l,辛烷)燃烧生成CO2(g)和H2O(l),放出48.40kJ的热量,则C8H18(l)的燃烧热为___ kJ/mol。
(2)已知N2(g)+2O2(g)=2NO2(g);ΔH=+67.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH=-534kJ/mol,根据盖斯定律写出肼(N2H4)与NO2完全反应生成氮气和气态水的热化学方程式____ 。
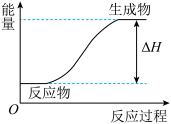
(3)某反应过程中的能量变化如图所示,则该反应是____ (填“放热”或“吸热”)反应,判断依据是____ 。
(4)已知:2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462kJ•mol-1
 ,
,
则断开1molH–N键与断开1molH–Cl键所需能量相差约为_____ kJ。
(1)在25℃、101kPa时,1.0gC8H18(l,辛烷)燃烧生成CO2(g)和H2O(l),放出48.40kJ的热量,则C8H18(l)的燃烧热为
(2)已知N2(g)+2O2(g)=2NO2(g);ΔH=+67.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH=-534kJ/mol,根据盖斯定律写出肼(N2H4)与NO2完全反应生成氮气和气态水的热化学方程式
(3)某反应过程中的能量变化如图所示,则该反应是

(4)已知:2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462kJ•mol-1
 ,
,
则断开1molH–N键与断开1molH–Cl键所需能量相差约为
您最近一年使用:0次
名校
解题方法
5 . 参考下列图表和有关要求回答问题:
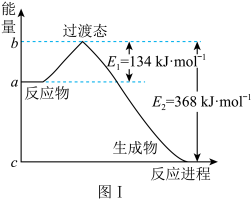
(1)图Ⅰ是 1mol NO2(g)和 1 mol CO(g)反应生成 CO2和NO 过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_____ (填“增大”“减小”或“不变”,下同),ΔH 的变化是_____ 。请写出 NO2和 CO反应的热化学方程式:_____ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则甲醇燃烧生成液态水的热化学方程式:_____ 。
(3)下表是部分化学键的键能数据:
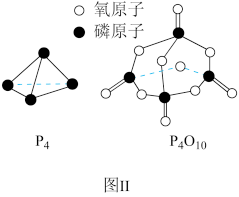
已知 1 mol 白磷(P4)完全燃烧放热为 dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中 x=_____ kJ·mol-1(用含有 a、b、c、d 的代数式表示)。


(1)图Ⅰ是 1mol NO2(g)和 1 mol CO(g)反应生成 CO2和NO 过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则甲醇燃烧生成液态水的热化学方程式:
(3)下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/kJ·mol-1 | a | b | c | x |
已知 1 mol 白磷(P4)完全燃烧放热为 dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中 x=
您最近一年使用:0次
2020-05-04更新
|
298次组卷
|
16卷引用:北京市朝阳区陈经纶中学 2019-2020学年高二下学期期中自主检测化学试题
北京市朝阳区陈经纶中学 2019-2020学年高二下学期期中自主检测化学试题(已下线)2014高考名师推荐化学盖斯定律及其应用2016-2017学年江苏省启东中学高一上月考二化学试卷2016-2017学年四川省乐山市高二上学期教学质检化学试卷2016-2017学年四川省雅安中学高二下学期开学考试化学试卷河南省南阳市第一中学2016-2017学年高二下学期第二次月考(5月)化学试题福建省泉州市泉港区第一中学2017-2018学年高二上学期期中考试化学试题湖南省醴陵市第一中学2018-2019学年高二上学期入学考试化学试题四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题安徽省滁州市定远县育才学校2019-2020学年高二(普通班)上学期第三次月考化学试题云南省曲靖市会泽县第一中学2019-2020学年高二上学期第一次段考化学试题陕西省咸阳百灵中学2020-2021学年高二上学期第一次月考化学试题江西省赣州市会昌县会昌中学2020-2021学年高二上学期第一次月考化学试题(已下线)【南昌新东方】9.湾里一中 梁莎陕西省子洲中学2019-2020学年高二下学期第一次月考化学试题甘肃省靖远县第二中学2021-2022学年高二上学期期中考试化学(理)试题
解题方法
6 . 氮及氮的化合物有着重要的用途。
(1)氮元素在周期表中的位置是______ ; NH3的电子式是______ 。
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径______ (用化学方程式表示)。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:

下列说法正确的是______ (选填字母)。
a 图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g) △H= -92.4 kJ/mol,2H2(g)+O2(g)=2H2O(g) △H = -483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是________ 。
(5)水合肼(N2H4•H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是________ 。
(1)氮元素在周期表中的位置是
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:

下列说法正确的是
a 图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g) △H= -92.4 kJ/mol,2H2(g)+O2(g)=2H2O(g) △H = -483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是
(5)水合肼(N2H4•H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是
您最近一年使用:0次
解题方法
7 . 碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═ H2(g)+
H2(g)+ I2(aq)△H2
I2(aq)△H2
反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═______ (用△H1、△H2表示);
②分析上述反应,下列判断正确的是______ ;
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)⇌I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:______ ;

(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:______ ;
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)⇌AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═______ [用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示].该方法去除碘离子的原理是______ 。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═
 H2(g)+
H2(g)+ I2(aq)△H2
I2(aq)△H2反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═
②分析上述反应,下列判断正确的是
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)⇌I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:

(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)⇌AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═
您最近一年使用:0次
2020-02-27更新
|
193次组卷
|
2卷引用:北京市通州区2020届高三上学期期末摸底考试化学试题
8 . 煤的气化、液化是综合利用煤炭的重要途径之一。
(1)已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
③H2(g)+ 1/2O2(g)=H2O(g) ΔH3=-241.8kJ·mol-1
焦炭与水蒸气反应是:C(s)+H2O(g)=CO(g)+H2(g)△H=___ kJ·mol-1
(2)氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的发电装置,其工作原理是2H2+O2=2H2O
①若选用KOH溶液作电解质溶液,则正极通入的气体是___ ,该电极的电极反应式为___ 。
②若选用硫酸作电解质溶液,则负极的电极方程式为___ 。
(3)电解氯化钠溶液时,阳极的电极反应式为___ 。
(1)已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
③H2(g)+ 1/2O2(g)=H2O(g) ΔH3=-241.8kJ·mol-1
焦炭与水蒸气反应是:C(s)+H2O(g)=CO(g)+H2(g)△H=
(2)氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的发电装置,其工作原理是2H2+O2=2H2O
①若选用KOH溶液作电解质溶液,则正极通入的气体是
②若选用硫酸作电解质溶液,则负极的电极方程式为
(3)电解氯化钠溶液时,阳极的电极反应式为
您最近一年使用:0次
2019-11-11更新
|
290次组卷
|
3卷引用:北京市海淀区首都师范大学附属中学2019-2020学年高一下学期第二次月考化学试题
名校
9 . 2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)⇌H2O(g) +CO(g) ΔH1 = + 41.1 kJ•mol-1
CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.0 kJ•mol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______ 。
(2)为提高CH3OH产率,理论上应采用的条件是_______ (填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。

① 反应物X是_______ (填“CO2”或“H2”)。
② 判断依据是_______ 。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K =_______ 。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
根据上表所给数据,用CO2生产甲醇的最优选项为_______ (填字母)。
(1)已知:CO2(g)+H2(g)⇌H2O(g) +CO(g) ΔH1 = + 41.1 kJ•mol-1
CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.0 kJ•mol-1
写出CO2催化氢化合成甲醇的热化学方程式:
(2)为提高CH3OH产率,理论上应采用的条件是
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。

① 反应物X是
② 判断依据是
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=
② 化学平衡常数K =
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
| 实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
| C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为
您最近一年使用:0次
2019-07-30更新
|
548次组卷
|
4卷引用:北京市朝阳区2018-2019学年高二第二学期期末统一考试化学试题
名校
10 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为______ 。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______ 。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。
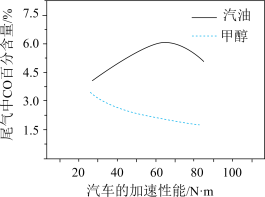
根据图信息分析,与汽油相比,甲醇作为燃料的优点是______ 。
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
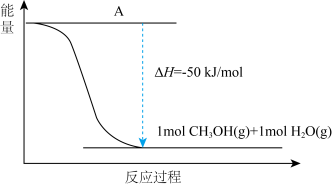
① 补全上图:图中A处应填入______ 。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______ (填“变大”“变小”或“不变”)。
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) ==== CH3OH(g) 。该反应的ΔH为_____ kJ/mol。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) ==== CH3OH(g) 。该反应的ΔH为
您最近一年使用:0次
2019-07-07更新
|
1933次组卷
|
9卷引用:北京市海淀区2018-2019学年高二第二学期期末考试化学试题
北京市海淀区2018-2019学年高二第二学期期末考试化学试题北京市中央民族大学附属中学2019-2020学年高二下学期期末考试化学试题浙江省杭州市西湖高级中学2019-2020学年高二10月月考化学试题内蒙古包钢第一中学2019-2020学年高二上学期10月月考化学试题(已下线)第01章 化学反应与能量(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测(已下线)第1章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)四川省乐山市峨山彝族自治县第一中学2020-2021学年高二下学期4月月考化学试题四川省遂宁中学校2020-2021学年高二下学期第一次月考化学试题



