1 . 二氧化碳与氢气催化合成乙烯具有重要的意义。将 和
和 按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。
按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。
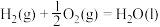
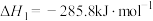
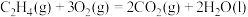
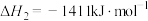

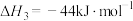
下列说法不正确 的是
 和
和 按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。
按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。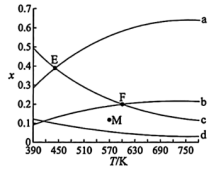
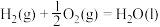
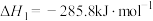
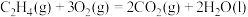
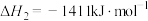

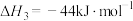
下列说法
A. 与 与 合成 合成 反应的热化学方程式: 反应的热化学方程式: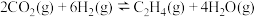 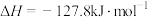 |
B.图中b、d分别表示 、 、 的变化曲线 的变化曲线 |
C.570K、0.2MPa反应达到平衡状态时,M点显示的可能是 的物质的量分数 的物质的量分数 |
D. 与 与 合成 合成 反应的 反应的 |
您最近半年使用:0次
2 . 烟气脱硝技术是环境科学研究的热点。实验室模拟 将烟气中的
将烟气中的 深度氧化为
深度氧化为 ,并进一步将
,并进一步将 转化获得含氮产品,流程示意图如下。
转化获得含氮产品,流程示意图如下。
i.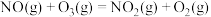
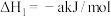
ii.

iii.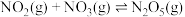

(1) 被
被 深度氧化,补全热化学方程式:
深度氧化,补全热化学方程式:


___________ 
(2)一定条件下,不同温度时, 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。
___________  (填“>”或“<”)。
(填“>”或“<”)。
②8s时, 的浓度不同的原因是
的浓度不同的原因是___________ 。
(3)一定条件下,NO的初始浓度为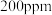 时,不同反应时间,深度氧化器中
时,不同反应时间,深度氧化器中 的浓度随
的浓度随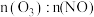 的变化如图所示。反应过程中
的变化如图所示。反应过程中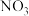 的浓度极低。
的浓度极低。 时,深度氧化器中发生的反应主要是
时,深度氧化器中发生的反应主要是___________ (填“i”“ii”或“iii”)。
② 时,
时, 的浓度随
的浓度随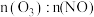 变化的原因是
变化的原因是___________ 。
(4) 且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是
且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是___________ 。
(5)深度氧化后的烟气通过吸收器完全转化为硝酸盐产品,产品浓度的测定方法如下。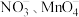 的还原产物分别是
的还原产物分别是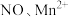 。产品中
。产品中 的物质的量浓度为
的物质的量浓度为___________  。
。
 将烟气中的
将烟气中的 深度氧化为
深度氧化为 ,并进一步将
,并进一步将 转化获得含氮产品,流程示意图如下。
转化获得含氮产品,流程示意图如下。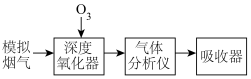
i.
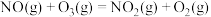
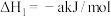
ii.


iii.
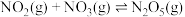

(1)
 被
被 深度氧化,补全热化学方程式:
深度氧化,补全热化学方程式:


(2)一定条件下,不同温度时,
 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。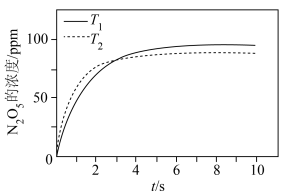

 (填“>”或“<”)。
(填“>”或“<”)。②8s时,
 的浓度不同的原因是
的浓度不同的原因是(3)一定条件下,NO的初始浓度为
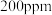 时,不同反应时间,深度氧化器中
时,不同反应时间,深度氧化器中 的浓度随
的浓度随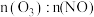 的变化如图所示。反应过程中
的变化如图所示。反应过程中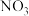 的浓度极低。
的浓度极低。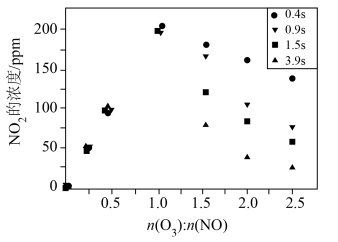
 时,深度氧化器中发生的反应主要是
时,深度氧化器中发生的反应主要是②
 时,
时, 的浓度随
的浓度随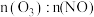 变化的原因是
变化的原因是(4)
 且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是
且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是(5)深度氧化后的烟气通过吸收器完全转化为硝酸盐产品,产品浓度的测定方法如下。
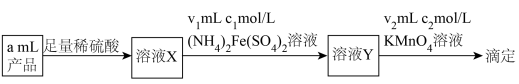
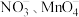 的还原产物分别是
的还原产物分别是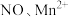 。产品中
。产品中 的物质的量浓度为
的物质的量浓度为 。
。
您最近半年使用:0次
解题方法
3 . 甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。
(1)已知一定条件下,发生反应: ,
,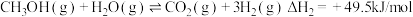 ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是________ 。
(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。
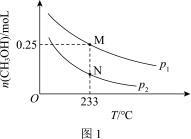
①p1____ p2(填“<”或“>”)。
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=_______ ,H2的转化率为______ (保留1位小数)。
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是_______ (填字母)。
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯: 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
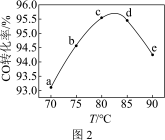
①b、c、d三点中,尚未达到化学平衡状态的点是________ 。
②该反应是_______ (填“放热”或“吸热”)反应。
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:________ 。
(1)已知一定条件下,发生反应:
 ,
,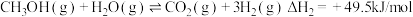 ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。

①p1
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯:
 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
①b、c、d三点中,尚未达到化学平衡状态的点是
②该反应是
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:
您最近半年使用:0次
名校
4 . 二甲醚( )是重要的化工原料,可用水煤气(主要成分为CO和
)是重要的化工原料,可用水煤气(主要成分为CO和 )合成。其主要反应原理如下(a、b、c均为正值):
)合成。其主要反应原理如下(a、b、c均为正值):
①
 kJ⋅mol
kJ⋅mol
②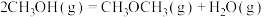
 kJ·mol
kJ·mol
③
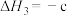 kJ⋅mol
kJ⋅mol
回答下列问题:
(1)总反应的热化学方程式: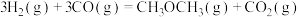

_______ kJ/mol。
(2)以下说法能说明反应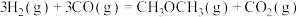 达到化学平衡状态的有
达到化学平衡状态的有_______ 。
a.恒温恒容条件下,气体的密度保持不变
b.恒温恒压条件下,气体的平均摩尔质量保持不变
c.绝热体系中,体系的温度保持不变
(3)生产二甲醚的过程中存在副反应: ,与甲醇脱水反应:
,与甲醇脱水反应: 形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
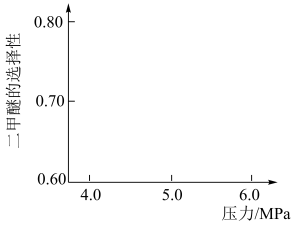
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
分析:温度一定,随压强增大,二甲醚选择性增大的原因是_______ 。
 )是重要的化工原料,可用水煤气(主要成分为CO和
)是重要的化工原料,可用水煤气(主要成分为CO和 )合成。其主要反应原理如下(a、b、c均为正值):
)合成。其主要反应原理如下(a、b、c均为正值):①

 kJ⋅mol
kJ⋅mol
②
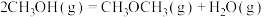
 kJ·mol
kJ·mol
③

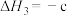 kJ⋅mol
kJ⋅mol
回答下列问题:
(1)总反应的热化学方程式:
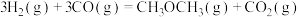

(2)以下说法能说明反应
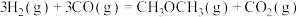 达到化学平衡状态的有
达到化学平衡状态的有a.恒温恒容条件下,气体的密度保持不变
b.恒温恒压条件下,气体的平均摩尔质量保持不变
c.绝热体系中,体系的温度保持不变
(3)生产二甲醚的过程中存在副反应:
 ,与甲醇脱水反应:
,与甲醇脱水反应: 形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
分析:温度一定,随压强增大,二甲醚选择性增大的原因是
您最近半年使用:0次
名校
解题方法
5 . 完成下列问题
(1)0.1mol 完全燃烧生成液态水和
完全燃烧生成液态水和 ,放出88.96kJ热量,
,放出88.96kJ热量, 的燃烧热为
的燃烧热为
___________ kJ/mol。
(2)单斜硫和正交硫转化为 的能量变化图如图。
的能量变化图如图。
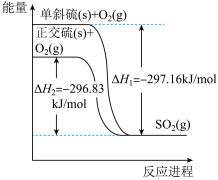
32g单斜硫转化为正交硫的反应热为
___________ kJ/mol,单斜硫比正交硫的稳定性___________ (填“强”或“弱”)。
(3) 和
和 在一定条件下能发生反应:
在一定条件下能发生反应: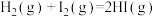
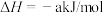
已知:
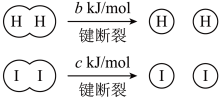 a、b、c均大于零
a、b、c均大于零
断开1mol H-I键所需能量为___________ kJ/mol。
(1)0.1mol
 完全燃烧生成液态水和
完全燃烧生成液态水和 ,放出88.96kJ热量,
,放出88.96kJ热量, 的燃烧热为
的燃烧热为
(2)单斜硫和正交硫转化为
 的能量变化图如图。
的能量变化图如图。
32g单斜硫转化为正交硫的反应热为

(3)
 和
和 在一定条件下能发生反应:
在一定条件下能发生反应: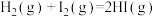
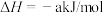
已知:
 a、b、c均大于零
a、b、c均大于零断开1mol H-I键所需能量为
您最近半年使用:0次
名校
6 . 二甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式为:
工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:___________
ii.甲醇脱水反应: ,
,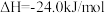
(1)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为___________ 。
(2)请补全甲醇合成反应 的热化学方程式___________ 。
(3)甲醇脱水反应: ,是制备二甲醚的重要环节。
,是制备二甲醚的重要环节。
①某温度下,该反应的化学平衡常数是360。在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时正反应速率___________ 逆反应速率(填“>”、“<”或“=”)。
②在一定温度下的恒容密闭容器中发生甲醇脱水反应,下列能说明该反应已达到平衡状态的是___________ 。
a.相同时间内消耗CH3OH的物质的量与消耗CH3OCH3的物质的量之比为2:1
b.混合体系内各组分浓度不变
c.恒容密闭容器内的压强不变
(4)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争。

将反应物混合气按进料比 通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的
通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的选择性 如图所示。
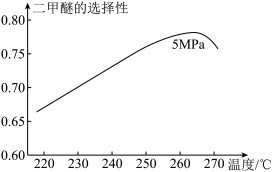
资料:二甲醚的选择性 是指转化为二甲醚的CO在全部转化的CO中所占的比例。温度低于265℃时,随着温度升高二甲醚选择性增加,原因是___________ 。

工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:___________
ii.甲醇脱水反应:
 ,
,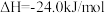
(1)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为
(2)请补全
(3)甲醇脱水反应:
 ,是制备二甲醚的重要环节。
,是制备二甲醚的重要环节。①某温度下,该反应的化学平衡常数是360。在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时正反应速率
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.02 | 0.4 | 0.4 |
a.相同时间内消耗CH3OH的物质的量与消耗CH3OCH3的物质的量之比为2:1
b.混合体系内各组分浓度不变
c.恒容密闭容器内的压强不变
(4)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争。

将反应物混合气按进料比
 通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的
通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的
资料:二甲醚的
您最近半年使用:0次
名校
7 . 碳单质在工业上有多种用途。
(1)焦炭可用于制取水煤气。测得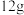 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了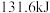 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是___________ 。
(2)活性炭可处理大气污染物 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:

①请结合上表数据,写出 与活性炭反应的化学方程式
与活性炭反应的化学方程式___________ 。
②上述反应 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。
Ⅰ.计算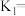
___________ 。
Ⅱ.根据上述信息判断,温度 和
和 的关系是(填序号)
的关系是(填序号)___________ 。
a.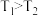 b.
b. c.无法比较
c.无法比较
③在T温度下反应达到平衡后,下列措施不能改变 的转化率的是
的转化率的是___________ 。
a.增大 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属。若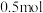 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到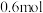 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是___________ 。
(1)焦炭可用于制取水煤气。测得
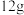 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了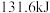 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是(2)活性炭可处理大气污染物
 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出
 与活性炭反应的化学方程式
与活性炭反应的化学方程式②上述反应
 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。Ⅰ.计算
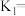
Ⅱ.根据上述信息判断,温度
 和
和 的关系是(填序号)
的关系是(填序号)a.
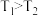 b.
b. c.无法比较
c.无法比较③在T温度下反应达到平衡后,下列措施不能改变
 的转化率的是
的转化率的是a.增大
 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F(3)工业上可用焦炭冶炼金属。若
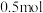 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到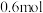 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是
您最近半年使用:0次
名校
8 . 碳氧化物、氮氧化物处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的 ,有利于减少
,有利于减少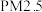 的排放。
的排放。
已知:I.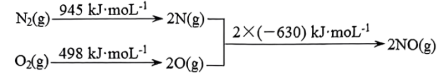
Ⅱ.

①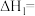
___________ 。
②在催化剂作用下 和
和 转化为无毒气体,写出反应的热化学方程式
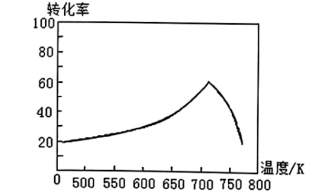
转化为无毒气体,写出反应的热化学方程式___________ 。一定条件下,单位时间内不同温度下测定的氮氧化物转化率如下图所示。温度高于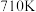 时,随温度的升高氮氧化物转化率降低的原因可能是
时,随温度的升高氮氧化物转化率降低的原因可能是___________ 。
(2)消除燃煤烟气中的 (主要成分为
(主要成分为 、
、 的混合物)可以采用
的混合物)可以采用 溶液吸收脱除。
溶液吸收脱除。 水解的离子方程式是
水解的离子方程式是___________ 。
 溶液吸收
溶液吸收 的主要过程如下:
的主要过程如下:
i. ,
,
ⅱ.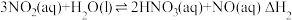 ,
,
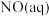 转化为
转化为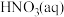 的热化学方程式是
的热化学方程式是___________ 。
研究 对
对 脱除率的影响。调节
脱除率的影响。调节 溶液的初始
溶液的初始 ,
, 的脱除率如下:
的脱除率如下:
 影响
影响 脱除率的原因是
脱除率的原因是___________ 。
(1)消除汽车尾气中的
 ,有利于减少
,有利于减少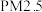 的排放。
的排放。已知:I.

Ⅱ.


①
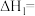
②在催化剂作用下
 和
和 转化为无毒气体,写出反应的热化学方程式
转化为无毒气体,写出反应的热化学方程式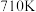 时,随温度的升高氮氧化物转化率降低的原因可能是
时,随温度的升高氮氧化物转化率降低的原因可能是
(2)消除燃煤烟气中的
 (主要成分为
(主要成分为 、
、 的混合物)可以采用
的混合物)可以采用 溶液吸收脱除。
溶液吸收脱除。 水解的离子方程式是
水解的离子方程式是 溶液吸收
溶液吸收 的主要过程如下:
的主要过程如下:i.
 ,
,ⅱ.
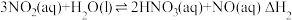 ,
,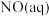 转化为
转化为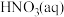 的热化学方程式是
的热化学方程式是研究
 对
对 脱除率的影响。调节
脱除率的影响。调节 溶液的初始
溶液的初始 ,
, 的脱除率如下:
的脱除率如下:初始 | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
 脱除率 脱除率 | 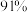 |  |  |  | 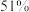 |
 影响
影响 脱除率的原因是
脱除率的原因是
您最近半年使用:0次
名校
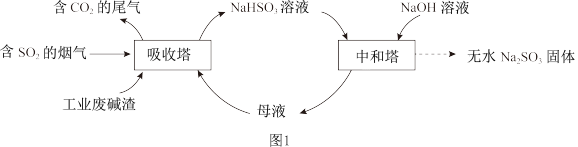
9 . 直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
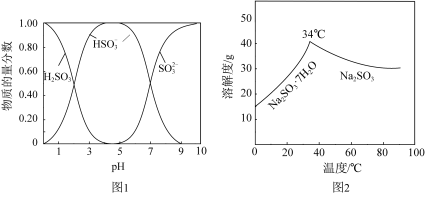
已知:H2SO3、HSO 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_______ 。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_______ 。
②NaHSO3溶液中c(SO )>c(H2SO3),结合方程式解释其原因:
)>c(H2SO3),结合方程式解释其原因:_______ 。
③已知下列反应:
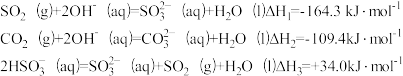
吸收塔中Na2CO3溶液吸收SO2生成HSO 的热化学方程式是
的热化学方程式是_______ 。
④吸收塔中的温度不宜过高,可能的原因是_______ (写出1种即可)。

已知:H2SO3、HSO
 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为
②NaHSO3溶液中c(SO
 )>c(H2SO3),结合方程式解释其原因:
)>c(H2SO3),结合方程式解释其原因:③已知下列反应:
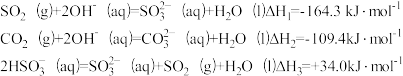
吸收塔中Na2CO3溶液吸收SO2生成HSO
 的热化学方程式是
的热化学方程式是④吸收塔中的温度不宜过高,可能的原因是
您最近半年使用:0次
名校
10 . 工业上制硫酸的主要反应之一为: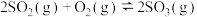 ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
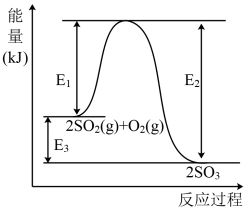
(1)向反应体系中加入催化剂后,图中
___________ (填“增大”、“减小”或“不变”,下同),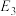
___________ 。
(2)已知:
 ;
;
 ;若
;若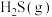 与
与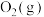 反应产生
反应产生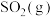 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为___________ 。
(3)某温度下,反应的起始浓度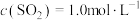 ,
,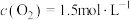 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为___________ 。
(4)在 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=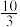 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时正反应速率
,则反应开始时正反应速率___________ (填“>”、“=”或“<”)逆反应速率。
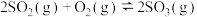 ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
(1)向反应体系中加入催化剂后,图中

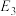
(2)已知:

 ;
;
 ;若
;若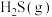 与
与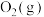 反应产生
反应产生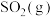 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(3)某温度下,反应的起始浓度
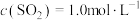 ,
,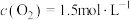 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为(4)在
 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=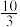 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时正反应速率
,则反应开始时正反应速率
您最近半年使用:0次



