1 .  (s)与CO(g)主要发生如下反应。
(s)与CO(g)主要发生如下反应。
①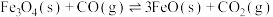
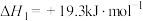
②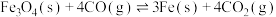

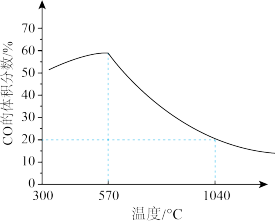
反应的还原产物与温度密切相关。其他条件一定, (s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
 (s)与CO(g)主要发生如下反应。
(s)与CO(g)主要发生如下反应。①
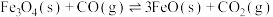
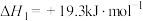
②
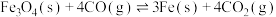

反应的还原产物与温度密切相关。其他条件一定,
 (s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
A.反应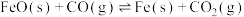 的焓变为 的焓变为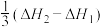 |
B.根据图象推测, 应当小于0 应当小于0 |
C.反应温度越高, 主要还原产物中铁元素的价态越低 主要还原产物中铁元素的价态越低 |
D.温度高于1040℃时, (s)和CO(g)发生的主要反应的化学平衡常数 (s)和CO(g)发生的主要反应的化学平衡常数 |
您最近一年使用:0次
2022-09-01更新
|
960次组卷
|
11卷引用:北京市育才学校2023-2024学年高三上学期11月期中考试化学试题
北京市育才学校2023-2024学年高三上学期11月期中考试化学试题北京市海淀区2021-2022学年高三上学期期末考试化学试题四川省成都市第七中学2023届高三上学期零诊模拟考试化学试题河南省豫北名校2022-2023学年高二上学期10月教学质量检测化学试题北京市第二十中学2022-2023学年高二上学期期末考试化学试题广东省华南师范大学附属中学2022届高三下学期押题预测(一)化学试题安徽省六安第一中学2023-2024学年高二上学期期中考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第八十中学2024届高三上学期10月月考化学试题北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市密云二中2023-2024学年高二上学期10月月考化学试卷
2 . NSR(NO2的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中NO2的排放,其工作原理如图。

(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ·mol-1
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g) △H3=____ 。
(2)①存储阶段:Ba存储NO2后转化为Ba(NO3)2的化学方程式是____ 。
②还原阶段:NO2从Ba(NO3)2中释放,然后在Pt的表面被CO、H2还原为N2。若参加反应的n(CO)=n(H2),则反应的n(CO):n(H2):n(NO2)=____ 。
(3)某实验小组模拟NSR系统中的一个存储、还原过程。让尾气通过NSR反应器,测得过程中出口NO2浓度变化如图。

①t1时刻前,NO2的浓度接近0,原因是____ 。
②t2时刻,切换至贫氧条件,NO2的浓度急剧上升又快速下降的原因是____ 。

(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ·mol-1
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g) △H3=
(2)①存储阶段:Ba存储NO2后转化为Ba(NO3)2的化学方程式是
②还原阶段:NO2从Ba(NO3)2中释放,然后在Pt的表面被CO、H2还原为N2。若参加反应的n(CO)=n(H2),则反应的n(CO):n(H2):n(NO2)=
(3)某实验小组模拟NSR系统中的一个存储、还原过程。让尾气通过NSR反应器,测得过程中出口NO2浓度变化如图。

①t1时刻前,NO2的浓度接近0,原因是
②t2时刻,切换至贫氧条件,NO2的浓度急剧上升又快速下降的原因是
您最近一年使用:0次
2022-06-13更新
|
302次组卷
|
3卷引用:北京市西城区2021届高三一模化学试题
名校
解题方法
3 . 氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)①反应N2(g)+3H2(g) 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为_____ 。
②实验室检验氨气的方法是____ 。
(2)在一定条件下氨的平衡含量如表。
①该反应为_____ (填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是____ 。
(3)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。
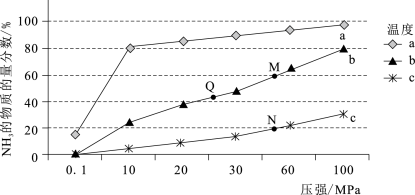
①曲线a对应的温度是____ 。
②M、N、Q点平衡常数K的大小关系是____ 。
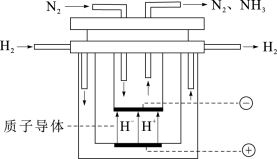
(4)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为____ 。
(5)NH3转化为NO是工业制取硝酸的重要一步,已知:100kPa、298K时:
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1268kJ·mol-1
2N2(g)+6H2O(g) △H=-1268kJ·mol-1
2NO(g) N2(g)+O2(g) △H=-180.5kJ·mol-1
N2(g)+O2(g) △H=-180.5kJ·mol-1
请写出NH3转化为NO的热化学方程式____ 。
(1)①反应N2(g)+3H2(g)
 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为②实验室检验氨气的方法是
(2)在一定条件下氨的平衡含量如表。
| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
(3)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。

①曲线a对应的温度是
②M、N、Q点平衡常数K的大小关系是
(4)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为

(5)NH3转化为NO是工业制取硝酸的重要一步,已知:100kPa、298K时:
4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H=-1268kJ·mol-1
2N2(g)+6H2O(g) △H=-1268kJ·mol-12NO(g)
 N2(g)+O2(g) △H=-180.5kJ·mol-1
N2(g)+O2(g) △H=-180.5kJ·mol-1请写出NH3转化为NO的热化学方程式
您最近一年使用:0次
21-22高一下·北京西城·期中
名校
4 . 以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
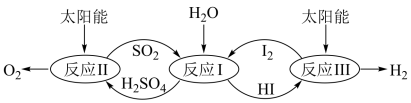
相关反应的热化学方程式为:
反应I:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1=-213kJ·mol-1
反应II:H2SO4(aq)=SO2(g)+H2O(1)+ O2(g) △H2=+327kJ·mol-l
O2(g) △H2=+327kJ·mol-l
反应III:2HI(aq)=H2(g)+I2(g)△H3=+172kJ·mol-1
下列说法不正确的是

相关反应的热化学方程式为:
反应I:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1=-213kJ·mol-1
反应II:H2SO4(aq)=SO2(g)+H2O(1)+
 O2(g) △H2=+327kJ·mol-l
O2(g) △H2=+327kJ·mol-l反应III:2HI(aq)=H2(g)+I2(g)△H3=+172kJ·mol-1
下列说法不正确的是
| A.该过程实现了太阳能到化学能的转化 |
| B.SO2和I2对总反应起到了催化剂的作用 |
| C.总反应的热化学方程式为:2H2O(1)=2H2(g)+O2(g) △H=+286kJ·mol-l |
| D.该过程使水分解制氢分为三步反应,但总反应的△H不变 |
您最近一年使用:0次
名校
解题方法
5 . 在双碳目标驱动下,大批量氢燃料客车在2022年北京冬奥会上投入使用。稳定氢源的获取是科学研究热点,对以下2种氢源获取方法进行讨论。
Ⅰ.甲醇蒸汽重整制氢
甲醇蒸汽重整制氢过程中有以下化学反应。
资料:产氢率和水碳比(S/C)的定义:
①产氢率=
②水碳比(S/C)表示反应物中H2O和CH3OH的比值,水碳比的变化是以CH3OH不变,改变H2O的物质的量加以控制。
(1)理想产氢率=_______ 。
(2)△H2=_______ kJ·mol-1
(3)针对R1进行讨论:其他条件不变,随着温度升高,n(H2)_______ (填“增大”、“减小”或“不变”),理由是_______ 。
(4)其他条件不变,测得产物摩尔分数(即物质的量分数)随温度的变化如图所示。由图可知,在600-912K时,随着温度升高,氢气的摩尔分数增大,原因是_______ 。

(5)结合资料和图示,提出2条减少积碳的措施_______ 、_______ 。
Ⅱ.电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。使用NaNH2非水电解质研究液氨电解制氢原理,装置示意图如图所示。

资料:2NH3 NH
NH +NH
+NH
(6)①某电极上发生的电极反应为6NH3+6e-=3H2↑+6NH ,该电极为
,该电极为_______ (选填a或b)极。
②写出另一极上发生的电极反应_______ 。
③不考虑其它能量损耗,利用该装置产生1mol氢气时,转移电子的物质的量是_______ mol。
Ⅰ.甲醇蒸汽重整制氢
甲醇蒸汽重整制氢过程中有以下化学反应。
| 编号 | 反应 | 方程式 | △H/kJ·mol-1 |
| R1 | 甲醇蒸汽重整 | CH3OH(g)+H2O(g) CO2(g)+3H2(g) CO2(g)+3H2(g) | △H1=+49.24 |
| R2 | 甲醇分解反应 | CH3OH(g) CO(g)+2H2(g) CO(g)+2H2(g) | △H2 |
| R3 | 水汽反应 | CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) | △H3=-41.17 |
| R4 | 积碳反应 | CO(g)+H2(g) C(s)+H2O(g) C(s)+H2O(g) | △H<0 |
CO2(g)+2H2(g) C(s)+2H2O(g) C(s)+2H2O(g) | △H<0 | ||
2CO(g) C(s)+CO2(g) C(s)+CO2(g) | △H<0 |
资料:产氢率和水碳比(S/C)的定义:
①产氢率=

②水碳比(S/C)表示反应物中H2O和CH3OH的比值,水碳比的变化是以CH3OH不变,改变H2O的物质的量加以控制。
(1)理想产氢率=
(2)△H2=
(3)针对R1进行讨论:其他条件不变,随着温度升高,n(H2)
(4)其他条件不变,测得产物摩尔分数(即物质的量分数)随温度的变化如图所示。由图可知,在600-912K时,随着温度升高,氢气的摩尔分数增大,原因是

(5)结合资料和图示,提出2条减少积碳的措施
Ⅱ.电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。使用NaNH2非水电解质研究液氨电解制氢原理,装置示意图如图所示。

资料:2NH3
 NH
NH +NH
+NH
(6)①某电极上发生的电极反应为6NH3+6e-=3H2↑+6NH
 ,该电极为
,该电极为②写出另一极上发生的电极反应
③不考虑其它能量损耗,利用该装置产生1mol氢气时,转移电子的物质的量是
您最近一年使用:0次
名校
解题方法
6 . 土壤中微生物将大气中的H2S氧化为SO 的变化过程如下图所示。下列说法
的变化过程如下图所示。下列说法不正确 的是

 的变化过程如下图所示。下列说法
的变化过程如下图所示。下列说法
| A.1 mol H2S(g)和1/2mol O2(g)的总能量高于1 mol S(g)和1 mol H2O(g)的总能量 |
B.H2S(g)+ 2O2(g)=SO (aq) +2H+(aq) △H=-806.39kJ/mol (aq) +2H+(aq) △H=-806.39kJ/mol |
C.H2S和SO 中S原子采用的杂化方式不同 中S原子采用的杂化方式不同 |
D.1 mol H2S完全氧化为SO 转移8mol电子 转移8mol电子 |
您最近一年使用:0次
2022-04-16更新
|
447次组卷
|
7卷引用:北京市北京师范大学附属中学2022-2023 学年高三上学期月考2化学试题
北京市北京师范大学附属中学2022-2023 学年高三上学期月考2化学试题北京市顺义区2021-2022学年高三下学期4月第二次统练化学试题(已下线)秘籍15 反应热、盖斯定律应用及图象分析-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项10 化学反应与能量-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)三轮冲刺卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专题08 化学反应中的能量变化(已下线)热点题型训练 盖斯定律在反应热计算中的应用
名校
解题方法
7 . 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟 氧化结合
氧化结合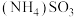 溶液吸收法同时脱除
溶液吸收法同时脱除 和NO的过程示意图如下。
和NO的过程示意图如下。
①已知: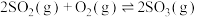
 ,则
,则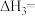
_______ 。
②其他条件不变时,高于150℃,在相同时间内 和NO的转化率均随温度升高而降低,原因是
和NO的转化率均随温度升高而降低,原因是_______ 。
③其他条件不变, 和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内, 和NO的转化率随
和NO的转化率随 的浓度的变化如图。结合数据分析NO的转化率高于
的浓度的变化如图。结合数据分析NO的转化率高于 的原因
的原因_______ 。 和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内, 与NO的物质的量之比对
与NO的物质的量之比对 和NO脱除率的影响如图。
和NO脱除率的影响如图。 溶液显碱性,用化学平衡原理解释:
溶液显碱性,用化学平衡原理解释:_______ 。
② 的浓度很低时,
的浓度很低时, 的脱除率超过97%,原因是
的脱除率超过97%,原因是_______ 。
③在吸收器中, 与
与 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是_______ 。
④在吸收器中,随着吸收过程的进行,部分 被转化为
被转化为 ,反应中
,反应中 和
和 的物质的量之比为1:1,该反应的离子方程式是
的物质的量之比为1:1,该反应的离子方程式是_______ 。
 氧化结合
氧化结合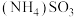 溶液吸收法同时脱除
溶液吸收法同时脱除 和NO的过程示意图如下。
和NO的过程示意图如下。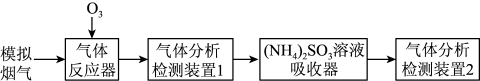
| 反应 | 平衡常数(25℃) | 活化能/(kJ/mol) |
反应a: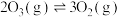 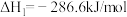 |  | 24.6 |
反应b: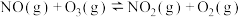 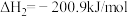 | 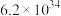 | 3.17 |
反应c:  | 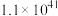 | 58.17 |
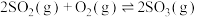
 ,则
,则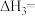
②其他条件不变时,高于150℃,在相同时间内
 和NO的转化率均随温度升高而降低,原因是
和NO的转化率均随温度升高而降低,原因是③其他条件不变,
 和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内, 和NO的转化率随
和NO的转化率随 的浓度的变化如图。结合数据分析NO的转化率高于
的浓度的变化如图。结合数据分析NO的转化率高于 的原因
的原因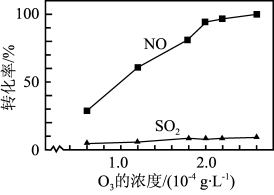
 和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内, 与NO的物质的量之比对
与NO的物质的量之比对 和NO脱除率的影响如图。
和NO脱除率的影响如图。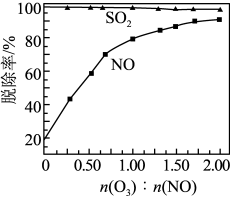
 溶液显碱性,用化学平衡原理解释:
溶液显碱性,用化学平衡原理解释:②
 的浓度很低时,
的浓度很低时, 的脱除率超过97%,原因是
的脱除率超过97%,原因是③在吸收器中,
 与
与 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是④在吸收器中,随着吸收过程的进行,部分
 被转化为
被转化为 ,反应中
,反应中 和
和 的物质的量之比为1:1,该反应的离子方程式是
的物质的量之比为1:1,该反应的离子方程式是
您最近一年使用:0次
2022-04-10更新
|
763次组卷
|
6卷引用:北京市西城区2022届高三一模化学试题
名校
解题方法
8 . 依据图示关系,下列说法不正确 的是


A.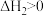 |
| B.1 mol S(g)完全燃烧释放的能量小于2968 kJ |
C. |
| D.16 g S(s)完全燃烧释放的能量为1484 kJ |
您最近一年使用:0次
2022-03-25更新
|
1022次组卷
|
10卷引用:北京市北京师范大学附属实验中学2022-2023学年高二上学期期中考试化学试题
北京市北京师范大学附属实验中学2022-2023学年高二上学期期中考试化学试题北京市丰台区2022届高三一模化学试题辽宁省沈阳市第四十中学2021-2022年高一下学期4月份线上教学效果检测化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)秘籍15 反应热、盖斯定律应用及图象分析-备战2022年高考化学抢分秘籍(全国通用)上海市上海中学2021-2022学年高一下学期期末考试化学试题(已下线)第2讲 盖斯定律 反应热的计算北京市第二十二中学2023-2024学年高二上学期10月月考化学试题北京市中关村中学2023-2024学年高二上学期期中考试化学试题河南省郑州学森实验学校2023-2024学年高二上学期期中考试 化学试题
名校
9 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CO2资源化利用对缓解碳减排压力具有重要意义。在二氧化碳催化加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1
CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
反应III:2CO(g)+2H2(g) CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1
CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1
向恒压、密闭容器中通入1molCO2和4molH2,平衡时体系内CH4、CO、CO2的物质的量(n)与温度(T)的变化关系如图所示。

(1)反应I~III中,属于吸热反应的是____ (填反应序号)。
(2)反应I的平衡常数表达式为____ 。
(3)盖斯定律的重要价值是可以利用已知反应的反应热求得未知反应的反应热,利用上述反应计算CH4(g)+H2O(g) CO(g)+3H2(g)的ΔH=
CO(g)+3H2(g)的ΔH=____ 。
(4)结合上述反应,解释图中CO的物质的量随温度的变化的原因:___ 。
(5)在实际生产中为了提高甲烷的产量,选择的反应条件为较低温度和使用合适的催化剂,从反应原理角度说明选择该反应条件的理由:____ 、____ 。
反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1
CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1反应III:2CO(g)+2H2(g)
 CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1
CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1向恒压、密闭容器中通入1molCO2和4molH2,平衡时体系内CH4、CO、CO2的物质的量(n)与温度(T)的变化关系如图所示。

(1)反应I~III中,属于吸热反应的是
(2)反应I的平衡常数表达式为
(3)盖斯定律的重要价值是可以利用已知反应的反应热求得未知反应的反应热,利用上述反应计算CH4(g)+H2O(g)
 CO(g)+3H2(g)的ΔH=
CO(g)+3H2(g)的ΔH=(4)结合上述反应,解释图中CO的物质的量随温度的变化的原因:
(5)在实际生产中为了提高甲烷的产量,选择的反应条件为较低温度和使用合适的催化剂,从反应原理角度说明选择该反应条件的理由:
您最近一年使用:0次
2022-01-15更新
|
347次组卷
|
4卷引用:北京市第三十五中学2022-2023学年高三上学期 10月月考化学试题
名校
10 . 书写下列化学方程式
(1)下图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式___________ 。

(2)已知:C(s) + O2(g) = CO2(g) ΔH=-437.3 kJ•mol-1
H2(g) +1/2O2(g) = H2O(g) ΔH=-285.8 kJ•mol-1
CO(g) +1/2O2(g) = CO2(g) ΔH=-283.0 kJ•mol-1
则固态碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是___________ 。
(3)已知拆开1mol H-H键、1molN≡N和1mol N—H键分别需要的能量是436kJ、948kJ、391 kJ。则N2、H2合成NH3的热化学方程式为:___________ 。
(4)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。已知存在如下反应:
i.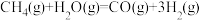

ii.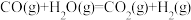

iii.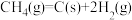

……
iii为积炭反应,利用 和
和 计算
计算 时,还需要利用
时,还需要利用___________ 反应的 。
。
(1)下图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式

(2)已知:C(s) + O2(g) = CO2(g) ΔH=-437.3 kJ•mol-1
H2(g) +1/2O2(g) = H2O(g) ΔH=-285.8 kJ•mol-1
CO(g) +1/2O2(g) = CO2(g) ΔH=-283.0 kJ•mol-1
则固态碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是
(3)已知拆开1mol H-H键、1molN≡N和1mol N—H键分别需要的能量是436kJ、948kJ、391 kJ。则N2、H2合成NH3的热化学方程式为:
(4)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。已知存在如下反应:
i.
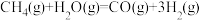

ii.
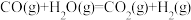

iii.
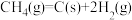

……
iii为积炭反应,利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。
您最近一年使用:0次



