名校
1 . 二甲醚( )是重要的化工原料,可用水煤气(主要成分为CO和
)是重要的化工原料,可用水煤气(主要成分为CO和 )合成。其主要反应原理如下(a、b、c均为正值):
)合成。其主要反应原理如下(a、b、c均为正值):
①
 kJ⋅mol
kJ⋅mol
②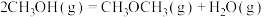
 kJ·mol
kJ·mol
③
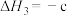 kJ⋅mol
kJ⋅mol
回答下列问题:
(1)总反应的热化学方程式: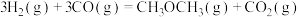

_______ kJ/mol。
(2)以下说法能说明反应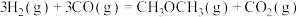 达到化学平衡状态的有
达到化学平衡状态的有_______ 。
a.恒温恒容条件下,气体的密度保持不变
b.恒温恒压条件下,气体的平均摩尔质量保持不变
c.绝热体系中,体系的温度保持不变
(3)生产二甲醚的过程中存在副反应: ,与甲醇脱水反应:
,与甲醇脱水反应: 形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
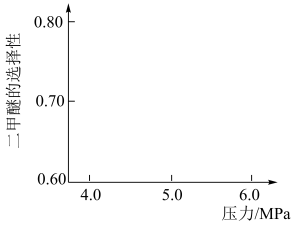
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
分析:温度一定,随压强增大,二甲醚选择性增大的原因是_______ 。
 )是重要的化工原料,可用水煤气(主要成分为CO和
)是重要的化工原料,可用水煤气(主要成分为CO和 )合成。其主要反应原理如下(a、b、c均为正值):
)合成。其主要反应原理如下(a、b、c均为正值):①

 kJ⋅mol
kJ⋅mol
②
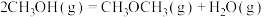
 kJ·mol
kJ·mol
③

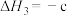 kJ⋅mol
kJ⋅mol
回答下列问题:
(1)总反应的热化学方程式:
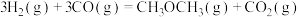

(2)以下说法能说明反应
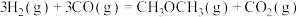 达到化学平衡状态的有
达到化学平衡状态的有a.恒温恒容条件下,气体的密度保持不变
b.恒温恒压条件下,气体的平均摩尔质量保持不变
c.绝热体系中,体系的温度保持不变
(3)生产二甲醚的过程中存在副反应:
 ,与甲醇脱水反应:
,与甲醇脱水反应: 形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
分析:温度一定,随压强增大,二甲醚选择性增大的原因是
您最近一年使用:0次
名校
解题方法
2 . 完成下列问题
(1)0.1mol 完全燃烧生成液态水和
完全燃烧生成液态水和 ,放出88.96kJ热量,
,放出88.96kJ热量, 的燃烧热为
的燃烧热为
___________ kJ/mol。
(2)单斜硫和正交硫转化为 的能量变化图如图。
的能量变化图如图。
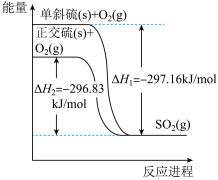
32g单斜硫转化为正交硫的反应热为
___________ kJ/mol,单斜硫比正交硫的稳定性___________ (填“强”或“弱”)。
(3) 和
和 在一定条件下能发生反应:
在一定条件下能发生反应: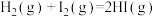
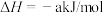
已知:
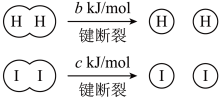 a、b、c均大于零
a、b、c均大于零
断开1mol H-I键所需能量为___________ kJ/mol。
(1)0.1mol
 完全燃烧生成液态水和
完全燃烧生成液态水和 ,放出88.96kJ热量,
,放出88.96kJ热量, 的燃烧热为
的燃烧热为
(2)单斜硫和正交硫转化为
 的能量变化图如图。
的能量变化图如图。
32g单斜硫转化为正交硫的反应热为

(3)
 和
和 在一定条件下能发生反应:
在一定条件下能发生反应:
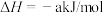
已知:
 a、b、c均大于零
a、b、c均大于零断开1mol H-I键所需能量为
您最近一年使用:0次
名校
3 . 二甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式为:
工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:___________
ii.甲醇脱水反应: ,
,
(1)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为___________ 。
(2)请补全甲醇合成反应 的热化学方程式___________ 。
(3)甲醇脱水反应: ,是制备二甲醚的重要环节。
,是制备二甲醚的重要环节。
①某温度下,该反应的化学平衡常数是360。在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时正反应速率___________ 逆反应速率(填“>”、“<”或“=”)。
②在一定温度下的恒容密闭容器中发生甲醇脱水反应,下列能说明该反应已达到平衡状态的是___________ 。
a.相同时间内消耗CH3OH的物质的量与消耗CH3OCH3的物质的量之比为2:1
b.混合体系内各组分浓度不变
c.恒容密闭容器内的压强不变
(4)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争。

将反应物混合气按进料比 通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的
通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的选择性 如图所示。
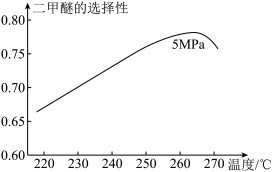
资料:二甲醚的选择性 是指转化为二甲醚的CO在全部转化的CO中所占的比例。温度低于265℃时,随着温度升高二甲醚选择性增加,原因是___________ 。

工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:___________
ii.甲醇脱水反应:
 ,
,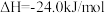
(1)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为
(2)请补全
(3)甲醇脱水反应:
 ,是制备二甲醚的重要环节。
,是制备二甲醚的重要环节。①某温度下,该反应的化学平衡常数是360。在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时正反应速率
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.02 | 0.4 | 0.4 |
a.相同时间内消耗CH3OH的物质的量与消耗CH3OCH3的物质的量之比为2:1
b.混合体系内各组分浓度不变
c.恒容密闭容器内的压强不变
(4)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争。

将反应物混合气按进料比
 通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的
通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的
资料:二甲醚的
您最近一年使用:0次
名校
4 . 碳单质在工业上有多种用途。
(1)焦炭可用于制取水煤气。测得 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了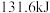 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是___________ 。
(2)活性炭可处理大气污染物 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:

①请结合上表数据,写出 与活性炭反应的化学方程式
与活性炭反应的化学方程式___________ 。
②上述反应 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。
Ⅰ.计算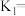
___________ 。
Ⅱ.根据上述信息判断,温度 和
和 的关系是(填序号)
的关系是(填序号)___________ 。
a. b.
b. c.无法比较
c.无法比较
③在T温度下反应达到平衡后,下列措施不能改变 的转化率的是
的转化率的是___________ 。
a.增大 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属。若 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到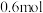 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是___________ 。
(1)焦炭可用于制取水煤气。测得
 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了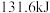 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是(2)活性炭可处理大气污染物
 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出
 与活性炭反应的化学方程式
与活性炭反应的化学方程式②上述反应
 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。Ⅰ.计算
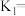
Ⅱ.根据上述信息判断,温度
 和
和 的关系是(填序号)
的关系是(填序号)a.
 b.
b. c.无法比较
c.无法比较③在T温度下反应达到平衡后,下列措施不能改变
 的转化率的是
的转化率的是a.增大
 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F(3)工业上可用焦炭冶炼金属。若
 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到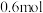 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是
您最近一年使用:0次
名校
5 . 碳氧化物、氮氧化物处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的 ,有利于减少
,有利于减少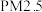 的排放。
的排放。
已知:I.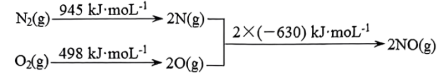
Ⅱ.

①
___________ 。
②在催化剂作用下 和
和 转化为无毒气体,写出反应的热化学方程式
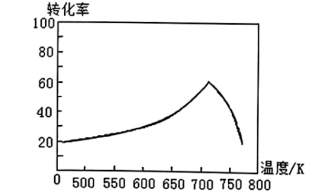
转化为无毒气体,写出反应的热化学方程式___________ 。一定条件下,单位时间内不同温度下测定的氮氧化物转化率如下图所示。温度高于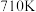 时,随温度的升高氮氧化物转化率降低的原因可能是
时,随温度的升高氮氧化物转化率降低的原因可能是___________ 。
(2)消除燃煤烟气中的 (主要成分为
(主要成分为 、
、 的混合物)可以采用
的混合物)可以采用 溶液吸收脱除。
溶液吸收脱除。 水解的离子方程式是
水解的离子方程式是___________ 。
 溶液吸收
溶液吸收 的主要过程如下:
的主要过程如下:
i. ,
,
ⅱ.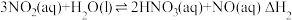 ,
,
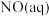 转化为
转化为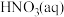 的热化学方程式是
的热化学方程式是___________ 。
研究 对
对 脱除率的影响。调节
脱除率的影响。调节 溶液的初始
溶液的初始 ,
, 的脱除率如下:
的脱除率如下:
 影响
影响 脱除率的原因是
脱除率的原因是___________ 。
(1)消除汽车尾气中的
 ,有利于减少
,有利于减少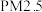 的排放。
的排放。已知:I.

Ⅱ.


①

②在催化剂作用下
 和
和 转化为无毒气体,写出反应的热化学方程式
转化为无毒气体,写出反应的热化学方程式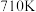 时,随温度的升高氮氧化物转化率降低的原因可能是
时,随温度的升高氮氧化物转化率降低的原因可能是
(2)消除燃煤烟气中的
 (主要成分为
(主要成分为 、
、 的混合物)可以采用
的混合物)可以采用 溶液吸收脱除。
溶液吸收脱除。 水解的离子方程式是
水解的离子方程式是 溶液吸收
溶液吸收 的主要过程如下:
的主要过程如下:i.
 ,
,ⅱ.
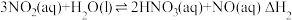 ,
,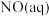 转化为
转化为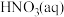 的热化学方程式是
的热化学方程式是研究
 对
对 脱除率的影响。调节
脱除率的影响。调节 溶液的初始
溶液的初始 ,
, 的脱除率如下:
的脱除率如下:初始 | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
 脱除率 脱除率 | 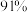 |  |  |  | 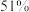 |
 影响
影响 脱除率的原因是
脱除率的原因是
您最近一年使用:0次
名校
6 . 直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
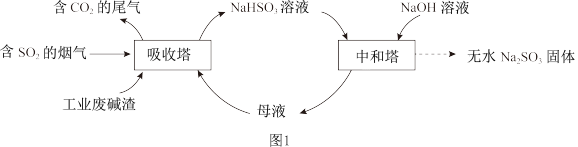
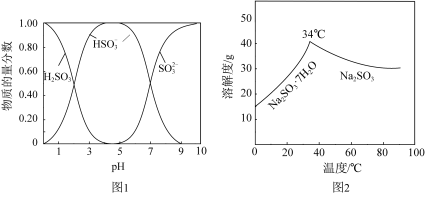
已知:H2SO3、HSO 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_______ 。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_______ 。
②NaHSO3溶液中c(SO )>c(H2SO3),结合方程式解释其原因:
)>c(H2SO3),结合方程式解释其原因:_______ 。
③已知下列反应:
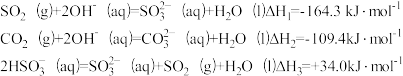
吸收塔中Na2CO3溶液吸收SO2生成HSO 的热化学方程式是
的热化学方程式是_______ 。
④吸收塔中的温度不宜过高,可能的原因是_______ (写出1种即可)。

已知:H2SO3、HSO
 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为
②NaHSO3溶液中c(SO
 )>c(H2SO3),结合方程式解释其原因:
)>c(H2SO3),结合方程式解释其原因:③已知下列反应:
吸收塔中Na2CO3溶液吸收SO2生成HSO
 的热化学方程式是
的热化学方程式是④吸收塔中的温度不宜过高,可能的原因是
您最近一年使用:0次
名校
7 . 工业上制硫酸的主要反应之一为: ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
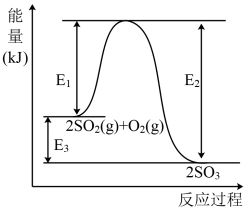
(1)向反应体系中加入催化剂后,图中
___________ (填“增大”、“减小”或“不变”,下同),
___________ 。
(2)已知:
 ;
;
 ;若
;若 与
与 反应产生
反应产生 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为___________ 。
(3)某温度下,反应的起始浓度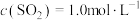 ,
,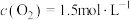 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为___________ 。
(4)在 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=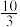 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时正反应速率
,则反应开始时正反应速率___________ (填“>”、“=”或“<”)逆反应速率。
 ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
(1)向反应体系中加入催化剂后,图中


(2)已知:

 ;
;
 ;若
;若 与
与 反应产生
反应产生 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(3)某温度下,反应的起始浓度
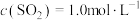 ,
,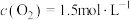 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为(4)在
 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=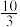 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时正反应速率
,则反应开始时正反应速率
您最近一年使用:0次
名校
8 . CO2减排能有效降低温室效应,同时,CO2也是一种重要的资源,因此CO2捕集与转化技术研究备受关注。
Ⅰ.CO2催化加氢制甲醇
(1)已知:①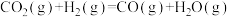

②
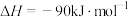
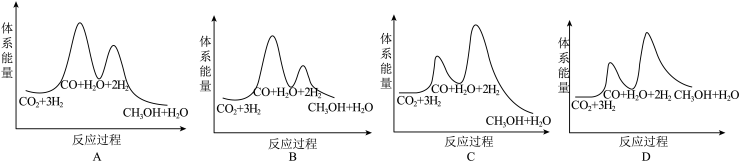
则CO2催化加氢制甲醇的热化学方程式为___________ 。若反应①为慢反应(活化能高),下列图中能体现上述能量变化的是___________ 。
Ⅱ.离子液体聚合物捕集CO2
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如下图1和图2
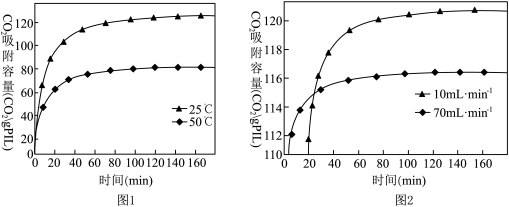
结合图1和图2分析:
①离子液体聚合物捕集CO2的反应为___________ (填“吸热”或“放热”)反应。
②离子液体聚合物捕集CO2的有利条件是___________ 。
(3)CO2捕集过程中水分子的数目对反应有重要影响。图3是离子液体聚合物与1个H2O和2个H2O捕集CO2的反应路径(CO2等部分物质已省略)。结合图3中的反应路径,CO2捕集过程中H2O的作用是___________ 。
Ⅰ.CO2催化加氢制甲醇
(1)已知:①
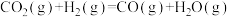

②

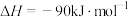
则CO2催化加氢制甲醇的热化学方程式为

Ⅱ.离子液体聚合物捕集CO2
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如下图1和图2

结合图1和图2分析:
①离子液体聚合物捕集CO2的反应为
②离子液体聚合物捕集CO2的有利条件是
(3)CO2捕集过程中水分子的数目对反应有重要影响。图3是离子液体聚合物与1个H2O和2个H2O捕集CO2的反应路径(CO2等部分物质已省略)。结合图3中的反应路径,CO2捕集过程中H2O的作用是

您最近一年使用:0次
名校
解题方法
9 . 我国科学家研发的“液态阳光”计划通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备甲醇。
已知: 产率
产率
(1)制备甲醇的主反应:
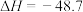 kJ·mol
kJ·mol 。该过程中还存在一个生成CO的副反应,结合反应:
。该过程中还存在一个生成CO的副反应,结合反应:
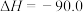 kJ·mol
kJ·mol ,写出该副反应的热化学方程式:
,写出该副反应的热化学方程式:____ 。
(2)为同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,反应条件应选择
的平衡产率,反应条件应选择____ 。
将 和
和 按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
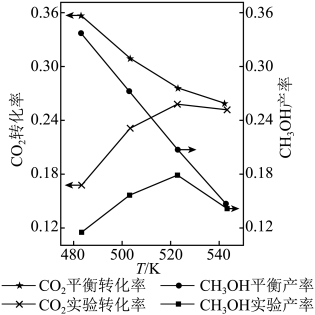
(3)①催化剂活性最好的温度为_____ (填字母序号)。
a.483K b.503K c.523K d.543K
②温度由483K升到523K,_____ (填“主反应”或“副反应”)的反应速率受温度影响更大。
③温度由523K升到543K, 的平衡转化率和
的平衡转化率和 的实验产率均降低,解释原因:
的实验产率均降低,解释原因:_____ 。
④如图,a点对应的坐标为(523K,0.26),b点对应的坐标为(523K,0.18),在523K温度下,b点对应的 的百分含量为
的百分含量为_____ 。
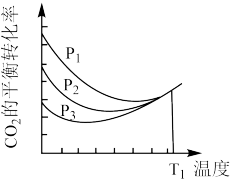
(4)不同压强下,按照 投料,
投料, 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。 时曲线出现拐点的温度高于
时曲线出现拐点的温度高于 时的原因是
时的原因是_____ 。
已知:
 产率
产率
(1)制备甲醇的主反应:

 kJ·mol
kJ·mol 。该过程中还存在一个生成CO的副反应,结合反应:
。该过程中还存在一个生成CO的副反应,结合反应:
 kJ·mol
kJ·mol ,写出该副反应的热化学方程式:
,写出该副反应的热化学方程式:(2)为同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,反应条件应选择
的平衡产率,反应条件应选择将
 和
和 按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/Al/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
(3)①催化剂活性最好的温度为
a.483K b.503K c.523K d.543K
②温度由483K升到523K,
③温度由523K升到543K,
 的平衡转化率和
的平衡转化率和 的实验产率均降低,解释原因:
的实验产率均降低,解释原因:④如图,a点对应的坐标为(523K,0.26),b点对应的坐标为(523K,0.18),在523K温度下,b点对应的
 的百分含量为
的百分含量为(4)不同压强下,按照
 投料,
投料, 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。 时曲线出现拐点的温度高于
时曲线出现拐点的温度高于 时的原因是
时的原因是
您最近一年使用:0次
名校
10 . CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4—CO2催化重整反应为 。
。
已知: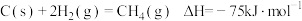
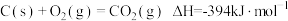
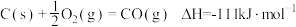
①该催化重整反应的
___________  ,有利于提高CH4平衡转化率的条件是
,有利于提高CH4平衡转化率的条件是___________ (填标号)。
A.高温低压 B低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___________ 。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
①由上表判断,催化剂X___________ Y(填“优于”或“劣于”),理由是___________ 。
②在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如下图所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是___________ (填标号)。
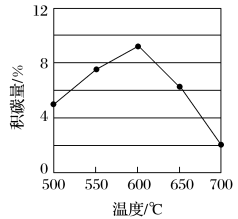
A.K积、K消均增加 B.v积减小、v消增加
C.K积减小、K消增加 D.v消增加的倍数比v积增加的倍数大
(1)CH4—CO2催化重整反应为
 。
。已知:
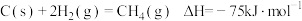
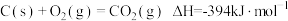
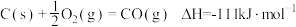
①该催化重整反应的

 ,有利于提高CH4平衡转化率的条件是
,有利于提高CH4平衡转化率的条件是A.高温低压 B低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应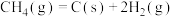 | 消碳反应 | ||
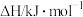 | 75 | 172 | |
| 活化能/kJ·mol﹣1 | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |
②在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如下图所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是

A.K积、K消均增加 B.v积减小、v消增加
C.K积减小、K消增加 D.v消增加的倍数比v积增加的倍数大
您最近一年使用:0次



