解题方法
1 . 回答下列问题。
(1)一定条件下,在 密闭容器中充入
密闭容器中充入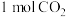 和
和 ,发生反应:
,发生反应: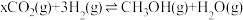 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
___________ ;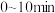 内
内 的平均反应速率
的平均反应速率
___________ 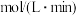 ,平衡时
,平衡时 的转化率为
的转化率为___________ 。
(2)下列措施能提高正反应速率的是___________(填正确答案的字母)。
(3)工业上常以水煤气( 和
和 )为原料合成甲醇。已知:
)为原料合成甲醇。已知: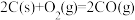
 ;
;
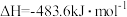 ,则
,则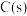 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为___________ 。
(1)一定条件下,在
 密闭容器中充入
密闭容器中充入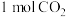 和
和 ,发生反应:
,发生反应: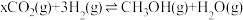 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。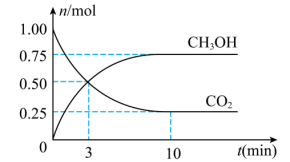

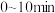 内
内 的平均反应速率
的平均反应速率
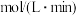 ,平衡时
,平衡时 的转化率为
的转化率为(2)下列措施能提高正反应速率的是___________(填正确答案的字母)。
| A.降低温度 | B.增加 的量 的量 | C.使用催化剂 | D.及时分离出甲醇 |
 和
和 )为原料合成甲醇。已知:
)为原料合成甲醇。已知: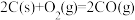
 ;
;
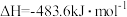 ,则
,则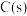 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为
您最近半年使用:0次
2 . 已知胆矾晶体相关的焓变如图所示,则 为
为
 为
为
A.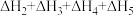 | B.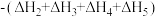 |
C.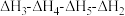 | D.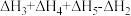 |
您最近半年使用:0次
解题方法
3 . I.甲醇(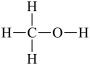 )是重要的化工原料,又可作为燃料。利用合成气(主要成分为
)是重要的化工原料,又可作为燃料。利用合成气(主要成分为 、
、 和
和 )在催化剂的作用下合成甲醇,涉及的反应有:
)在催化剂的作用下合成甲醇,涉及的反应有:
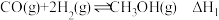
②

③
 与
与 反应生成
反应生成 和
和
已知反应①中的相关的化学键键能数据如下:(
 为
为 )
)| 化学键 |  |  |  |  |  |
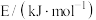 | 436 | 343 | 1076 | 465 | 413 |
(1)

 。
。(2)反应③的热化学方程式为
 用含
用含 和
和 的式子表示)
的式子表示)Ⅱ.亚硝酰氯(
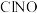 )是有机合成中的重要试剂,可通过反应:
)是有机合成中的重要试剂,可通过反应: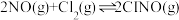 获得。
获得。(3)在恒温恒容的密闭容器中,氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
①
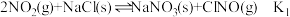
②

③

则

 、
、 的式子表示)。
的式子表示)。下列事实不能说明上述体系中反应③已达平衡状态的是
a.容器内气体的颜色不再变化 b.容器中气体的密度不再变化 c.
 不再发生变化
不再发生变化(4)300℃时,
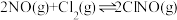 的正反应速率表达式为
的正反应速率表达式为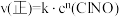 ,测得速率和浓度的关系如表所示:
,测得速率和浓度的关系如表所示:| 序号 | 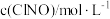 | 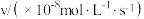 |
| ① | 0.30 | 0.36 |
| ② | 0.60 | 1.44 |
| ③ | 0.90 | 3.24 |
(5)对于反应③按投料比
 把
把 和
和 加入到压强恒为p的密闭容器中发生反应,平衡时
加入到压强恒为p的密闭容器中发生反应,平衡时 的转化率与温度T的关系如图所示:
的转化率与温度T的关系如图所示: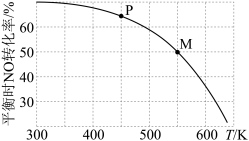
 的体积分数为
的体积分数为②M点的分压平衡常数

(6)一定条件下,在恒温恒容的密闭容器中按一定比例充入
 和
和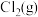 ,平衡时
,平衡时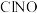 的体积分数随
的体积分数随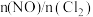 的变化图像如图所示,则A、B、C三状态中,
的变化图像如图所示,则A、B、C三状态中, 的转化率最大的是
的转化率最大的是
您最近半年使用:0次
解题方法
4 . 雾霾主要成分为灰尘、 、
、 和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
(1)以氨气为脱硝剂时,可将 还原为
还原为 。
。
①

②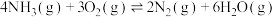

③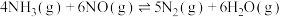


___________  (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
(2)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为: 。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
①
___________  (填“<”、“>”或“无法确定”),该反应的
(填“<”、“>”或“无法确定”),该反应的
___________ 0(填“<”或“>”)。
②0~25 min内乙容器中反应的平均速率:V(O2)___________ 。
③ 温度下,混合气体的起始总压为p,则达到平衡时,
温度下,混合气体的起始总压为p,则达到平衡时, 的转化率为
的转化率为___________ ,平衡常数Kp___________ 。
(3)乙烯也可用于烟气脱硝。为研究温度、催化剂中 负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为
负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为___________ ,催化剂中 负载量为
负载量为___________ 。
 、
、 和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、(1)以氨气为脱硝剂时,可将
 还原为
还原为 。
。①


②
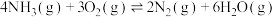

③
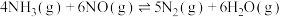


 (用含a、b的代数式表示)。
(用含a、b的代数式表示)。(2)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:
 。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示: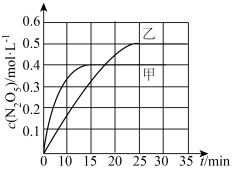
| 容器 | 甲 | 乙 |
| 温度/K |  |  |
| 容积/L | 2 | |
| 起始充入量 | 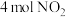 和 和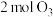 | |

 (填“<”、“>”或“无法确定”),该反应的
(填“<”、“>”或“无法确定”),该反应的
②0~25 min内乙容器中反应的平均速率:V(O2)
③
 温度下,混合气体的起始总压为p,则达到平衡时,
温度下,混合气体的起始总压为p,则达到平衡时, 的转化率为
的转化率为(3)乙烯也可用于烟气脱硝。为研究温度、催化剂中
 负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为
负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为 负载量为
负载量为
您最近半年使用:0次
解题方法
5 . 回答下面各题。
I.近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)=H2O(g)+CO(g) ∆H1=+41.1kJ/mol
CO(g)+2H2(g)=CH3OH(g) ∆H2=-90.0kJ/mol
则CO2催化氢化合成甲醇的热化学方程式:___________ 。
II.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(2)判断反应达到平衡状态的依据是(填字母序号)___________。
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)。
①由表中数据判断该反应的∆H___________ 0(填“>”、“=”或“<”);
②在250℃,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,某时刻测得c(CO)=0.3mol/L,则此时化学反应向___________ 方向移动 (填“正向”,“逆向”或“平衡”)。
III.在一定条件下, A(g)+3B(g) C(g)+D(g) ∆H=-49.0kJ/mol,体系中A的平衡转化率(α)与L和X的关系如图所示,L和X分别表示温度或压强。
C(g)+D(g) ∆H=-49.0kJ/mol,体系中A的平衡转化率(α)与L和X的关系如图所示,L和X分别表示温度或压强。___________ 。
(5)判断L1与L2的大小关系:L1___________ L2 (填“<”,“=”或“>”)。
I.近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)=H2O(g)+CO(g) ∆H1=+41.1kJ/mol
CO(g)+2H2(g)=CH3OH(g) ∆H2=-90.0kJ/mol
则CO2催化氢化合成甲醇的热化学方程式:
II.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)(2)判断反应达到平衡状态的依据是(填字母序号)___________。
| A.生成CH3OH的速率与消耗CO的速率相等 |
| B.CH3OH、CO、H2的浓度都不再发生变化 |
| C.混合气体的相对平均分子质量不变 |
| D.混合气体的密度不变 |
| 温度℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②在250℃,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,某时刻测得c(CO)=0.3mol/L,则此时化学反应向
III.在一定条件下, A(g)+3B(g)
 C(g)+D(g) ∆H=-49.0kJ/mol,体系中A的平衡转化率(α)与L和X的关系如图所示,L和X分别表示温度或压强。
C(g)+D(g) ∆H=-49.0kJ/mol,体系中A的平衡转化率(α)与L和X的关系如图所示,L和X分别表示温度或压强。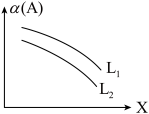
(5)判断L1与L2的大小关系:L1
您最近半年使用:0次
6 . 已知① ②C2H5OH(g)=C2H5OH(l)
②C2H5OH(g)=C2H5OH(l) 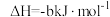 ,③
,③ (a、b、c均>0)。若使
(a、b、c均>0)。若使 酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位:
酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位: )
)
 ②C2H5OH(g)=C2H5OH(l)
②C2H5OH(g)=C2H5OH(l) 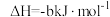 ,③
,③ (a、b、c均>0)。若使
(a、b、c均>0)。若使 酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位:
酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位: )
)A.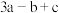 | B.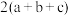 | C.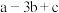 | D.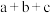 |
您最近半年使用:0次
7 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。我国科学家研究 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
反应Ⅰ.
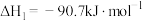
反应Ⅱ.

反应Ⅲ.
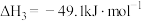
(1)反应Ⅱ的
___________ 
(2)下列措施有利于提高甲醇平衡产率的是___________(填字母)。
(3)反应III的平衡常数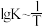 ,的变化关系应为下图的曲线
,的变化关系应为下图的曲线___________ (填“①”或“②”) 时,往某密闭容器中按投料比
时,往某密闭容器中按投料比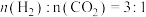 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ (填化学式)。
②体系中 的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的
的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的___________ 反应和反应Ⅲ的___________ 反应(填“正向”或“逆向”)。
(5)T℃时,将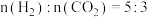 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。)
为用气体分压表示的平衡常数,分压=物质的量分数×总压。)
反应Ⅱ:
反应Ⅲ:
反应达到平衡状态时, 和
和 的分压相等,甲醇的选择性(产率)是CO的2倍,则
的分压相等,甲醇的选择性(产率)是CO的2倍,则 的平衡转化率为
的平衡转化率为___________ ,反应Ⅲ的
___________ 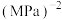 (列出计算式即可)。
(列出计算式即可)。
 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:反应Ⅰ.

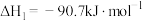
反应Ⅱ.


反应Ⅲ.

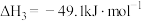
(1)反应Ⅱ的


(2)下列措施有利于提高甲醇平衡产率的是___________(填字母)。
| A.加入适量CO | B.使用催化剂 |
| C.循环利用原料气 | D.升高温度 |
(3)反应III的平衡常数
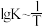 ,的变化关系应为下图的曲线
,的变化关系应为下图的曲线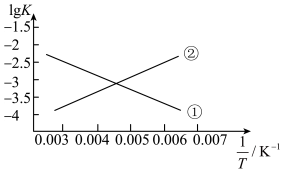
 时,往某密闭容器中按投料比
时,往某密闭容器中按投料比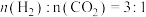 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
②体系中
 的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的
的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的(5)T℃时,将
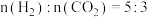 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。)
为用气体分压表示的平衡常数,分压=物质的量分数×总压。)反应Ⅱ:

反应Ⅲ:

反应达到平衡状态时,
 和
和 的分压相等,甲醇的选择性(产率)是CO的2倍,则
的分压相等,甲醇的选择性(产率)是CO的2倍,则 的平衡转化率为
的平衡转化率为
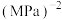 (列出计算式即可)。
(列出计算式即可)。
您最近半年使用:0次
解题方法
8 . 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g) H= +133 kJ/mol
H= +133 kJ/mol
H2O(g)=H2O(l) H=- 44 kJ/mol
H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___________ 。
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是___________ 。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH 和SO
和SO 。物质A的化学式为
。物质A的化学式为___________ ,阴极的电极反应式是___________ 。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g)
 H= +133 kJ/mol
H= +133 kJ/molH2O(g)=H2O(l)
 H=- 44 kJ/mol
H=- 44 kJ/mol催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH
 和SO
和SO 。物质A的化学式为
。物质A的化学式为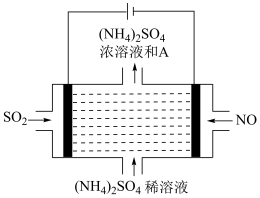
您最近半年使用:0次
解题方法
9 . 以  为原料合成
为原料合成  的反应是研究热点之一,该反应体系涉及的反应如下:
的反应是研究热点之一,该反应体系涉及的反应如下:
I.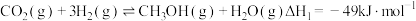
II.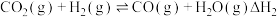
回答下列问题:
(1)已知 和101kPa下,
和101kPa下, 的燃烧热分别为
的燃烧热分别为  、
、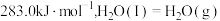
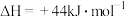 ,则∆H2=
,则∆H2=___________ kJ/mol。
(2)在恒压密闭容器中,按照 投料进行反应,反应I、
投料进行反应,反应I、 以物质的分压表示的平衡常数
以物质的分压表示的平衡常数 随温度
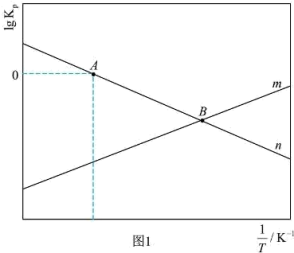
随温度  的变化关系如下图1所示(体系总压为
的变化关系如下图1所示(体系总压为 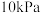 )。
)。 对应图1中
对应图1中___________ (填:“ ” 或“
” 或“ ”);
”);  点对应温度下体系达到平衡时
点对应温度下体系达到平衡时  的转化率为
的转化率为  ,反应I的Kp=
,反应I的Kp=___________ kPa-2 (保留两位有效数字)。
②通过调整温度可调控平衡时 的值。
的值。 点对应温度下,平衡时
点对应温度下,平衡时  ,则p(H2)=
,则p(H2)= ___________ kPa 。
(3)在密闭容器中,保持投料比不变,将 和
和 按一定流速通过反应器,一段时间后,测得
按一定流速通过反应器,一段时间后,测得  转化率
转化率 和甲醇选择性
和甲醇选择性 随温度
随温度 变化关系如上图2所示。
变化关系如上图2所示。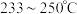 催化剂的活性受温度影响不大,则
催化剂的活性受温度影响不大,则 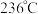 图中曲线下降的原因是
图中曲线下降的原因是___________ ;
②若气体流速过大, 的转化率会降低,原因是
的转化率会降低,原因是___________ 。
(4)向恒温恒压的两个密闭容器甲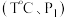 、乙
、乙 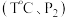 中,分别充入物质的量均为
中,分别充入物质的量均为 的
的  和
和  ,若只发生反应
,若只发生反应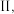 其正反应速率
其正反应速率  为气体分压。若甲、乙容器平衡时正反应速率之比
为气体分压。若甲、乙容器平衡时正反应速率之比 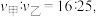 则甲、乙容器的体积之比为
则甲、乙容器的体积之比为___________ 。
 为原料合成
为原料合成  的反应是研究热点之一,该反应体系涉及的反应如下:
的反应是研究热点之一,该反应体系涉及的反应如下:I.
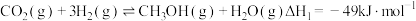
II.
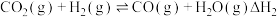
回答下列问题:
(1)已知
 和101kPa下,
和101kPa下, 的燃烧热分别为
的燃烧热分别为  、
、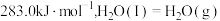
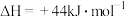 ,则∆H2=
,则∆H2=(2)在恒压密闭容器中,按照
 投料进行反应,反应I、
投料进行反应,反应I、 以物质的分压表示的平衡常数
以物质的分压表示的平衡常数 随温度
随温度  的变化关系如下图1所示(体系总压为
的变化关系如下图1所示(体系总压为 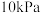 )。
)。
 对应图1中
对应图1中 ” 或“
” 或“ ”);
”);  点对应温度下体系达到平衡时
点对应温度下体系达到平衡时  的转化率为
的转化率为  ,反应I的Kp=
,反应I的Kp=②通过调整温度可调控平衡时
 的值。
的值。 点对应温度下,平衡时
点对应温度下,平衡时  ,则p(H2)=
,则p(H2)= (3)在密闭容器中,保持投料比不变,将
 和
和 按一定流速通过反应器,一段时间后,测得
按一定流速通过反应器,一段时间后,测得  转化率
转化率 和甲醇选择性
和甲醇选择性 随温度
随温度 变化关系如上图2所示。
变化关系如上图2所示。
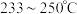 催化剂的活性受温度影响不大,则
催化剂的活性受温度影响不大,则 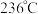 图中曲线下降的原因是
图中曲线下降的原因是②若气体流速过大,
 的转化率会降低,原因是
的转化率会降低,原因是(4)向恒温恒压的两个密闭容器甲
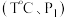 、乙
、乙 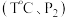 中,分别充入物质的量均为
中,分别充入物质的量均为 的
的  和
和  ,若只发生反应
,若只发生反应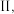 其正反应速率
其正反应速率  为气体分压。若甲、乙容器平衡时正反应速率之比
为气体分压。若甲、乙容器平衡时正反应速率之比 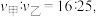 则甲、乙容器的体积之比为
则甲、乙容器的体积之比为
您最近半年使用:0次
10 . 回答下列问题。
(1)根据所学知识回答下列问题:
(1)已知:①N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.0kJ·mol-1;
②H2(g)+ O2(g)=H2O(g) ΔH=-240.0kJ·mol-1;
O2(g)=H2O(g) ΔH=-240.0kJ·mol-1;
③2Fe(s)+ O2(g)=Fe2O3(s) ΔH=-1644.0kJ·mol-1
O2(g)=Fe2O3(s) ΔH=-1644.0kJ·mol-1
则反应2NH3(g)+Fe2O3(s)=N2(g)+3H2O(g)+2Fe(s) ΔH=___________ kJ·mol-1.
(2)反应NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH2=+72.49kJ·mol-1自发进行的条件是___________ (填“高温”或“低温”)。
(3)工业上以含SO2的废气为原料,用电化学的方法制取硫酸的装置图如下:___________ 。
(4)常温下,pH=3的醋酸溶液中,由水电离产生的
___________ mol∙L−1.
(5)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合后溶液呈___________ (填“酸性”“碱性”或“中性”)
(6)KAl(SO4)2‧12H2O可用作净水剂,其原理是___________ (用离子方程式说明)。
(7)已知常温下,Ka(HCN)=6.2×10-10。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显___________ (填“酸”“碱”或“中”)性。
(8)某 溶液中含有
溶液中含有 杂质,溶液中
杂质,溶液中 的浓度为0.020mol∙L−1,通常认为残留在溶液中的离子浓度小于
的浓度为0.020mol∙L−1,通常认为残留在溶液中的离子浓度小于 时即沉淀完全(注:lg5=0.7),已知
时即沉淀完全(注:lg5=0.7),已知 ,
,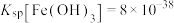 ,若将该溶液的pH调至4.0,
,若将该溶液的pH调至4.0,___________ (填“是”或“否”)可以达到除去 杂质而不损失
杂质而不损失 的目的。
的目的。
(1)根据所学知识回答下列问题:
(1)已知:①N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.0kJ·mol-1;
②H2(g)+
 O2(g)=H2O(g) ΔH=-240.0kJ·mol-1;
O2(g)=H2O(g) ΔH=-240.0kJ·mol-1;③2Fe(s)+
 O2(g)=Fe2O3(s) ΔH=-1644.0kJ·mol-1
O2(g)=Fe2O3(s) ΔH=-1644.0kJ·mol-1则反应2NH3(g)+Fe2O3(s)=N2(g)+3H2O(g)+2Fe(s) ΔH=
(2)反应NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH2=+72.49kJ·mol-1自发进行的条件是
(3)工业上以含SO2的废气为原料,用电化学的方法制取硫酸的装置图如下:
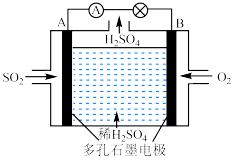
(4)常温下,pH=3的醋酸溶液中,由水电离产生的

(5)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合后溶液呈
(6)KAl(SO4)2‧12H2O可用作净水剂,其原理是
(7)已知常温下,Ka(HCN)=6.2×10-10。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
(8)某
 溶液中含有
溶液中含有 杂质,溶液中
杂质,溶液中 的浓度为0.020mol∙L−1,通常认为残留在溶液中的离子浓度小于
的浓度为0.020mol∙L−1,通常认为残留在溶液中的离子浓度小于 时即沉淀完全(注:lg5=0.7),已知
时即沉淀完全(注:lg5=0.7),已知 ,
,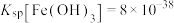 ,若将该溶液的pH调至4.0,
,若将该溶液的pH调至4.0, 杂质而不损失
杂质而不损失 的目的。
的目的。
您最近半年使用:0次



