1 . 第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2(g)+O2(g) 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1
反应H2(g)+Se(s) H2Se(g)的反应热△H=
H2Se(g)的反应热△H=___________ kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是___________ (填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
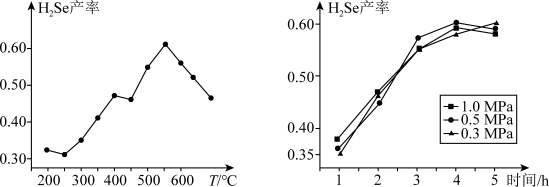
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:___________ 。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈___________ (填“酸性”或“碱性”),该溶液中的物料守恒关系式为___________ 。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________ ,最后通入SO2析出硒单质。
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=___________ (保留2位有效数字)。
(1)已知:①2H2Se(g)+O2(g)
 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1②2H2(g)+O2(g)
 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1反应H2(g)+Se(s)
 H2Se(g)的反应热△H=
H2Se(g)的反应热△H=(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s)
 H2Se(g),
H2Se(g),①下列情况可判断反应达到平衡状态的是
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq)
 CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=
您最近半年使用:0次
2 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的
___________  ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填标号)。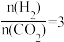 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为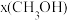 ,在
,在 ℃下的
℃下的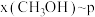 、在
、在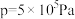 下的
下的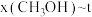 如图所示。
如图所示。
___________ ;
②图中对应等压过程的曲线是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率
___________ ,反应条件可能为___________ 或___________ 。
(1)二氧化碳加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
①

②

总反应的

 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是A. 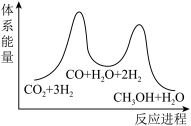 B.
B.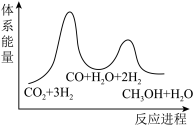
C. D.
D.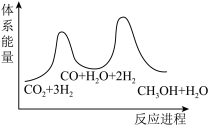
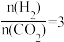 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为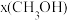 ,在
,在 ℃下的
℃下的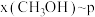 、在
、在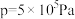 下的
下的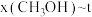 如图所示。
如图所示。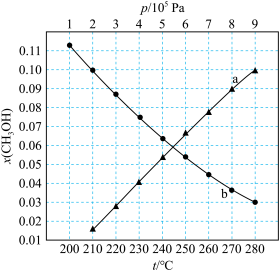

②图中对应等压过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率
您最近半年使用:0次
名校
解题方法
3 . 最新一期国际学术期刊《自然纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇 .
.
(1)该法利用 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下:
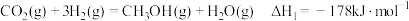
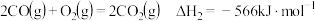
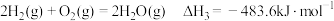
已知:i.断开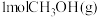 中的化学键共吸收
中的化学键共吸收 的能量
的能量
ⅱ.反应①中部分化学键键能数据如下:
由此计算断开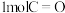 需要吸收
需要吸收_______  的能量,
的能量,
______  。
。
(2)将甲醇完全燃烧生成液态水的反应设计成原电池,以 为电解质.工作时负极的电极反应式
为电解质.工作时负极的电极反应式_____________________ 。
 .
.(1)该法利用
 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下: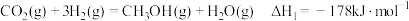
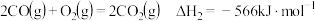
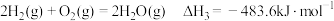
已知:i.断开
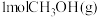 中的化学键共吸收
中的化学键共吸收 的能量
的能量ⅱ.反应①中部分化学键键能数据如下:
化学键 |
|
|
键能 | 436 | 463 |
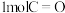 需要吸收
需要吸收 的能量,
的能量,
 。
。(2)将甲醇完全燃烧生成液态水的反应设计成原电池,以
 为电解质.工作时负极的电极反应式
为电解质.工作时负极的电极反应式
您最近半年使用:0次
解题方法
4 . Ⅰ.现有部分元素的性质与原子(或分子)结构如表所示:
回答下列问题:
(1)T是_______ (填元素符号)。元素X在周期表的位置_______ 。
(2)Y与Z相比,金属性较强的是_____ (填元素符号),下列表述中能证明这一事实的是_______ (填标号)。
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于_______ 氧化物(“酸性”、“碱性”或“两性”),写出Y、Z最高价氧化物对应水化物反应的离子方程式____ 。
Ⅱ.2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
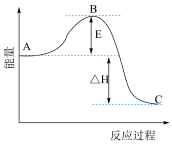
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示_______ 、_______ 。
(5)图中△H=_______ kJ·mol-1。
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H_______ 。
元素 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,是空气的主要成分,分子比较稳定 |
| Y | M层比K层少一个电子 |
| Z | 有三个电子层,M层上有3个电子 |
(1)T是
(2)Y与Z相比,金属性较强的是
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于
Ⅱ.2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示
(5)图中△H=
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H
您最近半年使用:0次
5 . 下列叙述正确的是
A.可逆反应X(g)+Y(g) Z(g)+W(s) ∆H>0,平衡后加入X,∆H增大 Z(g)+W(s) ∆H>0,平衡后加入X,∆H增大 |
B.反应CO(g)+H2O(g) CO2(g)+H2(g) ∆H<0,其他条件不变时升高温度,反应速率加快,反应放出的热量不变 CO2(g)+H2(g) ∆H<0,其他条件不变时升高温度,反应速率加快,反应放出的热量不变 |
| C.根据反应CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) H =-2878 kJ·mol−1 ;(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);H =-2869kJ·mol−1可知异丁烷的稳定性大于正丁烷 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
您最近半年使用:0次
名校
解题方法
6 . 长征五号B运载火箭是中国近地轨道运载能力最大的新一代运载火箭,承担中国空间站舱段发射任务.采用液氧、液氢作为推进剂.回答下列问题:
(1)与偏二甲肼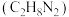 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是___________ ;
(2)已知: ;
;
 ;
;
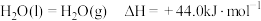 ;
;
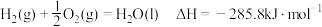 .
.
请写出液氢和液氧生成气态水的热化学方程式:______________ ,氢气的燃烧热
________ ;
(3)如果长征五号B运载火箭所携带的燃料为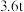 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量________  (保留3位有效数字);
(保留3位有效数字);
(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,________ 能转化为化学能;
②由图可知, 转化为
转化为 的催化剂是
的催化剂是________ (填字母)。
A. B.
B. C.
C. D.紫外线
D.紫外线
(1)与偏二甲肼
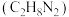 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是(2)已知:
 ;
; ;
;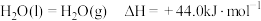 ;
;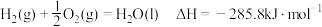 .
.请写出液氢和液氧生成气态水的热化学方程式:

(3)如果长征五号B运载火箭所携带的燃料为
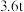 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量 (保留3位有效数字);
(保留3位有效数字);(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,
②由图可知,
 转化为
转化为 的催化剂是
的催化剂是A.
 B.
B. C.
C. D.紫外线
D.紫外线
您最近半年使用:0次
名校
7 . 已知Fe2O2(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+
CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+ O2(g)=Fe2O3(s)的△H是
O2(g)=Fe2O3(s)的△H是
 C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+
CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+ O2(g)=Fe2O3(s)的△H是
O2(g)=Fe2O3(s)的△H是| A.-824.4kJ·mol-1 | B.-627.6kJ·mol-1 |
| C.-744.7kJ·mol-1 | D.-169.4kJ·mol-1 |
您最近半年使用:0次
2024-03-18更新
|
293次组卷
|
3卷引用:云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题
8 . 磷酸是重要的化学试剂和工业原料。回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
向NaF溶液中滴加少量 溶液,反应的离子方程式为
溶液,反应的离子方程式为___________ 。
(2)已知:
Ⅰ. CaO(s)+H2SO4(l) CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 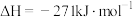
Ⅱ.

①工业上用 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为___________ 。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___________ (填“增大”“减小”“不变”,下同);HF的平衡浓度___________ 。
(3)工业上用磷尾矿制备 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
___________ ,该反应的平衡常数K=___________ 。
②在压强不变的密闭容器中发生上述反应,设起始的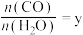 ,CO的平衡体积分数
,CO的平衡体积分数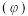 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。

则:该反应的
___________ 0(填“>”“<”或“=”,下同),a___________ 1。
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
| 物质 |  |  |
| 电离常数 |  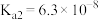 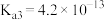 |  |
 溶液,反应的离子方程式为
溶液,反应的离子方程式为(2)已知:
Ⅰ. CaO(s)+H2SO4(l)
 CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 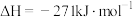
Ⅱ.


①工业上用
 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率
(3)工业上用磷尾矿制备
 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和
 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
②在压强不变的密闭容器中发生上述反应,设起始的
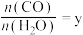 ,CO的平衡体积分数
,CO的平衡体积分数 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。
则:该反应的

您最近半年使用:0次
名校
9 . 以 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
I.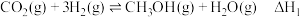
Ⅱ.
Ⅲ.
回答下列问题:
(1)计算反应I的
___________  ,该反应在
,该反应在___________ (填“高温”、“低温”或“任意温度”)下能自发。
(2)在 下,按照
下,按照 投料,假设只发生反应I和Ⅱ,平衡时,
投料,假设只发生反应I和Ⅱ,平衡时, 和
和 在含碳产物物质的量分数及
在含碳产物物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图:
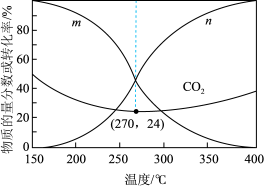
①图中代表 的曲线为
的曲线为___________ (填“m”或“n”)。
②解释 范围内
范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因___________ 。
③下列说法正确的是___________ (填字母)。
A.温度越高,越有利于工业生产
B. 范围内,温度升高,
范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大
C.随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态
④已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ;则
;则 时
时 的分压为
的分压为___________  (用最简分数),反应II的平衡常数
(用最简分数),反应II的平衡常数 为
为___________ (列出算式即可)。
 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:I.
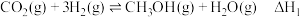
Ⅱ.

Ⅲ.

回答下列问题:
(1)计算反应I的

 ,该反应在
,该反应在(2)在
 下,按照
下,按照 投料,假设只发生反应I和Ⅱ,平衡时,
投料,假设只发生反应I和Ⅱ,平衡时, 和
和 在含碳产物物质的量分数及
在含碳产物物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图:
①图中代表
 的曲线为
的曲线为②解释
 范围内
范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因③下列说法正确的是
A.温度越高,越有利于工业生产

B.
 范围内,温度升高,
范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大C.随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态
④已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ;则
;则 时
时 的分压为
的分压为 (用最简分数),反应II的平衡常数
(用最简分数),反应II的平衡常数 为
为
您最近半年使用:0次
2024-03-02更新
|
109次组卷
|
2卷引用:湖南省宁乡市第一高级中学2021届高三第三次模拟考试化学试卷
10 .  的固定和利用对降低温室气体排放具有重要作用,
的固定和利用对降低温室气体排放具有重要作用, 加氢合成甲醇不仅可以有效缓解减排压力,而且还是
加氢合成甲醇不仅可以有效缓解减排压力,而且还是 综合利用的一条新途径。
综合利用的一条新途径。 加氢过程,主要发生的两个竞争反应为:
加氢过程,主要发生的两个竞争反应为:
i.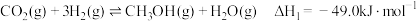
ii.
回答下列问题:
(1)由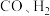 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为___________ 。
(2)在某催化剂作用下, 和
和 除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将
除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经过相同时间测得实验数据:
按一定流速通过该催化剂,经过相同时间测得实验数据:
注:甲醇的选择性是指发生反应的 中转化为甲醇的百分比。
中转化为甲醇的百分比。
表中数据说明,升高温度, 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是___________ 。
(3)恒温恒压条件下(此时甲醇为气态),发生反应i(此时不考虑反应ii)。在开始为 的密闭容器中充入
的密闭容器中充入 和
和 ,达平衡时
,达平衡时 的转化率为50%,则反应i的
的转化率为50%,则反应i的
___________ 。
(4)反应i可能的反应历程下图所示。
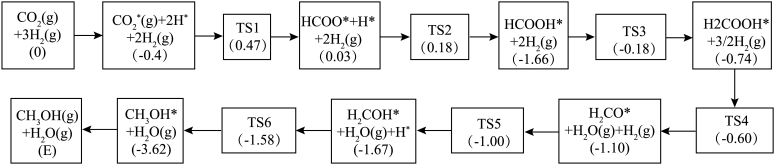
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位: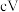 )。其中,
)。其中, 表示过渡态、*表示吸附在催化剂上的微粒。
表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的快速步骤的反应方程式为___________ 。
②相对总能量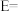
___________  (计算结果保留2位小数)。(已知:
(计算结果保留2位小数)。(已知: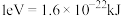 )
)
(5)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入 电解,在阴极可制得低密度聚乙烯
电解,在阴极可制得低密度聚乙烯 (简称
(简称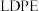 )。
)。
①电解时,阴极的电极反应式是___________ 。
②工业上生产 的
的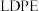 ,理论上需要标准状况下
,理论上需要标准状况下___________ L的 。
。
 的固定和利用对降低温室气体排放具有重要作用,
的固定和利用对降低温室气体排放具有重要作用, 加氢合成甲醇不仅可以有效缓解减排压力,而且还是
加氢合成甲醇不仅可以有效缓解减排压力,而且还是 综合利用的一条新途径。
综合利用的一条新途径。 加氢过程,主要发生的两个竞争反应为:
加氢过程,主要发生的两个竞争反应为:i.
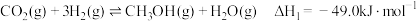
ii.

回答下列问题:
(1)由
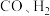 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为(2)在某催化剂作用下,
 和
和 除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将
除发生反应i外,还发生反应ii.维持压强不变,按固定初始投料比将 和
和 按一定流速通过该催化剂,经过相同时间测得实验数据:
按一定流速通过该催化剂,经过相同时间测得实验数据: |  实际转化率(%) 实际转化率(%) | 甲醇选择性(%) |
| 673 | 22.3 | 63.2 |
| 773 | 25.7 | 49.1 |
 中转化为甲醇的百分比。
中转化为甲醇的百分比。表中数据说明,升高温度,
 的实际转化率提高而甲醇的选择性降低,其原因是
的实际转化率提高而甲醇的选择性降低,其原因是(3)恒温恒压条件下(此时甲醇为气态),发生反应i(此时不考虑反应ii)。在开始为
 的密闭容器中充入
的密闭容器中充入 和
和 ,达平衡时
,达平衡时 的转化率为50%,则反应i的
的转化率为50%,则反应i的
(4)反应i可能的反应历程下图所示。

注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:
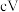 )。其中,
)。其中, 表示过渡态、*表示吸附在催化剂上的微粒。
表示过渡态、*表示吸附在催化剂上的微粒。①反应历程中,生成甲醇的快速步骤的反应方程式为
②相对总能量
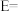
 (计算结果保留2位小数)。(已知:
(计算结果保留2位小数)。(已知: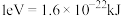 )
)(5)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入
 电解,在阴极可制得低密度聚乙烯
电解,在阴极可制得低密度聚乙烯 (简称
(简称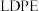 )。
)。①电解时,阴极的电极反应式是
②工业上生产
 的
的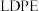 ,理论上需要标准状况下
,理论上需要标准状况下 。
。
您最近半年使用:0次






