名校
1 . 工业上,一氧化碳是一碳化学的基础,可用于物质的合成与纯化等。
(1)二氧化碳和木炭还原法是工业制备CO的方法之一,利用如图关系计算:C(石墨)

___________ 。

(2)羰基硫(COS)是一种粮食熏蒸剂,能防止某些昆虫和真菌的危害,一氧化碳可用于羰基硫的合成。在容积不变的密闭容器中,使CO和H2S发生下列反应并达到平衡: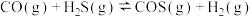

①若反应前CO物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1。下列说法正确的是___________ (填字母)。
a.通入CO后,正反应速率逐渐增大
b.反应前H2S物质的量为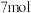
c.达到平衡时CO的转化率为80%
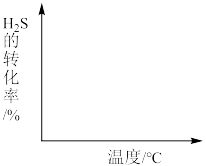
②画出在不同温度下达到化学平衡时,H2S的转化率随温度变化示意图___________ (画出变化趋势即可)。
③已知羰基硫(COS)分子中所有原子的最外层都满足8电子结构,则下列有关说法正确的是________ 。
A.羰基硫属于非极性分子
B.羰基硫的沸点比CO2低
C.羰基硫分子中三个原子处于同一直线上
(3)羰化冶金工艺是气化冶金技术的重要分支,其原理是利用Ⅷ族过渡金属与一氧化碳反应,生成易挥发的羰基化合物进行分离提取金属的一种方法。以某镍合金为原料的羰基工艺流程如下图所示:

“热交换”步骤涉及的反应有:
I.
II.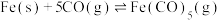
III.
IV.
①温度不变时提高反应I中Ni(CO)4的产率,可采取的措施___________ (答一条即可)。
②Ni(CO)4的沸点为:43℃,其分解温度也只有60℃,Fe(CO)5的沸点为:106℃,精馏的温度范围应控制在___________ ℃。
③实际生产中要调整合成原料中铜元素与硫元素的质量比为___________ 。
④Cu、Au不在VIII族,不易生成羰基化合物。在元素周期表中Au跟Cu处在同一列,则Au位于_____ 族。
(1)二氧化碳和木炭还原法是工业制备CO的方法之一,利用如图关系计算:C(石墨)



(2)羰基硫(COS)是一种粮食熏蒸剂,能防止某些昆虫和真菌的危害,一氧化碳可用于羰基硫的合成。在容积不变的密闭容器中,使CO和H2S发生下列反应并达到平衡:
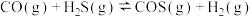

①若反应前CO物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1。下列说法正确的是
a.通入CO后,正反应速率逐渐增大
b.反应前H2S物质的量为
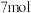
c.达到平衡时CO的转化率为80%
②画出在不同温度下达到化学平衡时,H2S的转化率随温度变化示意图

③已知羰基硫(COS)分子中所有原子的最外层都满足8电子结构,则下列有关说法正确的是
A.羰基硫属于非极性分子
B.羰基硫的沸点比CO2低
C.羰基硫分子中三个原子处于同一直线上
(3)羰化冶金工艺是气化冶金技术的重要分支,其原理是利用Ⅷ族过渡金属与一氧化碳反应,生成易挥发的羰基化合物进行分离提取金属的一种方法。以某镍合金为原料的羰基工艺流程如下图所示:

“热交换”步骤涉及的反应有:
I.

II.
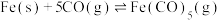
III.

IV.

①温度不变时提高反应I中Ni(CO)4的产率,可采取的措施
②Ni(CO)4的沸点为:43℃,其分解温度也只有60℃,Fe(CO)5的沸点为:106℃,精馏的温度范围应控制在
③实际生产中要调整合成原料中铜元素与硫元素的质量比为
④Cu、Au不在VIII族,不易生成羰基化合物。在元素周期表中Au跟Cu处在同一列,则Au位于
您最近半年使用:0次
2 . 硫、氮元素形成的有毒有害气体对大气造成严重污染,研究它们的转化关系对消除污染有重要指导作用。已知:标准生成焓是指298K,100kPa条件下,由最稳定的单质生成单位物质的量的纯物质的热效应,△H=生成物标准生成焓总和﹣反应物标准生成焓总和。
(1)写出NO2氧化SO2的热化学方程式___________ 。(已知NO2自身被还原为NO)
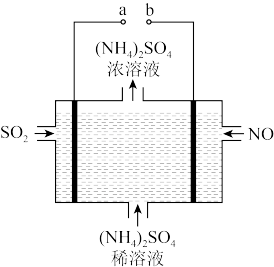
(2)可用如图电解装置将雾霾中的NO、SO2转化为(NH4)2SO4,则a接电源的___________ 极,阴极的电极反应式为___________ 。
(3)按投料比n(NO):n(Cl2)=2:1将NO和Cl2加入到恒压密闭容器中,发生反应2NO(g)+Cl2(g)⇌2NOCl(g),平衡时NO的转化率与温度的关系如图所示。
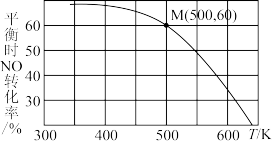
①反应的△H___________ 0。(填“>”或“<”)
②已知总压pMPa,M点时容器内Cl2的转化率为___________ 。M点的平衡常数Kp=___________ MPa﹣1(Kp为以平衡分压表示的平衡常数:平衡分压=总压×体积分数)。
(4)利用现代传感技术探究压强对2NO2(g)⇌N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
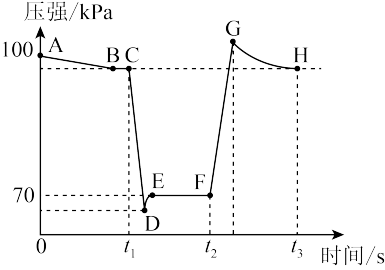
①B、E两点对应的反应速率大小为vB(逆)___________ vE(正)(填“>”、“<”或“=”)。
②F、H两点对应气体的平均相对分子质量较小的点为___________ 。(填字母序号)
| 物质 | 标准生成焓(kJ/mol) | 物质 | 标准生成焓(kJ/mol) |
| O2(g) | 0 | SO2(g) | ﹣296.9 |
| N2(g) | 0 | SO3(g) | ﹣395.2 |
| S(斜方硫,s) | 0 | NO(g) | 89.9 |
| NO2(g) | 33.9 |
(2)可用如图电解装置将雾霾中的NO、SO2转化为(NH4)2SO4,则a接电源的

(3)按投料比n(NO):n(Cl2)=2:1将NO和Cl2加入到恒压密闭容器中,发生反应2NO(g)+Cl2(g)⇌2NOCl(g),平衡时NO的转化率与温度的关系如图所示。

①反应的△H
②已知总压pMPa,M点时容器内Cl2的转化率为
(4)利用现代传感技术探究压强对2NO2(g)⇌N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①B、E两点对应的反应速率大小为vB(逆)
②F、H两点对应气体的平均相对分子质量较小的点为
您最近半年使用:0次
解题方法
3 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
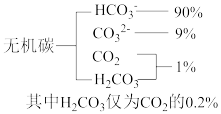
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因:___________ 。
(2)某研究所的科研人员在新型纳米催化剂 和
和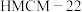 的表面,以
的表面,以 为碳源,与电解水产生的
为碳源,与电解水产生的 催化转化为高附加值的烃类化合物,其过程如图。
催化转化为高附加值的烃类化合物,其过程如图。
已知 、
、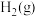 和
和 的燃烧热(
的燃烧热( )分别为
)分别为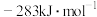 、
、 、
、 且
且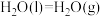
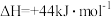 。则以
。则以 和
和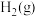 为原料合成
为原料合成 和气态水的热化学方程式是
和气态水的热化学方程式是___________ 。
(3)工业上以 和
和 为原料合成甲醇的反应:
为原料合成甲醇的反应:
 。在容积为
。在容积为 的恒容容器中,分别在
的恒容容器中,分别在 、
、 、
、 三种温度下合成甲醇。上述三种温度下不同
三种温度下合成甲醇。上述三种温度下不同 和
和 的起始组成比(起始时
的起始组成比(起始时 的物质的量均为
的物质的量均为 )与
)与 平衡转化率的关系如图所示。下列说法正确的是___________(填标号)。
平衡转化率的关系如图所示。下列说法正确的是___________(填标号)。

(4)在一定条件下,向某恒容密闭容器中充入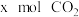 和
和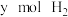 ,发生反应
,发生反应
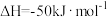 。
。

①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线___________ (填“a”或“b”),判断依据是___________ 。
②若x=2、y=3,测得在相同时间内不同温度下 的转化率如图2所示,则
的转化率如图2所示,则 时,起始压强为
时,起始压强为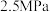 ,
,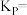
___________  (
( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
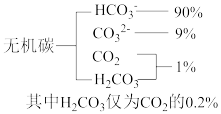
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因:
(2)某研究所的科研人员在新型纳米催化剂
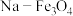 和
和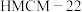 的表面,以
的表面,以 为碳源,与电解水产生的
为碳源,与电解水产生的 催化转化为高附加值的烃类化合物,其过程如图。
催化转化为高附加值的烃类化合物,其过程如图。
已知
 、
、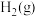 和
和 的燃烧热(
的燃烧热( )分别为
)分别为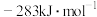 、
、 、
、 且
且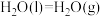
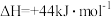 。则以
。则以 和
和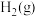 为原料合成
为原料合成 和气态水的热化学方程式是
和气态水的热化学方程式是(3)工业上以
 和
和 为原料合成甲醇的反应:
为原料合成甲醇的反应:
 。在容积为
。在容积为 的恒容容器中,分别在
的恒容容器中,分别在 、
、 、
、 三种温度下合成甲醇。上述三种温度下不同
三种温度下合成甲醇。上述三种温度下不同 和
和 的起始组成比(起始时
的起始组成比(起始时 的物质的量均为
的物质的量均为 )与
)与 平衡转化率的关系如图所示。下列说法正确的是___________(填标号)。
平衡转化率的关系如图所示。下列说法正确的是___________(填标号)。
A.a、b、c三点 的转化率:c>a>b 的转化率:c>a>b |
B.上述三种温度之间的关系为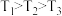 |
C.c点状态下再通入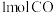 和 和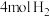 ,再次达到平衡时 ,再次达到平衡时 的体积分数增大 的体积分数增大 |
D.a点状态下再通入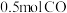 和 和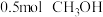 ,平衡不移动 ,平衡不移动 |
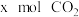 和
和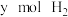 ,发生反应
,发生反应
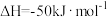 。
。
①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线
②若x=2、y=3,测得在相同时间内不同温度下
 的转化率如图2所示,则
的转化率如图2所示,则 时,起始压强为
时,起始压强为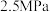 ,
,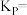
 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
您最近半年使用:0次
4 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因_______ 。已知春季海水pH=8.1,冬季海水碱性会减弱,理由是_______ 。
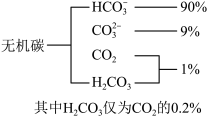
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是_______ (填字母)。
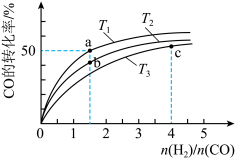
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
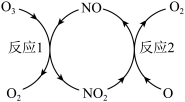
①NO的作用是_______ 。
②已知:O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为_______ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图。
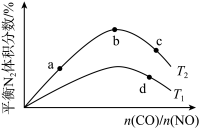
①b点时,平衡体系中C、N原子个数之比接近_______ 。
②b、c、d三点的平衡常数从大到小的顺序为_______ ,对你的排序进行解释: _______ 。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_______ 。
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因

(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是
②已知:O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图。

①b点时,平衡体系中C、N原子个数之比接近
②b、c、d三点的平衡常数从大到小的顺序为
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为
您最近半年使用:0次
2021-01-19更新
|
424次组卷
|
3卷引用:吉林省吉林市2021届高三上学期第二次调研测试(1月)化学试题
吉林省吉林市2021届高三上学期第二次调研测试(1月)化学试题(已下线)2021年高考化学押题预测卷(新课标Ⅰ卷)(01)(含考试版、答题卡、参考答案、全解全析)江西省南昌市八一中学2021届高三第三次模拟考试理科综合化学试题
名校
解题方法
5 . 研究碳、氮等元素化合物的性质与转化,对建设美丽中国具有重要意义。
Ⅰ: 能加速臭氧层被破坏,其反应过程如下图所示。
能加速臭氧层被破坏,其反应过程如下图所示。
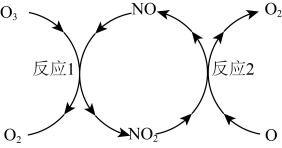
① 的作用是
的作用是___________ 。
②已知: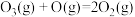

反应1: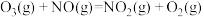
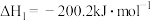
反应2:热化学方程式为___________ 。
Ⅱ:以 和
和 为原料合成甲醇的反应为:
为原料合成甲醇的反应为: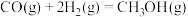
 ,在容积为1L的恒容容器中,分别在
,在容积为1L的恒容容器中,分别在 、
、 、
、 三种温度下合成甲醇。下图是三种温度下不同
三种温度下合成甲醇。下图是三种温度下不同 和
和 的起始组成比(起始时
的起始组成比(起始时 的物质的量均为
的物质的量均为 )与
)与 平衡转化率的关系。下列说法正确的是
平衡转化率的关系。下列说法正确的是___________ (填字母)。
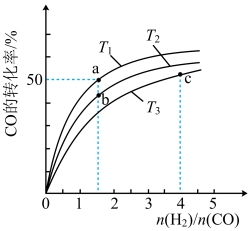
A.上述三种温度之间关系为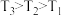
B. 、
、 、
、 三点
三点 转化率:
转化率: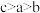
C.a点状态下再通入 和
和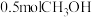 ,平衡不移动
,平衡不移动
D.c点状态下再通入 和
和 ,新平衡中
,新平衡中 的体积分数增大
的体积分数增大
Ⅲ.若将 和
和 按不同比例投入一密闭容器中发生反应:
按不同比例投入一密闭容器中发生反应:
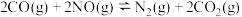
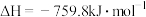
反应达到平衡时, 的体积分数随
的体积分数随 的变化曲线如下图。
的变化曲线如下图。
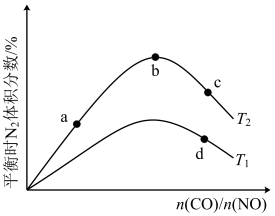
①b点时,平衡体系中C、N原子个数之比接近___________ 。
②a、b、c三点CO的转化率从大到小的顺序为___________ ;a、c、d三点的平衡常数从大到小的顺序为___________ 。
③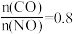 ,反应达平衡时,的体积分数为20%,则的转化率为
,反应达平衡时,的体积分数为20%,则的转化率为_____ 。
Ⅰ:
 能加速臭氧层被破坏,其反应过程如下图所示。
能加速臭氧层被破坏,其反应过程如下图所示。
①
 的作用是
的作用是②已知:
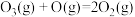

反应1:
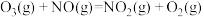
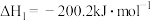
反应2:热化学方程式为
Ⅱ:以
 和
和 为原料合成甲醇的反应为:
为原料合成甲醇的反应为: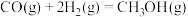
 ,在容积为1L的恒容容器中,分别在
,在容积为1L的恒容容器中,分别在 、
、 、
、 三种温度下合成甲醇。下图是三种温度下不同
三种温度下合成甲醇。下图是三种温度下不同 和
和 的起始组成比(起始时
的起始组成比(起始时 的物质的量均为
的物质的量均为 )与
)与 平衡转化率的关系。下列说法正确的是
平衡转化率的关系。下列说法正确的是
A.上述三种温度之间关系为
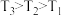
B.
 、
、 、
、 三点
三点 转化率:
转化率: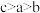
C.a点状态下再通入
 和
和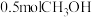 ,平衡不移动
,平衡不移动D.c点状态下再通入
 和
和 ,新平衡中
,新平衡中 的体积分数增大
的体积分数增大Ⅲ.若将
 和
和 按不同比例投入一密闭容器中发生反应:
按不同比例投入一密闭容器中发生反应: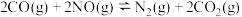
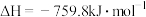
反应达到平衡时,
 的体积分数随
的体积分数随 的变化曲线如下图。
的变化曲线如下图。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③
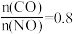 ,反应达平衡时,的体积分数为20%,则的转化率为
,反应达平衡时,的体积分数为20%,则的转化率为
您最近半年使用:0次
解题方法
6 . 含碳化合物的资源化综合利用,不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)利用CO、CO2和H2在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58kJ·mol-1
③CO2(g)+H2(g)=CO(g)+H2O(g) △H
反应③的△H=_______ kJ·mol-1。
(2)工业上可通过甲醇洗基化法制取甲酸甲酯,反应为:CH3OH(g)+CO(g) HCOOCH3(g) △H=-29.1kJ·mol-1。
HCOOCH3(g) △H=-29.1kJ·mol-1。
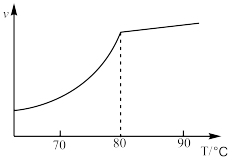
①科研人员对该反应进行了研究,在一定压强时,温度对反应速率的影响如图所示。实际工业生产中采用的温度是80℃,其理由是_______ 。
②反应过程发生副反应:2CH3OH(g) HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
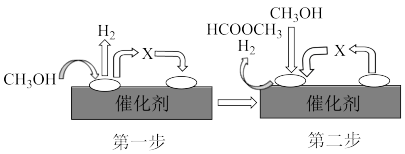
写出第二步的反应方程式_______ 。
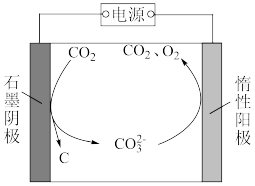
(3)华盛顿大学的研究人员研究出一种方法,可实现CO2零排放,其基本原理如图所示:反应温度控制在900℃时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为_______ 。
(4)CO2气氛下乙苯催化脱氢制苯乙烯的反应为: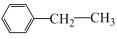 (g)+CO2(g)
(g)+CO2(g)
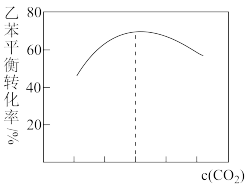
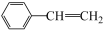 (g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因
(g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因_______ 。
(1)利用CO、CO2和H2在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58kJ·mol-1
③CO2(g)+H2(g)=CO(g)+H2O(g) △H
反应③的△H=
(2)工业上可通过甲醇洗基化法制取甲酸甲酯,反应为:CH3OH(g)+CO(g)
 HCOOCH3(g) △H=-29.1kJ·mol-1。
HCOOCH3(g) △H=-29.1kJ·mol-1。①科研人员对该反应进行了研究,在一定压强时,温度对反应速率的影响如图所示。实际工业生产中采用的温度是80℃,其理由是

②反应过程发生副反应:2CH3OH(g)
 HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
写出第二步的反应方程式
(3)华盛顿大学的研究人员研究出一种方法,可实现CO2零排放,其基本原理如图所示:反应温度控制在900℃时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为

(4)CO2气氛下乙苯催化脱氢制苯乙烯的反应为:
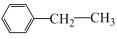 (g)+CO2(g)
(g)+CO2(g)
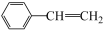 (g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因
(g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因
您最近半年使用:0次
7 . I氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为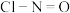 )是有机合成中的重要试剂。它可由
)是有机合成中的重要试剂。它可由 和NO在通常条件下反应制得,反应方程式为
和NO在通常条件下反应制得,反应方程式为 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:
当 与NO反应生成ClNO的过程中转移了5mol电子,理论上放出的热量为
与NO反应生成ClNO的过程中转移了5mol电子,理论上放出的热量为_______ kJ;
(2)在一个恒容密闭容器中投入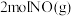 和
和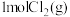 发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
①T1_______ T2(填“>“”<”或”=”);
②温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮( ),其工作原理如图所示
),其工作原理如图所示
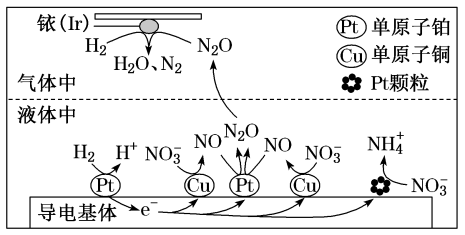
Ir表面发生反应的方程式为_______ ;
II.利用电化学原理,将 、
、 和熔融
和熔融 制成燃料电池,模拟工业电解法来精炼银,装置如图所示
制成燃料电池,模拟工业电解法来精炼银,装置如图所示
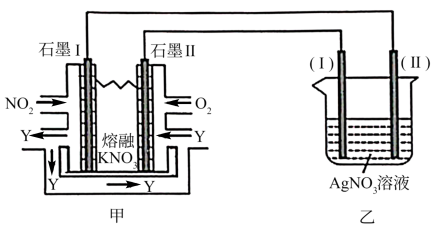
请回答下列问题:
(4)甲池工作时, 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用,则石墨II附近发生的电极反应式为
,可循环使用,则石墨II附近发生的电极反应式为_______ 。
(1)亚硝酸氯(结构式为
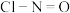 )是有机合成中的重要试剂。它可由
)是有机合成中的重要试剂。它可由 和NO在通常条件下反应制得,反应方程式为
和NO在通常条件下反应制得,反应方程式为 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:| 化学键 | Cl—Cl | Cl—N | N—O | N—O(NO) |
| 键能(kJ/mol) | 243 | 200 | 607 | 630 |
 与NO反应生成ClNO的过程中转移了5mol电子,理论上放出的热量为
与NO反应生成ClNO的过程中转移了5mol电子,理论上放出的热量为(2)在一个恒容密闭容器中投入
 和
和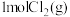 发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示t/min 温度/℃ | 0 | 5 | 8 | 13 |
| T1 | 2 | 1.5 | 1.3 | 1.0 |
| T2 | 2 | 1.15 | 1.0 | 1.0 |
②温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(
 ),其工作原理如图所示
),其工作原理如图所示
Ir表面发生反应的方程式为
II.利用电化学原理,将
 、
、 和熔融
和熔融 制成燃料电池,模拟工业电解法来精炼银,装置如图所示
制成燃料电池,模拟工业电解法来精炼银,装置如图所示
请回答下列问题:
(4)甲池工作时,
 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用,则石墨II附近发生的电极反应式为
,可循环使用,则石墨II附近发生的电极反应式为
您最近半年使用:0次



