1 . 金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1) 镓(Ga)的原子结构示意图为 ,镓元素在周期表中的位置是
,镓元素在周期表中的位置是_______ 。
(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是______________ 。
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是____________________ 。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是____________________________________ 。
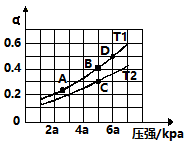
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

图中A点和C点化学平衡常数的关系是:KA_____ KC (填“>”“=”或“<”),理由是_____________________________ 。
(4)电解法可以提纯粗镓,具体原理如图2所示:
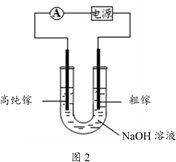
①粗镓与电源____ 极相连。(填“正”或“负”)
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
_____________________________ 。
(1) 镓(Ga)的原子结构示意图为
 ,镓元素在周期表中的位置是
,镓元素在周期表中的位置是(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

图中A点和C点化学平衡常数的关系是:KA
(4)电解法可以提纯粗镓,具体原理如图2所示:

①粗镓与电源
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
您最近半年使用:0次
名校
解题方法
2 . 砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________ ,AsH3的电子式_________ 。
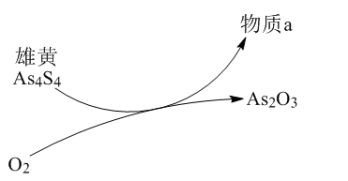
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________ (填化学式)。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s) 2As(g) +3CO(g)
2As(g) +3CO(g) 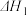 =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s)
 As4(g) +3CO(g)
As4(g) +3CO(g) 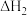 =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g) 4As(g)
4As(g) 
①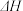 =
=_________ kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应: (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
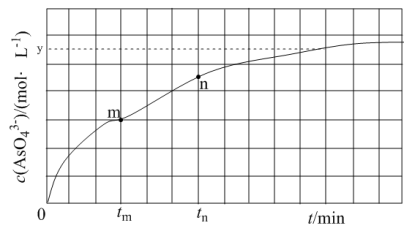
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v( )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c( )/c(
)/c( )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正( )
)_______ (填“大于”“小于”或“等于”)v逆(  )。
)。
③tm min时,v逆( )
) _______ (填“大于”“小于”或“等于”)tn时v逆(  ),理由是
),理由是___________________ 。
(1)As在元素周期表中的位置是
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s)
 2As(g) +3CO(g)
2As(g) +3CO(g) 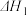 =a kJ· mol-1
=a kJ· mol-1反应 II.As2O3(g) +3C(s)

 As4(g) +3CO(g)
As4(g) +3CO(g) 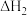 =b kJ ·mol-1
=b kJ ·mol-1反应III.As4(g)
 4As(g)
4As(g) 
①
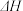 =
=②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
| 反应II | 反应III | ||
| 活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 | |
由表中数据判断催化剂X
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应:
 (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可说明反应达到平衡的是
a.v(I- ) =2v(
 )
) b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c(
 )/c(
)/c( )不再发生变化
)不再发生变化e.c(Na+) =5xmol· L-1
②tm min时,v正(
 )
) )。
)。③tm min时,v逆(
 )
)  ),理由是
),理由是
您最近半年使用:0次
名校
3 . Ⅰ.2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。
(1)中国青年化学家姜雪峰被国际组织推选为“元素硫代言人”,元素硫在周期表中的位置是___ ;它与短周期中金属性最强的元素形成的常见化合物的电子式是___ 。
(2)X是周期表中原子半径最小的元素,Y的一种同位素常用于考古,Z的最外层电子数是次外层电子数的3倍,厨房中有两种常见的调味品都是由这三种元素组成,一定条件下,这两种物质可反应生成一种具有水果香味的物质,写出该反应的方程式:___ 。
Ⅱ.氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据如图提供的信息,写出该反应的热化学方程式___ ,如图的曲线中___ (填“a”或“b”)表示加入了催化剂的能量变化曲线。
已知H—H键能:436kJ/mol;N—H键能:391kJ/mol,则N≡N的键能为___ 。
(2)科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
①利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____ 。
②利用氮氧化物的流程如图:
NO NO2
NO2 N2
N2
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为____ L(标准状况下)。
(3)已知下列反应:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g)ΔH=-266kJ·mol-1
O2(g)ΔH=-266kJ·mol-1
在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠。该反应的热化学方程式为___ 。
(1)中国青年化学家姜雪峰被国际组织推选为“元素硫代言人”,元素硫在周期表中的位置是
(2)X是周期表中原子半径最小的元素,Y的一种同位素常用于考古,Z的最外层电子数是次外层电子数的3倍,厨房中有两种常见的调味品都是由这三种元素组成,一定条件下,这两种物质可反应生成一种具有水果香味的物质,写出该反应的方程式:
Ⅱ.氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据如图提供的信息,写出该反应的热化学方程式
已知H—H键能:436kJ/mol;N—H键能:391kJ/mol,则N≡N的键能为

(2)科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
①利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=
②利用氮氧化物的流程如图:
NO
 NO2
NO2 N2
N2已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为
(3)已知下列反应:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g)ΔH=-266kJ·mol-1
O2(g)ΔH=-266kJ·mol-1在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠。该反应的热化学方程式为
您最近半年使用:0次
解题方法
4 . 含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) △H。
CH3NH2(g)+H2O(g) △H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
则该合成反应的△H=______ 。若CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g)的活化能为Ea1=300kJ/mol,由此计算CH3NH2(g)+H2O(g)
CH3NH2(g)+H2O(g)的活化能为Ea1=300kJ/mol,由此计算CH3NH2(g)+H2O(g) CH3OH(g)+NH3(g)的活化能Ea2=
CH3OH(g)+NH3(g)的活化能Ea2=______ 。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为______ 。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g) 2GaN(s)+3H2(g)△H= --30.8kJ·mol-1。在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。
2GaN(s)+3H2(g)△H= --30.8kJ·mol-1。在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。
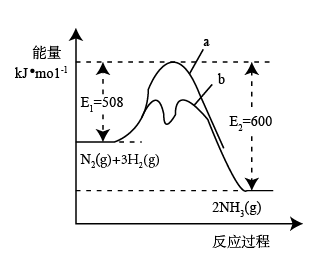
①图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是(填代号)_______ 。
a.纵轴a表示NH3的转化率 b.纵轴α表示H2的体积分数 c.T1<T2 d.KA<Kc
②若反应在T1温度下进行,下列描述能说明B点处于平衡状态的是______ 。
a.气体密度不再变化 b.c(H2)/c(NH3)=2:3
c.单位时间NH3与H2的断键数目相同 d.K不变
③若纵轴α表示NH3的体积分数,根据图中数据计算D点的化学平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)______ 。
④镓在元素周期表位于第四周期第ⅢA族,其原子结构示意图为_____ ,镓的化学性质与铝相似,氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____ 。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g) △H。
CH3NH2(g)+H2O(g) △H。①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
| 化学键 | C-H | C-O | H-O | N-H | C-N |
| 键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=
 CH3NH2(g)+H2O(g)的活化能为Ea1=300kJ/mol,由此计算CH3NH2(g)+H2O(g)
CH3NH2(g)+H2O(g)的活化能为Ea1=300kJ/mol,由此计算CH3NH2(g)+H2O(g) CH3OH(g)+NH3(g)的活化能Ea2=
CH3OH(g)+NH3(g)的活化能Ea2=②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
| NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
| 甲 | 1 | 1 | 498K,恒容 |
| 乙 | 1 | 1 | 598K,恒容 |
| 丙 | 1 | 1 | 598K,恒压 |
| 丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)
 2GaN(s)+3H2(g)△H= --30.8kJ·mol-1。在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。
2GaN(s)+3H2(g)△H= --30.8kJ·mol-1。在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。
①图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是(填代号)
a.纵轴a表示NH3的转化率 b.纵轴α表示H2的体积分数 c.T1<T2 d.KA<Kc
②若反应在T1温度下进行,下列描述能说明B点处于平衡状态的是
a.气体密度不再变化 b.c(H2)/c(NH3)=2:3
c.单位时间NH3与H2的断键数目相同 d.K不变
③若纵轴α表示NH3的体积分数,根据图中数据计算D点的化学平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④镓在元素周期表位于第四周期第ⅢA族,其原子结构示意图为
您最近半年使用:0次
2013·安徽·一模
解题方法
5 . X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
请推出具体元素,用具体元素回答下列问题:
(1)根据元素周期律可以设计出多种形式的周期表,下列是扇形元素周期表:
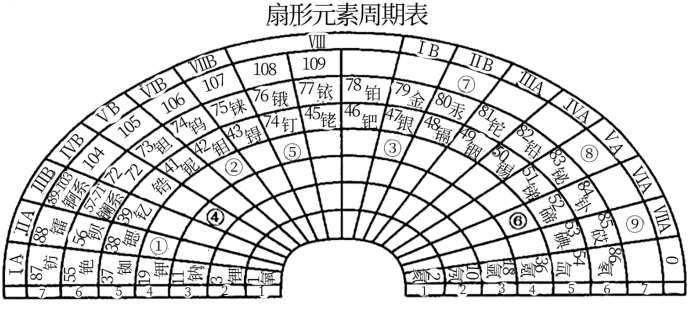
T元素在扇形元素周期表中的位置是____ (填表中带圆圈的数字);上表中⑨号位置 的元素基态原子未成对电子数为______ ;2012年6月25日,俄罗斯杜布纳核联合研究所再次成功合成117号元素,它将被列入元素周期表,“117”元素在扇形元素周期表中的位置是_______ (填表中带圆圈的数字)。
(2)质量数为2的X基态原子的电子排布式为________ ,在这五种元素中电负性最大的是____________________________ 。
(3)由上述五种元素中的某些元素形成的离子,该离子中每个原子最外层均有8个电子且 与Z3-具有相同质子数和电子数,则这种离子的结构式为_________________ 。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:___________________ 。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1) YZ-(aq)+X3W+(aq) ΔH=+45.6 kJ/mol
YZ-(aq)+X3W+(aq) ΔH=+45.6 kJ/mol
X3W+(aq)+WX(aq)=2X2W(1) ΔH=-57.3 kJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子厅程式表示):____________________________________ 。
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
(1)根据元素周期律可以设计出多种形式的周期表,下列是扇形元素周期表:

T元素在扇形元素周期表中的位置是
(2)质量数为2的X基态原子的电子排布式为
(3)由上述五种元素中的某些元素形成的离子,该离子中每个原子最外层均有8个电子且 与Z3-具有相同质子数和电子数,则这种离子的结构式为
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)
 YZ-(aq)+X3W+(aq) ΔH=+45.6 kJ/mol
YZ-(aq)+X3W+(aq) ΔH=+45.6 kJ/molX3W+(aq)+WX(aq)=2X2W(1) ΔH=-57.3 kJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子厅程式表示):
您最近半年使用:0次
2011·辽宁铁岭·模拟预测
解题方法
6 . X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,相关信息如下表:
根据上述信息回答下列问题:
(1)元素Q在元素周期表中的位置______________________________ .
(2)Y的最简单气态氢化物甲的水溶液可与H2O2发生反应,其产物不污染环境,化学方程式为______________________________________ .(用元素符号表示,下同)
(3)X和氢元素组成的化合物分子有6个原子,其结构式为_____________________ .
(4)已知:X(s)+O2(g) =XO2(g) △H = -393.5kJ·mol-1
2X(s)+O2(g) =2XO(g) △H = -221.0kJ·mol-1
则XO的燃烧热的热化学方程式__________________________________________________ .
(5)元素Y与氢元素形成的五核阳离子乙,向含乙和Z的阳离子的混合溶液中加入固体Na2O2,加入Na2O2的物质的量与产生沉淀有如图所示关系: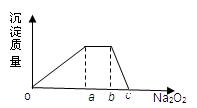
写出有关反应离子方程式:(每段只用一个离子方程式表示)
o-a段____________________________________
a-b段__________________________________ .
| 元素 | 相关信息 |
| X | X原子核外最外层电子数是次外层的2倍 |
| Y | Y的气态氢化物的水溶液显弱碱性 |
| Z | Z是地壳中含量最多的金属元素 |
| W | 常温常压下,W的单质是淡黄色固体 |
| Q | …… |
(1)元素Q在元素周期表中的位置
(2)Y的最简单气态氢化物甲的水溶液可与H2O2发生反应,其产物不污染环境,化学方程式为
(3)X和氢元素组成的化合物分子有6个原子,其结构式为
(4)已知:X(s)+O2(g) =XO2(g) △H = -393.5kJ·mol-1
2X(s)+O2(g) =2XO(g) △H = -221.0kJ·mol-1
则XO的燃烧热的热化学方程式
(5)元素Y与氢元素形成的五核阳离子乙,向含乙和Z的阳离子的混合溶液中加入固体Na2O2,加入Na2O2的物质的量与产生沉淀有如图所示关系:

写出有关反应离子方程式:(每段只用一个离子方程式表示)
o-a段
a-b段
您最近半年使用:0次
名校
7 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
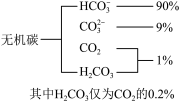
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________ 。已知春季海水pH=8.1,预测冬季海水碱性将会_______ (填“增强”或“减弱”),理由是_________________ 。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________ (填字母)。
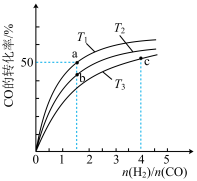
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
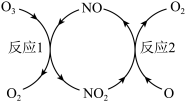
①NO的作用是_________________ 。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为____________________________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
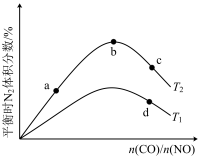
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从小到大的顺序为________ ;b、c、d三点的平衡常数从大到小的顺序为__________ 。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____ 。

(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。

①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从小到大的顺序为
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为
您最近半年使用:0次
2020-03-05更新
|
448次组卷
|
2卷引用:河南省驻马店市2020年3月高三模拟测试理综化学试题
解题方法
8 . 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光照可转化成N,转化过程如下,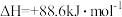 。则M、N相比,较稳定的是
。则M、N相比,较稳定的是_______
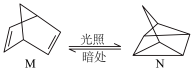
(2)已知 (l)的燃烧热为238.6kJ/mol,
(l)的燃烧热为238.6kJ/mol,
 ,则a
,则a_______ 238.6(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)使 和
和 (g)通过灼热的炭层,生成HCl(g)和
(g)通过灼热的炭层,生成HCl(g)和 ,当有1mol
,当有1mol 参与反应时释放出145kJ热量,写出该反应的热化学方程式
参与反应时释放出145kJ热量,写出该反应的热化学方程式_______ 。
(4)火箭和导弹表面的薄层是耐高温物质。下列反应可制得耐高温材料,热化学方程式为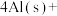
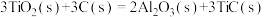
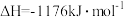 。反应过程中每转移1mol
。反应过程中每转移1mol 放出的热量为
放出的热量为_______ kJ。
(5)已知1mol燃料完全燃烧的数据分别为:
使用上述燃料最能体现“低碳经济”理念的是_______ 。
(6)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM—5催化下合成ETBE,反应的热化学方程式为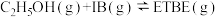
 。反应物被催化剂HZSM—5吸附的顺序与反应历程的关系如图所示,该反应的
。反应物被催化剂HZSM—5吸附的顺序与反应历程的关系如图所示,该反应的
_______ a ;反应历程的最优途径是
;反应历程的最优途径是
_______ (填“ ”、“
”、“ ”或“
”或“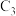 ”)。
”)。
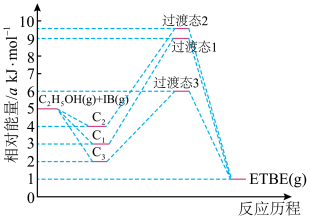
 表示先吸附乙醇,
表示先吸附乙醇, 表示先吸附异丁烯,
表示先吸附异丁烯,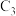 表示乙醇和异丁烯同时吸附
表示乙醇和异丁烯同时吸附
(1)有机物M经过太阳光照可转化成N,转化过程如下,
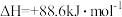 。则M、N相比,较稳定的是
。则M、N相比,较稳定的是
(2)已知
 (l)的燃烧热为238.6kJ/mol,
(l)的燃烧热为238.6kJ/mol,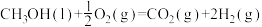
 ,则a
,则a ”、“
”、“ ”或“
”或“ ”)。
”)。(3)使
 和
和 (g)通过灼热的炭层,生成HCl(g)和
(g)通过灼热的炭层,生成HCl(g)和 ,当有1mol
,当有1mol 参与反应时释放出145kJ热量,写出该反应的热化学方程式
参与反应时释放出145kJ热量,写出该反应的热化学方程式(4)火箭和导弹表面的薄层是耐高温物质。下列反应可制得耐高温材料,热化学方程式为
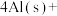
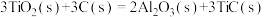
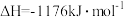 。反应过程中每转移1mol
。反应过程中每转移1mol 放出的热量为
放出的热量为(5)已知1mol燃料完全燃烧的数据分别为:
| 燃料 | 一氧化碳 | 甲烷 | 异辛烷(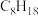 ) ) | 乙醇 |
 | 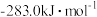 | 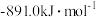 | 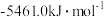 | 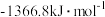 |
(6)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM—5催化下合成ETBE,反应的热化学方程式为
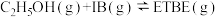
 。反应物被催化剂HZSM—5吸附的顺序与反应历程的关系如图所示,该反应的
。反应物被催化剂HZSM—5吸附的顺序与反应历程的关系如图所示,该反应的
 ;反应历程的最优途径是
;反应历程的最优途径是
 ”、“
”、“ ”或“
”或“ ”)。
”)。
 表示先吸附乙醇,
表示先吸附乙醇, 表示先吸附异丁烯,
表示先吸附异丁烯, 表示乙醇和异丁烯同时吸附
表示乙醇和异丁烯同时吸附
您最近半年使用:0次
名校
解题方法
9 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明,美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示:
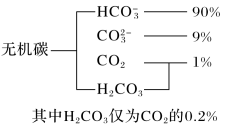
用离子方程式表示海水呈弱碱性的原因__ 。已知春季海水pH=8.1,预测夏季海水碱性将会__ (填“增强”或“减弱”)
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是__ (填字母)。
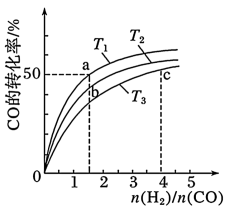
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
D.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
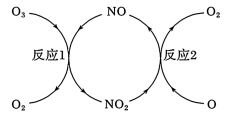
①NO的作用是__ 。
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为__ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随 的变化曲线如图。
的变化曲线如图。
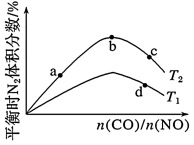
①b点时,平衡体系中C、N原子个数之比接近___ 。
②a、b、c三点CO的转化率从大到小的顺序为__ ;a、c、d三点的平衡常数从大到小的顺序为___ 。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___ 。
(1)海水中无机碳的存在形式及分布如图所示:

用离子方程式表示海水呈弱碱性的原因
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
D.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:

①NO的作用是
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随 的变化曲线如图。
的变化曲线如图。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若
 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
您最近半年使用:0次
名校
解题方法
10 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明,美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示:

用离子方程式表示海水呈弱碱性的原因______________ 。已知春季海水pH=8.1,预测夏季海水碱性将会_____________ (填“增强”或“减弱”)。
(2)工业上以CO和H2为原料合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) ΔH<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g) ΔH<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。下列说法正确的是________ (填字母)。
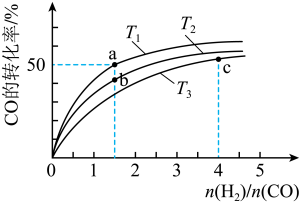
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol CO和4 mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是___________________ 。
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143 kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ·mol-1。
反应2:热化学方程式为______________________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随 的变化曲线如下图。
的变化曲线如下图。
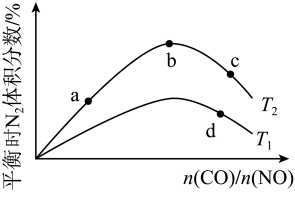
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从大到小的顺序为________ ;a、c、d三点的平衡常数从大到小的顺序为__________ 。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__________ 。
(1)海水中无机碳的存在形式及分布如图所示:

用离子方程式表示海水呈弱碱性的原因
(2)工业上以CO和H2为原料合成甲醇的反应:
CO(g)+2H2(g)
 CH3OH(g) ΔH<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g) ΔH<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。下列说法正确的是
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol CO和4 mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143 kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随 的变化曲线如下图。
的变化曲线如下图。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若
 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
您最近半年使用:0次



