名校
1 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: 。
。
上述两种方法中,方法2比方法1更好,其原因是_______ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为_______ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为_______ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为_______ g。
(4) 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知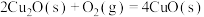
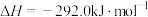 ;则
;则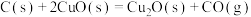 的
的
_______  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验ⅰ中气体减少的原因是_______ 。
②实验ⅰ中,推测产生 ,可能发生的反应有
,可能发生的反应有 、
、_______ 。
③随着阴极析出 ,实验ⅱ中
,实验ⅱ中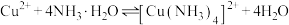 平衡不移动,理由是
平衡不移动,理由是_______ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为(4)
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知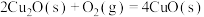
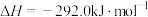 ;则
;则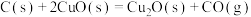 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| 1 | 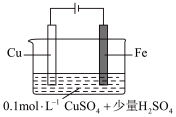 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| 2 | 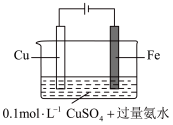 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 元素 元素 |
②实验ⅰ中,推测产生
 ,可能发生的反应有
,可能发生的反应有 、
、③随着阴极析出
 ,实验ⅱ中
,实验ⅱ中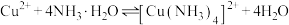 平衡不移动,理由是
平衡不移动,理由是
您最近半年使用:0次
2024-01-01更新
|
213次组卷
|
2卷引用:河南省部分名校2023-2024学年高三上学期11月期中化学试题
2 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: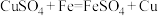 。
。
上述两种方法中,方法2比方法1更好,其原因是___________ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为___________ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为___________ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到 (标准状况)
(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为___________  。
。
(4) 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知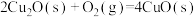
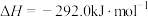 ;则
;则 的
的
___________  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验i中气体减少的原因是___________ 。
②实验i中,推测产生 ,可能发生的反应有
,可能发生的反应有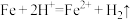 、
、___________ 。
③随着阴极析出 ,实验ii中
,实验ii中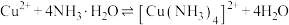 平衡
平衡___________ (填“向左”“向右”或“不”)移动,理由是___________ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
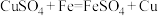 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到 (标准状况)
(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为 。
。(4)
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知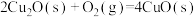
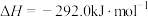 ;则
;则 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| i |  | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| ii |  | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素 |
②实验i中,推测产生
 ,可能发生的反应有
,可能发生的反应有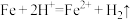 、
、③随着阴极析出
 ,实验ii中
,实验ii中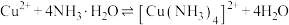 平衡
平衡
您最近半年使用:0次
2024-01-02更新
|
128次组卷
|
2卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
3 . 甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。
(1) ,
,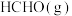 燃烧热
燃烧热 分别
分别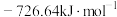 和
和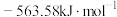 ,则
,则 与
与 反应生成
反应生成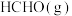 和
和 热化学反应方程式:
热化学反应方程式:___________ 。
(2)利用工业废气中的CO2可制取甲醇,其反应为: 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
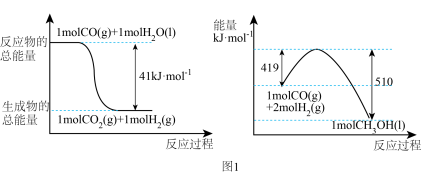
写出由二氧化碳和氢气制备甲醇的热化学方程式:___________ 。
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为___________ 。
②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象);阳极上收集到氧气的物质的量为___________ mol。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
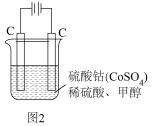
写出阳极电极反应式:___________ 。
(1)
 ,
,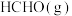 燃烧热
燃烧热 分别
分别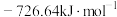 和
和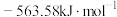 ,则
,则 与
与 反应生成
反应生成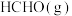 和
和 热化学反应方程式:
热化学反应方程式:(2)利用工业废气中的CO2可制取甲醇,其反应为:
 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了
 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
| 离子 | 铜离子 | 氢离子 | 氯离子 | 硫酸根离子 |
 | 1 | 4 | 4 | 1 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将
 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
写出阳极电极反应式:
您最近半年使用:0次
名校
解题方法
4 . H2O2广泛应用于医疗卫生、化学合成等领域。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为________ 。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
I.实验①和②的目的是_______ 。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2较稳定,不易分解,为达到实验目的,你对原方案的改进是_______ 。
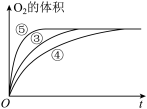
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?________ 。
III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:________ 。
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______ 。
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_______ 。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2%H2O2溶液 | 无 |
| ② | 10mL5%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol/LFeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol/LFeCl3溶液 |
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?

III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
您最近半年使用:0次
名校
5 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
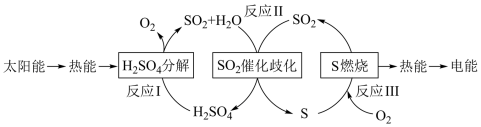
(1)已知反应 I:2H2SO4(l) 2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
反应 III:S(s) + O2 (g) SO2 (g) ΔH3 = −297 kJ/mol
SO2 (g) ΔH3 = −297 kJ/mol
所以反应 II 的热化学方程式为___________ 。
(2)试从绿色化学的角度列举该过程的优势与不足:___________ 。
上述过程中,I- 可以作为水溶液中 SO2歧化反应的催化剂,可能的催化过程如下:
ⅰ. SO2 + 4I- + 4H+ = S↓+ 2I2 + 2H2O ⅱ.I2+ 2H2O + SO2 = + 4H+ + 2I-
+ 4H+ + 2I-
某同学为探究ⅰ、ⅱ反应速率与 SO2歧化反应速率的关系, 进行如下实验:分别将 18mL SO2饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2易溶解在 KI 溶液中)
(3)第 2 组是第 1 组实验的对比组,则 a=___________ 。
(4)通过比较第 1、2、3 组实验,可得出的结论是___________ 。
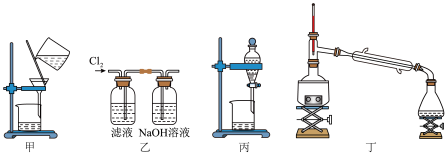
(5)该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是___________。

(1)已知反应 I:2H2SO4(l)
 2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol反应 III:S(s) + O2 (g)
 SO2 (g) ΔH3 = −297 kJ/mol
SO2 (g) ΔH3 = −297 kJ/mol所以反应 II 的热化学方程式为
(2)试从绿色化学的角度列举该过程的优势与不足:
上述过程中,I- 可以作为水溶液中 SO2歧化反应的催化剂,可能的催化过程如下:
ⅰ. SO2 + 4I- + 4H+ = S↓+ 2I2 + 2H2O ⅱ.I2+ 2H2O + SO2 =
 + 4H+ + 2I-
+ 4H+ + 2I-某同学为探究ⅰ、ⅱ反应速率与 SO2歧化反应速率的关系, 进行如下实验:分别将 18mL SO2饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2易溶解在 KI 溶液中)
| 序号 | 1 | 2 | 3 | 4 |
| 试剂组成 | 0.4 mol/L KI | amol/L KI、0.2 mol/L H2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI 、0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较组 1 快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较组 1 快 |
(3)第 2 组是第 1 组实验的对比组,则 a=
(4)通过比较第 1、2、3 组实验,可得出的结论是
(5)该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是___________。

| A.图甲是过滤海带浸泡液 | B.图乙是向浸泡液中通入 Cl2 氧化 |
| C.图丙是含 I2 的 CCl4 溶液从下口放出 | D.图丁是提取 I2 的同时回收溶剂 |
您最近半年使用:0次
6 . I.铁及铁的氧化物广泛应用于生产、生活、航天、科研领域铁的氧化物循环分解水制 。
。
已知: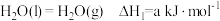 平衡常数 K1
平衡常数 K1
 平衡常数 K2
平衡常数 K2
平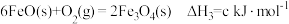 平衡常数 K3
平衡常数 K3
(1)则总反应: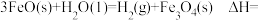
________ (用a、b、c表示),
___________ (用 表示)
表示)
(2)已知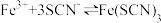 (红色),现将
(红色),现将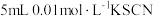 溶液和
溶液和
 溶液混合后溶液变成红色,然后又滴加2滴
溶液混合后溶液变成红色,然后又滴加2滴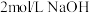 溶液现象:
溶液现象:_________ ,此时Q________ K(填“>”或“<”),平衡________ 移动(填“正向”或“逆向”或“不”)。
Ⅱ. 与
与 反应可制备纳米级金属铁。已知,恒温恒容时,加入
反应可制备纳米级金属铁。已知,恒温恒容时,加入 与
与 发生反应:
发生反应: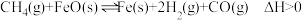
(3)此反应的化学平衡常数表达式为___________ 。
向两个容积均为 ,温度分别为
,温度分别为 的恒温恒容密闭容器中分别加入
的恒温恒容密闭容器中分别加入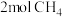 ,测得两容器中
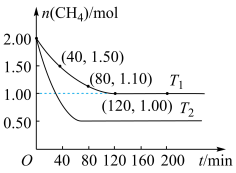
,测得两容器中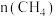 随反应时间t的变化如图所示。
随反应时间t的变化如图所示。
(4)
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5) 时,
时,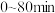 内,CH4的转化率
内,CH4的转化率___________ 。
(6)求 温度下的化学平衡常数
温度下的化学平衡常数
___________ 。
 。
。已知:
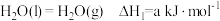 平衡常数 K1
平衡常数 K1 平衡常数 K2
平衡常数 K2平
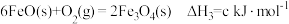 平衡常数 K3
平衡常数 K3(1)则总反应:
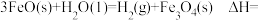

 表示)
表示)(2)已知
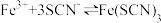 (红色),现将
(红色),现将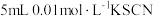 溶液和
溶液和
 溶液混合后溶液变成红色,然后又滴加2滴
溶液混合后溶液变成红色,然后又滴加2滴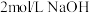 溶液现象:
溶液现象:Ⅱ.
 与
与 反应可制备纳米级金属铁。已知,恒温恒容时,加入
反应可制备纳米级金属铁。已知,恒温恒容时,加入 与
与 发生反应:
发生反应: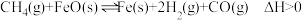
(3)此反应的化学平衡常数表达式为
向两个容积均为
 ,温度分别为
,温度分别为 的恒温恒容密闭容器中分别加入
的恒温恒容密闭容器中分别加入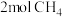 ,测得两容器中
,测得两容器中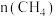 随反应时间t的变化如图所示。
随反应时间t的变化如图所示。
(4)

 (填“>”或“<”)。
(填“>”或“<”)。(5)
 时,
时,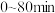 内,CH4的转化率
内,CH4的转化率(6)求
 温度下的化学平衡常数
温度下的化学平衡常数
您最近半年使用:0次
名校
7 . 天然气是一种重要的化工原料,现代工业中常用天然气生产氢气、一氧化碳、甲醇等高附加值化学品,或是将其用于燃料电池。
(1)用天然气作原料制取氢气和一氧化碳的主要反应如下:
I.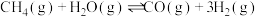
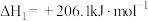
Ⅱ.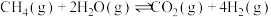
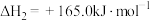
Ⅲ.
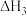
①反应Ⅱ在___________ (填“高温”、“低温”或“任何温度”)下为自发反应,反应Ⅲ的反应热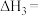
___________ 。
②已知反应I的正、逆反应活化能分别为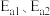 ,反应Ⅱ的正、逆反应活化能分别为
,反应Ⅱ的正、逆反应活化能分别为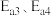 ,则
,则
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③在一定条件下,向恒容密闭容器中通入1mol 和2mol
和2mol ,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是
,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是___________ (填序号)。
A.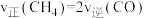
B.气体平均相对分子质量不再改变
C.气体密度不再改变
D. 与
与 的物质的量之比不再改变
的物质的量之比不再改变
④一定条件下,向体积为VL的恒容密闭容器中通入1mol 和1mol
和1mol ,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中
,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中 和
和 的物质的量均为0.2mol,此时CO的浓度为
的物质的量均为0.2mol,此时CO的浓度为___________  ,反应Ⅲ的平衡常数为
,反应Ⅲ的平衡常数为___________  。
。
(2)设计以天然气为燃料的电池,可以提高能源利用率。某燃料电池装置如图所示,A、B为多孔性碳棒。向该电池中持续通入 ,
, 时刻,已消耗的
时刻,已消耗的 体积为67.2L(标准状况下),继续通入
体积为67.2L(标准状况下),继续通入 ,此时负极的电极反应式为
,此时负极的电极反应式为___________ ;若向 时刻的溶液中加入
时刻的溶液中加入___________ molKOH并将溶液混匀,可使溶液中只含有一种溶质。

(1)用天然气作原料制取氢气和一氧化碳的主要反应如下:
I.
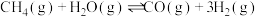
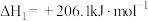
Ⅱ.
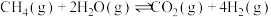
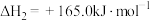
Ⅲ.

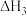
①反应Ⅱ在
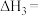
②已知反应I的正、逆反应活化能分别为
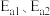 ,反应Ⅱ的正、逆反应活化能分别为
,反应Ⅱ的正、逆反应活化能分别为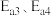 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③在一定条件下,向恒容密闭容器中通入1mol
 和2mol
和2mol ,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是
,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是A.
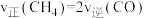
B.气体平均相对分子质量不再改变
C.气体密度不再改变
D.
 与
与 的物质的量之比不再改变
的物质的量之比不再改变④一定条件下,向体积为VL的恒容密闭容器中通入1mol
 和1mol
和1mol ,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中
,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中 和
和 的物质的量均为0.2mol,此时CO的浓度为
的物质的量均为0.2mol,此时CO的浓度为 ,反应Ⅲ的平衡常数为
,反应Ⅲ的平衡常数为 。
。(2)设计以天然气为燃料的电池,可以提高能源利用率。某燃料电池装置如图所示,A、B为多孔性碳棒。向该电池中持续通入
 ,
, 时刻,已消耗的
时刻,已消耗的 体积为67.2L(标准状况下),继续通入
体积为67.2L(标准状况下),继续通入 ,此时负极的电极反应式为
,此时负极的电极反应式为 时刻的溶液中加入
时刻的溶液中加入
您最近半年使用:0次
解题方法
8 . Ⅰ、工业上利用 和
和 在催化剂作用下合成甲醇
在催化剂作用下合成甲醇 。
。
已知相关物质的摩尔燃烧焓(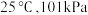 ):数据如下表所示:
):数据如下表所示:
(1)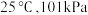 时,由
时,由 和
和 合成
合成 的热化学方程式为
的热化学方程式为___ 。
Ⅱ、某研究小组以甲醇—空气燃料电池为电源,用石墨电极持续电解 溶液,装置如下图所示。
溶液,装置如下图所示。
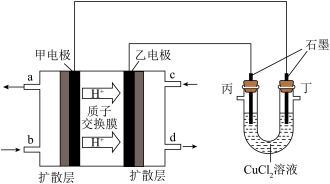
实验现象记录如下:
(2)甲电极的电极反应式为___________ ;当通入 (折算为标准状况下)甲醇蒸汽,测得电路中转移
(折算为标准状况下)甲醇蒸汽,测得电路中转移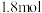 电子,则甲醇的利用率为
电子,则甲醇的利用率为___________ 。
(3)通电前 溶液呈酸性的原因:
溶液呈酸性的原因:___________ (用离子方程式表示)。
(4) 时丁电极的电极反应式为
时丁电极的电极反应式为___________ 。
(5)从丁电极刮取白色固体(含少量红色固体),经检验含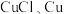 。针对
。针对 固体是如何产生的,某兴趣小组提出两种假设。
固体是如何产生的,某兴趣小组提出两种假设。
假设1:由电极反应产生: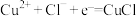
假设2:由反应___________ 产生(用离子方程式表示)。
(6)镀铜工业中,电镀液以 、
、 为主,同时含
为主,同时含 和添加剂。过多的
和添加剂。过多的 会使镀层出现白色胶状薄膜,电镀前向电镀液中加入适量
会使镀层出现白色胶状薄膜,电镀前向电镀液中加入适量 (微溶)固体能有效解决该问题,反应的离子方程式为
(微溶)固体能有效解决该问题,反应的离子方程式为___________ 。
 和
和 在催化剂作用下合成甲醇
在催化剂作用下合成甲醇 。
。已知相关物质的摩尔燃烧焓(
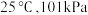 ):数据如下表所示:
):数据如下表所示:| 物质 |  |  | 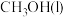 |
摩尔燃烧焓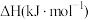 |  |  |  |
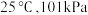 时,由
时,由 和
和 合成
合成 的热化学方程式为
的热化学方程式为Ⅱ、某研究小组以甲醇—空气燃料电池为电源,用石墨电极持续电解
 溶液,装置如下图所示。
溶液,装置如下图所示。
实验现象记录如下:
| 时刻 | 实验现象 | |
| 通电前 |  溶液呈绿色,显酸性 溶液呈绿色,显酸性 | |
 | 丙电极产生气体 | 丁电极底部出现少量红色固体,电极周围溶液变棕黑色 |
 | 丙电极产生气体 | 丁电极产生白色固体 |
| … | …… | |
 | 丙电极产生气体 | 丁电极产生气体 |
 (折算为标准状况下)甲醇蒸汽,测得电路中转移
(折算为标准状况下)甲醇蒸汽,测得电路中转移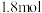 电子,则甲醇的利用率为
电子,则甲醇的利用率为(3)通电前
 溶液呈酸性的原因:
溶液呈酸性的原因:(4)
 时丁电极的电极反应式为
时丁电极的电极反应式为(5)从丁电极刮取白色固体(含少量红色固体),经检验含
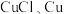 。针对
。针对 固体是如何产生的,某兴趣小组提出两种假设。
固体是如何产生的,某兴趣小组提出两种假设。假设1:由电极反应产生:
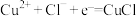
假设2:由反应
(6)镀铜工业中,电镀液以
 、
、 为主,同时含
为主,同时含 和添加剂。过多的
和添加剂。过多的 会使镀层出现白色胶状薄膜,电镀前向电镀液中加入适量
会使镀层出现白色胶状薄膜,电镀前向电镀液中加入适量 (微溶)固体能有效解决该问题,反应的离子方程式为
(微溶)固体能有效解决该问题,反应的离子方程式为
您最近半年使用:0次
名校
解题方法
9 . 乙烯是一种重要的化工原料,具有广阔的开发和应用前景。
(1)常温常压下:①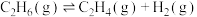
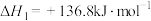
②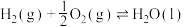
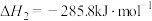
③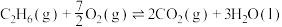

则表征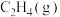 燃烧热的热化学方程式为
燃烧热的热化学方程式为__________ 。
利用 和
和 合成乙烯:
合成乙烯: 。
。
(2)在恒容密闭容器中,起始压强相同,反应温度、投料比[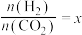 ]对
]对 平衡转化率的影响如图1所示。M、N两点的化学平衡常数
平衡转化率的影响如图1所示。M、N两点的化学平衡常数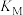
__________ (填“>”或“<”)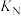 。
。

(3)300℃时,向1L恒容密闭容器中通入 、
、 ,平衡时
,平衡时 转化率为50%,
转化率为50%,
__________ (结果保留两位有效数字)。
根据如图2所示装置完成下列问题:

(4)乙烯燃料电池的负极上发生的反应为__________ 。
(5)写出乙池中电解的总反应的化学方程式:__________ 。
(6)甲池中消耗224mL(标准状况下) ,此时丙池中理论上最多产生
,此时丙池中理论上最多产生__________ g沉淀,此时乙池中溶液的体积为400mL,该溶液的
__________  。
。
(7)若以该乙烯燃料电池为电源,用石墨作电极电解200mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),电路中转移的电子的物质的量是__________ mol。
(1)常温常压下:①
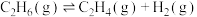
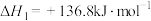
②
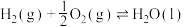
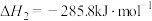
③
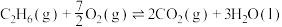

则表征
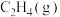 燃烧热的热化学方程式为
燃烧热的热化学方程式为利用
 和
和 合成乙烯:
合成乙烯: 。
。(2)在恒容密闭容器中,起始压强相同,反应温度、投料比[
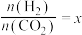 ]对
]对 平衡转化率的影响如图1所示。M、N两点的化学平衡常数
平衡转化率的影响如图1所示。M、N两点的化学平衡常数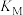
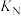 。
。
(3)300℃时,向1L恒容密闭容器中通入
 、
、 ,平衡时
,平衡时 转化率为50%,
转化率为50%,
根据如图2所示装置完成下列问题:

(4)乙烯燃料电池的负极上发生的反应为
(5)写出乙池中电解的总反应的化学方程式:
(6)甲池中消耗224mL(标准状况下)
 ,此时丙池中理论上最多产生
,此时丙池中理论上最多产生
 。
。(7)若以该乙烯燃料电池为电源,用石墨作电极电解200mL含有如下离子的溶液。
离子 |
|
|
|
|
| 0.5 | 2 | 2 | 0.5 |
您最近半年使用:0次
名校
10 . 铁及其化合物在实际生活中应用广泛。
I.一定条件下,Al可以将Fe置换出来,其转化的能量变化如图所示。回答下列问题:

(1)25℃时铝热反应的热化学方程式为________ ,该温度下当有56gFe(s)生成时,转移电子的数目为_______ 。
(2)在1538℃时,反应Fe(s)=Fe(l)的△H值为_______ 。
II.将等体积、低浓度的0.005mol/LFeCl3溶液(已用稀盐酸酸化)和0.01mol/LKSCN溶液混合,静置至体系达平衡,得红色溶液a。各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
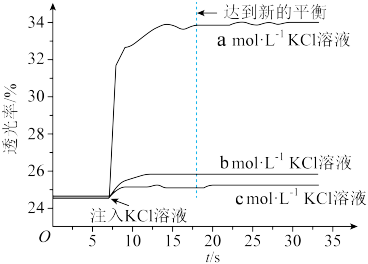
已知:①溶液的透光率与溶液颜色深找有关,颜色深,透光率低。
②FeCl3溶液中存在Fe3++4Cl- [FeCl4]-(黄色)。
[FeCl4]-(黄色)。
(3)工业上通常以FeCl3为腐蚀液,与覆铜板上的Cu反应完成蚀刻。写出蚀刻反应的离子方程式________ 。
(4)采用浓度较低的FeC13溶液制备Fe3+和SCN-平衡体系,是为了避免______ (填离子符号)的颜色对实验干扰。
(5)从实验结果来看,加入KCl溶液使得Fe3++3SCN- Fe(SCN)3,平衡向
Fe(SCN)3,平衡向______ (填“正”或“逆”)反应方向移动。结合实验现象及化学用语分析加入KCl溶液对Fe3+和SCN-平衡体系有影响的原因:________ 。
(6)加入KCl溶液的浓度从大到小排序为_________ (用a、b、c表示)。
I.一定条件下,Al可以将Fe置换出来,其转化的能量变化如图所示。回答下列问题:

(1)25℃时铝热反应的热化学方程式为
(2)在1538℃时,反应Fe(s)=Fe(l)的△H值为
II.将等体积、低浓度的0.005mol/LFeCl3溶液(已用稀盐酸酸化)和0.01mol/LKSCN溶液混合,静置至体系达平衡,得红色溶液a。各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:①溶液的透光率与溶液颜色深找有关,颜色深,透光率低。
②FeCl3溶液中存在Fe3++4Cl-
 [FeCl4]-(黄色)。
[FeCl4]-(黄色)。(3)工业上通常以FeCl3为腐蚀液,与覆铜板上的Cu反应完成蚀刻。写出蚀刻反应的离子方程式
(4)采用浓度较低的FeC13溶液制备Fe3+和SCN-平衡体系,是为了避免
(5)从实验结果来看,加入KCl溶液使得Fe3++3SCN-
 Fe(SCN)3,平衡向
Fe(SCN)3,平衡向(6)加入KCl溶液的浓度从大到小排序为
您最近半年使用:0次





