名校
1 . 回答下列问题
(1)甲醇是一种可再生能源,由 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:
反应Ⅰ: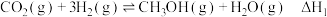
反应Ⅱ: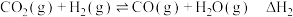
反应Ⅲ: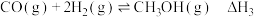
反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为 ,则
,则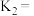
___________ (用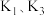 表示)。
表示)。
(2)某探究小组用 与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用
与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用 浓度为
浓度为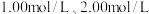 ,大理石有细颗粒和粗颗粒两种规格,实验温度为
,大理石有细颗粒和粗颗粒两种规格,实验温度为 、
、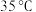 ,每次实验
,每次实验 的用量为
的用量为 ,大理石用量为
,大理石用量为 。
。
请完成实验设计表,其中a为___________ ,e为___________ 。
(3)①氯气是制备系列含氯化合物的主要原料,可采用如图A所示的装置来制取氯气。装置中的离子膜只允许___________ (填“ ”或“
”或“ ”)通过,氯气的逸出口是
”)通过,氯气的逸出口是___________ (填标号“ ”或“b”)。
”或“b”)。

② 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为___________ 。

(1)甲醇是一种可再生能源,由
 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:反应Ⅰ:
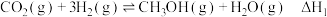
反应Ⅱ:
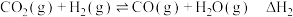
反应Ⅲ:
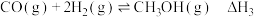
反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为
 ,则
,则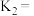
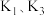 表示)。
表示)。(2)某探究小组用
 与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用
与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用 浓度为
浓度为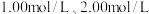 ,大理石有细颗粒和粗颗粒两种规格,实验温度为
,大理石有细颗粒和粗颗粒两种规格,实验温度为 、
、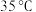 ,每次实验
,每次实验 的用量为
的用量为 ,大理石用量为
,大理石用量为 。
。| 实验编号 | 温度( ) ) | 大理石规格 |  (浓度) (浓度)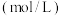 | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e___________对反应速率的影响 |
| ② | 25 | 粗颗粒 | a___________ | |
| ③ | b___________ | 粗颗粒 | 2.00 | |
| ④ | c___________ | 细颗粒 | d___________ |
(3)①氯气是制备系列含氯化合物的主要原料,可采用如图A所示的装置来制取氯气。装置中的离子膜只允许
 ”或“
”或“ ”)通过,氯气的逸出口是
”)通过,氯气的逸出口是 ”或“b”)。
”或“b”)。
②
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为
您最近半年使用:0次
名校
解题方法
2 . 化学反应在实现物质转化的同时还伴随着能量转化,最常见的一种能量变化就是化学能与热能之间的转化。在潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可用于制取氧气。
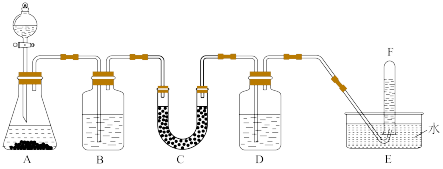
(1)A是用CaCO3制取CO2的装置。写出A中发生反应的离子方程式:_______ 。
(2)按要求填写表中空格:
(3)反应后取D中溶液,向其中逐滴加入稀盐酸,产生的CO2气体体积与所加入盐酸的体积之间的关系如图所示:

则加入盐酸之前D中溶质的成分以及对应物质的量之比是_______ 。
(4)为了达到实验目的,是否需要在B装置之后增加一个吸收水蒸气的装置,请说明理由:_______ 。
(5)研究发现,一定条件下CO2加氢可制备甲酸(HCOOH)。工业上利用甲酸的能量关系转换图如下:
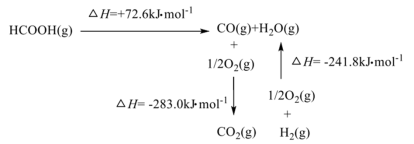
则:反应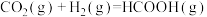 的焓变∆H=
的焓变∆H=_______ 。
(6) 溶液与1.95g锌粉在简易热量计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。
溶液与1.95g锌粉在简易热量计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。
已知: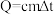 ,溶液的比热容近似为
,溶液的比热容近似为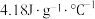 、溶液的密度近似为
、溶液的密度近似为 ,忽略溶液质量的变化、忽略金属吸收的热量。
,忽略溶液质量的变化、忽略金属吸收的热量。
①上述反应放出的热量数值为_______ J。
②请书写上述反应的热化学方程式(以离子方程式形式表示)_______ 。

(1)A是用CaCO3制取CO2的装置。写出A中发生反应的离子方程式:
(2)按要求填写表中空格:
| 仪器编号 | 盛放的试剂(焰色反应均呈黄色) | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 与CO2反应,产生O2 | |
| D | 吸收未反应的CO2气体 |

则加入盐酸之前D中溶质的成分以及对应物质的量之比是
(4)为了达到实验目的,是否需要在B装置之后增加一个吸收水蒸气的装置,请说明理由:
(5)研究发现,一定条件下CO2加氢可制备甲酸(HCOOH)。工业上利用甲酸的能量关系转换图如下:

则:反应
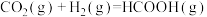 的焓变∆H=
的焓变∆H=(6)
 溶液与1.95g锌粉在简易热量计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。
溶液与1.95g锌粉在简易热量计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。已知:
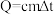 ,溶液的比热容近似为
,溶液的比热容近似为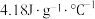 、溶液的密度近似为
、溶液的密度近似为 ,忽略溶液质量的变化、忽略金属吸收的热量。
,忽略溶液质量的变化、忽略金属吸收的热量。①上述反应放出的热量数值为
②请书写上述反应的热化学方程式(以离子方程式形式表示)
您最近半年使用:0次
3 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: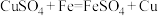 。
。
上述两种方法中,方法2比方法1更好,其原因是___________ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为___________ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为___________ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到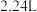 (标准状况)
(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为___________  。
。
(4) 和
和 的燃烧热分别为
的燃烧热分别为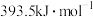 、
、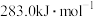 ,已知
,已知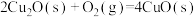
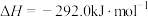 ;则
;则 的
的
___________  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验i中气体减少的原因是___________ 。
②实验i中,推测产生 ,可能发生的反应有
,可能发生的反应有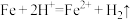 、
、___________ 。
③随着阴极析出 ,实验ii中
,实验ii中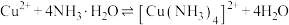 平衡
平衡___________ (填“向左”“向右”或“不”)移动,理由是___________ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
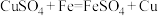 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到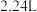 (标准状况)
(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为 。
。(4)
 和
和 的燃烧热分别为
的燃烧热分别为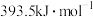 、
、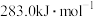 ,已知
,已知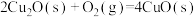
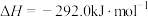 ;则
;则 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| i |  | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| ii |  | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素 |
②实验i中,推测产生
 ,可能发生的反应有
,可能发生的反应有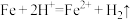 、
、③随着阴极析出
 ,实验ii中
,实验ii中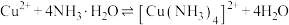 平衡
平衡
您最近半年使用:0次
2024-01-02更新
|
127次组卷
|
2卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
名校
4 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: 。
。
上述两种方法中,方法2比方法1更好,其原因是_______ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为_______ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为_______ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为_______ g。
(4) 和
和 的燃烧热分别为
的燃烧热分别为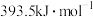 、
、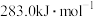 ,已知
,已知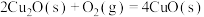
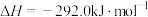 ;则
;则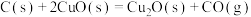 的
的
_______  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验ⅰ中气体减少的原因是_______ 。
②实验ⅰ中,推测产生 ,可能发生的反应有
,可能发生的反应有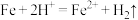 、
、_______ 。
③随着阴极析出 ,实验ⅱ中
,实验ⅱ中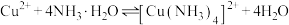 平衡不移动,理由是
平衡不移动,理由是_______ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为(4)
 和
和 的燃烧热分别为
的燃烧热分别为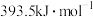 、
、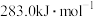 ,已知
,已知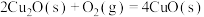
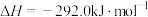 ;则
;则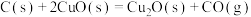 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| 1 | 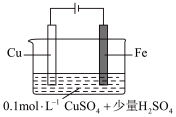 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| 2 | 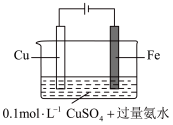 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 元素 元素 |
②实验ⅰ中,推测产生
 ,可能发生的反应有
,可能发生的反应有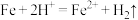 、
、③随着阴极析出
 ,实验ⅱ中
,实验ⅱ中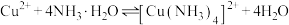 平衡不移动,理由是
平衡不移动,理由是
您最近半年使用:0次
2024-01-01更新
|
211次组卷
|
2卷引用:湖北省九师联盟2024届高三11月质检化学试题
5 . 甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。
(1)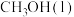 ,
,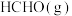 燃烧热
燃烧热 分别
分别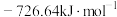 和
和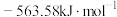 ,则
,则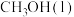 与
与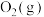 反应生成
反应生成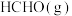 和
和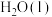 热化学反应方程式:
热化学反应方程式:___________ 。
(2)利用工业废气中的CO2可制取甲醇,其反应为: 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
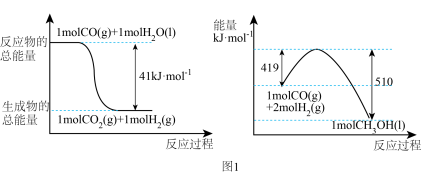
写出由二氧化碳和氢气制备甲醇的热化学方程式:___________ 。
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为___________ 。
②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象);阳极上收集到氧气的物质的量为___________ mol。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
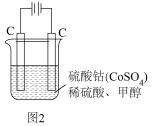
写出阳极电极反应式:___________ 。
(1)
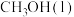 ,
,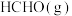 燃烧热
燃烧热 分别
分别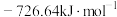 和
和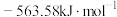 ,则
,则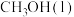 与
与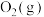 反应生成
反应生成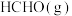 和
和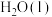 热化学反应方程式:
热化学反应方程式:(2)利用工业废气中的CO2可制取甲醇,其反应为:
 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了
 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
| 离子 | 铜离子 | 氢离子 | 氯离子 | 硫酸根离子 |
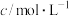 | 1 | 4 | 4 | 1 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将
 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
写出阳极电极反应式:
您最近半年使用:0次
解题方法
6 . 丙烷在燃烧时放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: 2C3H8(g)+7O2(g) = 6CO(g)+8H2O(1) ∆H1 = -2741.8 kJ•mol-1
2CO(g)+O2(g) = 2CO2(g) ∆H2 = -566.0 kJ•mol-1
(1)反应C3H8 (g)+5O2(g)=3CO2(g)+4H2O(l) ∆H=_______ ;
(2)根据上述反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钆(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-,在电池内部O2-向_______ 极移动(填“正”或“负”);电池的负极电极反应为_______ 。
(3)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,电解开始后阴极附近的现象为_______ 。
(4)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
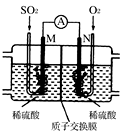
①M极发生的电极反应式为_______ 。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_______ (填“增大”或“减小”)_______ 克。
已知: 2C3H8(g)+7O2(g) = 6CO(g)+8H2O(1) ∆H1 = -2741.8 kJ•mol-1
2CO(g)+O2(g) = 2CO2(g) ∆H2 = -566.0 kJ•mol-1
(1)反应C3H8 (g)+5O2(g)=3CO2(g)+4H2O(l) ∆H=
(2)根据上述反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钆(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-,在电池内部O2-向
(3)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,电解开始后阴极附近的现象为
(4)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

①M极发生的电极反应式为
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量
您最近半年使用:0次
名校
7 . 硫元素在自然界中通常以硫化物、硫酸盐或单质的形式存在,其单质和化合物在工农业生产中有着重要的作用。
(1)硫元素在周期表中的位置为___________ ,其最简单气态氢化物的电子式为_________ 。
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+ O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=_____________ kJ·mol-1
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:
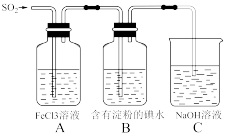
A瓶中发生反应的离子方程式为_______________________ 。B瓶中出现的现象为________ 。若要证明A、B的反应中SO2均显现还原性被氧化为SO42—,可以采取的操作和现象是_______________________________________ 。
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是__________ (填序号)。
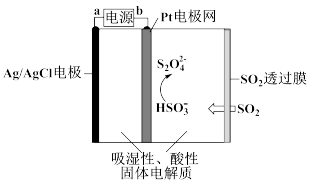
A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
(1)硫元素在周期表中的位置为
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+
 O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:

A瓶中发生反应的离子方程式为
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是

A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
您最近半年使用:0次
名校
解题方法
8 . H2O2广泛应用于医疗卫生、化学合成等领域。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为________ 。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
I.实验①和②的目的是_______ 。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2较稳定,不易分解,为达到实验目的,你对原方案的改进是_______ 。
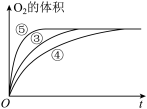
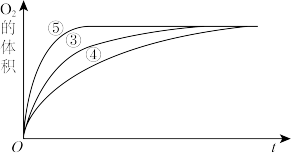
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?________ 。
III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:________ 。
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______ 。
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_______ 。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2%H2O2溶液 | 无 |
| ② | 10mL5%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol/LFeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol/LFeCl3溶液 |
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?

III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
您最近半年使用:0次
9 . 2017年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)=2CO2(g); ΔH = -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); ΔH = -483.6kJ·moL-1
H2O (g)=H2O(l); ΔH = -44.0kJ·moL-1
(1)氢气燃烧热ΔH=__________ ;
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式______________ 。
(3)往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO 的转化率为________ ;(保留一位小数)反应达到平衡后,升高温度,此时平衡常数将____ (填“变大”、“不变”或“变小”)。
(4)从汽车尾气中分离出CO与O2、熔融盐Na2CO3组成的燃料电池,同时采用电解法制备N2O5,装置如图所示,其中Y为CO2。石墨I电极的名称为______________ (填“正极”“负极”“阴极”“阳极”)。在电解池中生成N2O5的电极反应式为__________________________________ 。

(5)在一定条件下,用NH3处理汽车尾气中的NO。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________ 。
2H2(g)+O2(g)=2H2O(g); ΔH = -483.6kJ·moL-1
H2O (g)=H2O(l); ΔH = -44.0kJ·moL-1
(1)氢气燃烧热ΔH=
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO 的转化率为
(4)从汽车尾气中分离出CO与O2、熔融盐Na2CO3组成的燃料电池,同时采用电解法制备N2O5,装置如图所示,其中Y为CO2。石墨I电极的名称为

(5)在一定条件下,用NH3处理汽车尾气中的NO。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是
您最近半年使用:0次
解题方法
10 . H2O2广泛应用于医疗卫生、化学合成等领域。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)= H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+_______。
则ii中反应机理用热化学方程式表示为_______ 。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
Ⅰ.实验①和②的目的是_______ 。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下 较稳定,不易分解,为达到实验目的,你对原方案的改进是
较稳定,不易分解,为达到实验目的,你对原方案的改进是_______ 。
Ⅱ. 实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?_______ 。
Ⅲ.为比较 和
和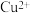 对
对 分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
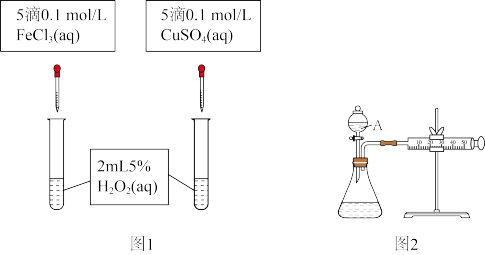
①写出 在
在 作用下发生反应的化学方程式:
作用下发生反应的化学方程式: _______ 
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论 有同学提出将
有同学提出将 改为
改为 更为合理,其理由是
更为合理,其理由是 _______ ,
③若利用图2实验可进行定理分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_______ 。
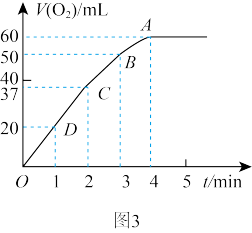
④将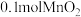 粉末加入50mL
粉末加入50mL  溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:
溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因: _______ , 初始物质的量浓度为
初始物质的量浓度为 _______ (保留两位有效数字)。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)= H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+_______。
则ii中反应机理用热化学方程式表示为
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① |  溶液 溶液 | 无 |
| ② | 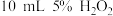 溶液 溶液 | 无 |
| ③ | 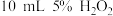 溶液 溶液 | 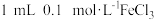 溶液 溶液 |
| ④ | 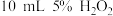 溶液 溶液 少量 HCl溶液 少量 HCl溶液 | 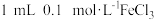 溶液 溶液 |
| ⑤ | 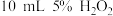 溶液 溶液 少量 NaOH溶液 少量 NaOH溶液 | 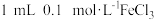 溶液 溶液 |
 较稳定,不易分解,为达到实验目的,你对原方案的改进是
较稳定,不易分解,为达到实验目的,你对原方案的改进是Ⅱ.
 实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
Ⅲ.为比较
 和
和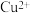 对
对 分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
①写出
 在
在 作用下发生反应的化学方程式:
作用下发生反应的化学方程式: 
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论
 有同学提出将
有同学提出将 改为
改为 更为合理,其理由是
更为合理,其理由是 ③若利用图2实验可进行定理分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
④将
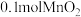 粉末加入50mL
粉末加入50mL  溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:
溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:  初始物质的量浓度为
初始物质的量浓度为 
您最近半年使用:0次



