工业上制硫酸的主要反应之一为: ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
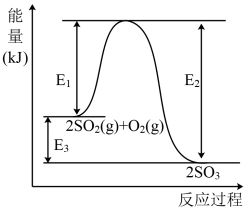
(1)向反应体系中加入催化剂后,图中
___________ (填“增大”、“减小”或“不变”,下同),
___________ 。
(2)已知:
 ;
;
 ;若
;若 与
与 反应产生
反应产生 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为___________ 。
(3)某温度下,反应的起始浓度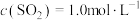 ,
,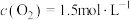 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为___________ 。
(4)在 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=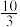 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时正反应速率
,则反应开始时正反应速率___________ (填“>”、“=”或“<”)逆反应速率。
 ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
(1)向反应体系中加入催化剂后,图中


(2)已知:

 ;
;
 ;若
;若 与
与 反应产生
反应产生 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(3)某温度下,反应的起始浓度
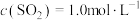 ,
,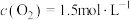 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为(4)在
 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=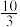 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时正反应速率
,则反应开始时正反应速率
更新时间:2023-12-12 11:42:36
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)⇌2NO(g) ΔH1=+180kJ·mol-1
②2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若已知CO的燃烧热即ΔH3=-283.5kJ·mol-1,则反应②的ΔH2=___________ kJ·mol-1。
(2)若在恒温恒容密闭容器中充入2molCO(g)和1molNO(g),发生反应②,下列选项中能说明反应已达到平衡状态的是___________(填标号)。
(3)CO和NO2也可反应,热化学方程式为2NO2(g)+4CO(g)⇌N2(g)+4CO2(g) ΔH4<0。T℃时,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如下:
①0~5min内,v正(CO2)=________ mol·L-1·min-1;该温度下反应的化学平衡常数K=________ (用分数表达)L·mol-1。
②其他条件不变,升高温度,NO2的平衡转化率___________ (填“增大”、“减小”或“不变”,下同),混合气体的密度___________ 。
③20min时,将容器改为恒温恒压且体积仍为2L,再向容器中通入0.4molCO、0.7molN2和0.4molCO2,此时v正___________ v逆(填“>”“<”或“=”)。
①N2(g)+O2(g)⇌2NO(g) ΔH1=+180kJ·mol-1
②2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若已知CO的燃烧热即ΔH3=-283.5kJ·mol-1,则反应②的ΔH2=
(2)若在恒温恒容密闭容器中充入2molCO(g)和1molNO(g),发生反应②,下列选项中能说明反应已达到平衡状态的是___________(填标号)。
| A.CO和NO的物质的量之比不变 | B.该反应的化学平衡常数不变 |
| C.混合气体的压强保持不变 | D.v正(N2)=2v逆(CO) |
| 0min | 5min | 10min | 15min | 20min | |
| n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
| n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
②其他条件不变,升高温度,NO2的平衡转化率
③20min时,将容器改为恒温恒压且体积仍为2L,再向容器中通入0.4molCO、0.7molN2和0.4molCO2,此时v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】“加大力度保护自然,实现可持续发展”是第五届联合国环境大会会议主题.工业生产产生的含 、
、 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
(1)在一定条件下,肼 与
与 ,反应能生成
,反应能生成 和
和 。
。
已知:① ;
;
② ;
;
③ ;
;
则反应 的
的
_______  。
。
(2)在一恒容密闭容器中发生反应: .当温度高于250℃时,正,逆反应速率分别为
.当温度高于250℃时,正,逆反应速率分别为 、
、 ,
, 、
、 分别为正,逆反应速率常数,
分别为正,逆反应速率常数, 、
、 与该反应的平衡常数K之间的关系为
与该反应的平衡常数K之间的关系为_______ .速率常数k随温度的升高而增大,则达到平衡后,仅升高温度, 增大的倍数
增大的倍数_______ (填“≥”、“≤”或“≈”) 增大的倍数。
增大的倍数。
(3)在一定条件下,利用催化净化技术,CO可将NO2转化为无毒物质,反应为 .向两个容积均为2L的恒容密闭容器中均分别充入
.向两个容积均为2L的恒容密闭容器中均分别充入 和
和 ,分别在220℃和300℃下发生反应.测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为
,分别在220℃和300℃下发生反应.测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为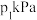 .曲线Ⅱ代表的体系平衡后气体的总压强为
.曲线Ⅱ代表的体系平衡后气体的总压强为 。
。

①代表220℃条件下的变化曲线为_______ (填“Ⅰ”或“Ⅱ”);ad段 的平均反应速率为
的平均反应速率为_______  。
。
②下列有关曲线Ⅱ条件下的反应的说法正确的是_______ (填标号)。
A.当体系中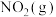 与
与 的物质的量之比不随时间变化时,反应达到平衡状态
的物质的量之比不随时间变化时,反应达到平衡状态
B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高 的转化率
的转化率
③在曲线Ⅱ代表的温度下,该反应的平衡常数
_______  (
( 为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
 、
、 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。(1)在一定条件下,肼
 与
与 ,反应能生成
,反应能生成 和
和 。
。已知:①
 ;
;②
 ;
;③
 ;
;则反应
 的
的
 。
。(2)在一恒容密闭容器中发生反应:
 .当温度高于250℃时,正,逆反应速率分别为
.当温度高于250℃时,正,逆反应速率分别为 、
、 ,
, 、
、 分别为正,逆反应速率常数,
分别为正,逆反应速率常数, 、
、 与该反应的平衡常数K之间的关系为
与该反应的平衡常数K之间的关系为 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)在一定条件下,利用催化净化技术,CO可将NO2转化为无毒物质,反应为
 .向两个容积均为2L的恒容密闭容器中均分别充入
.向两个容积均为2L的恒容密闭容器中均分别充入 和
和 ,分别在220℃和300℃下发生反应.测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为
,分别在220℃和300℃下发生反应.测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为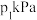 .曲线Ⅱ代表的体系平衡后气体的总压强为
.曲线Ⅱ代表的体系平衡后气体的总压强为 。
。
①代表220℃条件下的变化曲线为
 的平均反应速率为
的平均反应速率为 。
。②下列有关曲线Ⅱ条件下的反应的说法正确的是
A.当体系中
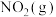 与
与 的物质的量之比不随时间变化时,反应达到平衡状态
的物质的量之比不随时间变化时,反应达到平衡状态B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高
 的转化率
的转化率③在曲线Ⅱ代表的温度下,该反应的平衡常数

 (
( 为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】Ti、Na、Mg、C、N、O、Fe等元素单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式___________ 。
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为___________ 。
(3)钠在火焰上灼烧产生的黄光是一种___________ (填字母)。
A.原子吸收光谱 B.原子发射光谱
(4)钢铁发生吸氧腐蚀时正极的电极反应式为:___________ 。为防止钢铁输水管的腐蚀,可用导线将其与镁块连接,这种防护方法为___________ 。(电化学保护法中的一种)
(5)基态 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为___________ ,其价电子轨道表示式为___________ 。
(6)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是___________ 。
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为
(3)钠在火焰上灼烧产生的黄光是一种
A.原子吸收光谱 B.原子发射光谱
(4)钢铁发生吸氧腐蚀时正极的电极反应式为:
(5)基态
 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为(6)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是
您最近一年使用:0次
【推荐1】研究发现,NOx和SO2是雾霾的主要成分。
I.NOx主要来源于汽车尾气。
已知: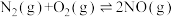
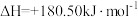

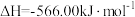
(1)为减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式:_______ 。
(2)T℃时,将等物质的量的NO和CO充入容积为4 L的密闭容器中,保持温度和体积不变,反应过程(0~l5 min)中NO的物质的量随时间变化的关系如下图所示。
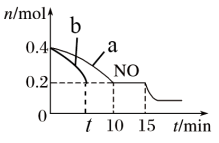
①图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较小的曲线是_______ (填“a”或“b”)。
②T℃时,该化学反应的平衡常数K=_______ ;平衡时若保持温度不变,再向容器中充入NO为0.2 mol、N2为0.3 mol,则平衡将_______ 移动(填“向左”“向右”或“不”)。
II.SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为NaHSO3,则该反应的化学方程式是_______ 。
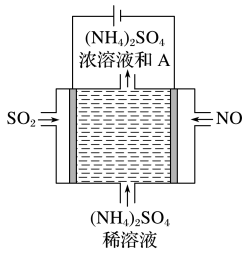
(4)如图电解装置可将雾霾中的NO、SO2分别转化为 和
和 ,则阳极的电极反应是
,则阳极的电极反应是_______ ;若将所得物质A溶于适量水配成稀溶液,则该溶液中存在的电荷守恒等式为_______ 。
I.NOx主要来源于汽车尾气。
已知:
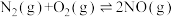
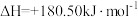

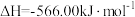
(1)为减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式:
(2)T℃时,将等物质的量的NO和CO充入容积为4 L的密闭容器中,保持温度和体积不变,反应过程(0~l5 min)中NO的物质的量随时间变化的关系如下图所示。

①图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较小的曲线是
②T℃时,该化学反应的平衡常数K=
II.SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为NaHSO3,则该反应的化学方程式是
(4)如图电解装置可将雾霾中的NO、SO2分别转化为
 和
和 ,则阳极的电极反应是
,则阳极的电极反应是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(1) 俗称“笑气”,曾用作麻醉剂。一定温度下
俗称“笑气”,曾用作麻醉剂。一定温度下 在某催化剂(cat)表面分解生成
在某催化剂(cat)表面分解生成 和
和 ,
,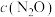 与催化剂面积、时间的关系如图所示:
与催化剂面积、时间的关系如图所示:
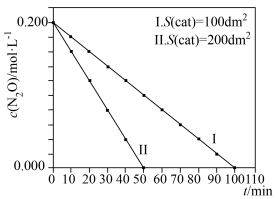
①根据直线Ⅰ、Ⅱ可得出的结论是,其他条件相同时,___________ 。
②在Ⅱ条件下,50min内 平均分解速率为
平均分解速率为___________ 。
③若 起始浓度
起始浓度 为0.400mol⋅L-1,比较不同起始浓度时
为0.400mol⋅L-1,比较不同起始浓度时 的平均分解速率:v(
的平均分解速率:v( mol⋅L-1)
mol⋅L-1)___________ v( mol⋅L-1)。(填“>”“=”或“<”)
mol⋅L-1)。(填“>”“=”或“<”)
(2)在 (Ⅲ)铁原子簇表面,反应
(Ⅲ)铁原子簇表面,反应
 的反应机理如下:
的反应机理如下:
ⅰ.

ⅱ.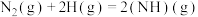

ⅲ.

ⅳ.
①
___________ O(填“>”或“<”)。
②该机理中,速率控制步骤为___________ ,理由是___________ 。
(3)利用 的还原性可以消除氮氧化物的污染,反应原理之一为
的还原性可以消除氮氧化物的污染,反应原理之一为

 kJ⋅mol-1,当该反应转移3mol电子时,应放出热量
kJ⋅mol-1,当该反应转移3mol电子时,应放出热量___________ kJ;已知该反应的 kJ⋅mol-1⋅K-1,试通过计算说明该反应常温下(298K)能否自发?
kJ⋅mol-1⋅K-1,试通过计算说明该反应常温下(298K)能否自发?___________ 。
(1)
 俗称“笑气”,曾用作麻醉剂。一定温度下
俗称“笑气”,曾用作麻醉剂。一定温度下 在某催化剂(cat)表面分解生成
在某催化剂(cat)表面分解生成 和
和 ,
, 与催化剂面积、时间的关系如图所示:
与催化剂面积、时间的关系如图所示:
①根据直线Ⅰ、Ⅱ可得出的结论是,其他条件相同时,
②在Ⅱ条件下,50min内
 平均分解速率为
平均分解速率为③若
 起始浓度
起始浓度 为0.400mol⋅L-1,比较不同起始浓度时
为0.400mol⋅L-1,比较不同起始浓度时 的平均分解速率:v(
的平均分解速率:v( mol⋅L-1)
mol⋅L-1) mol⋅L-1)。(填“>”“=”或“<”)
mol⋅L-1)。(填“>”“=”或“<”)(2)在
 (Ⅲ)铁原子簇表面,反应
(Ⅲ)铁原子簇表面,反应
 的反应机理如下:
的反应机理如下:ⅰ.


ⅱ.
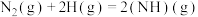

ⅲ.


ⅳ.

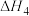
①

②该机理中,速率控制步骤为
(3)利用
 的还原性可以消除氮氧化物的污染,反应原理之一为
的还原性可以消除氮氧化物的污染,反应原理之一为

 kJ⋅mol-1,当该反应转移3mol电子时,应放出热量
kJ⋅mol-1,当该反应转移3mol电子时,应放出热量 kJ⋅mol-1⋅K-1,试通过计算说明该反应常温下(298K)能否自发?
kJ⋅mol-1⋅K-1,试通过计算说明该反应常温下(298K)能否自发?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________ 。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________ 。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____ 。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某城市场上销售的一种食用精制盐包装袋上有如下部分说明:
已知:IO +5I-+6H+ = 3I2+3H2O,I2+2S2O
+5I-+6H+ = 3I2+3H2O,I2+2S2O = 2I-+S4O
= 2I-+S4O 某学生拟测定食用精制盐的碘含量,其步骤为
某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________ ,恰好完全反应时的现象是_______________ 。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________ (填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________ mg·kg-1(计算结果保留整数即可)。
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
| 实验序号 | ① | ② |
| 加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 |
| 褪色时间/s | 116 | 6 |
请回答:
(1)该实验结论是
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为
| 实验序号 | ③ |
| 加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
| 褪色时间/s |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
| 碘含量(以I计) | 20~50 mg·kg-1 |
 +5I-+6H+ = 3I2+3H2O,I2+2S2O
+5I-+6H+ = 3I2+3H2O,I2+2S2O = 2I-+S4O
= 2I-+S4O 某学生拟测定食用精制盐的碘含量,其步骤为
某学生拟测定食用精制盐的碘含量,其步骤为a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)
您最近一年使用:0次
【推荐1】已知汽车尾气排放时容易发生以下反应:
Ⅰ.N2(g)+O2(g) 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1
Ⅱ.2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH2
N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若CO的燃烧热(ΔH3)为-283.5 kJ·mol-1,则反应Ⅱ的ΔH2=_______ kJ·mol-1。
(2)若在恒容密闭容器中充入2 mol CO(g)和1 mol NO(g),发生反应Ⅱ,下列选项中不能说明反应已达到平衡状态的是_______ (填标号)。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.v正(N2)=2v逆(CO)
(3)CO和NO2也可发生类似于反应Ⅱ的变化,热化学方程式为2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:
N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:
①0~5 min内,v正(CO2)=_______ mol·L-1·min-1;该温度下反应的化学平衡常数K=_______ (保留两位有效数字)L·mol-1。
②其他条件不变,升高温度,NO2的平衡转化率_______ (填“增大”、“减小”或“不变”,下同),混合气体的密度_______ 。
③20 min时,保持温度、压强不变,将容器改为恒温恒压密闭容器,再向容器中通入0.4 mol CO、0.7 mol N2和0.4 mol CO2,此时v正_______ v逆(填“>”“<”或“=”)。
Ⅰ.N2(g)+O2(g)
 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1Ⅱ.2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH2
N2(g)+2CO2(g) ΔH2请回答下列问题:
(1)若CO的燃烧热(ΔH3)为-283.5 kJ·mol-1,则反应Ⅱ的ΔH2=
(2)若在恒容密闭容器中充入2 mol CO(g)和1 mol NO(g),发生反应Ⅱ,下列选项中不能说明反应已达到平衡状态的是
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.v正(N2)=2v逆(CO)
(3)CO和NO2也可发生类似于反应Ⅱ的变化,热化学方程式为2NO2(g)+4CO(g)
 N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:
N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:| 0 min | 5 min | 10 min | 15 min | 20 min | |
| c(NO2)/mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②其他条件不变,升高温度,NO2的平衡转化率
③20 min时,保持温度、压强不变,将容器改为恒温恒压密闭容器,再向容器中通入0.4 mol CO、0.7 mol N2和0.4 mol CO2,此时v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学工业与人类的生产生活息息相关,回答下列问题:
已知反应: Fe(s)+CO2(g) FeO(s)+CO(g) △H =a kJ・mol-1,测得在不同温度下,平衡常数 K 值如下:
FeO(s)+CO(g) △H =a kJ・mol-1,测得在不同温度下,平衡常数 K 值如下:
(1)写出 K 的表达式__________________ 。
(2)反应中的 a____________ 0(填“>”、“<”或“=”)。
(3)若 500℃时进行反应,CO2 起始浓度为 3mol・L-1,CO 的平衡浓度为______ mol・L-1。
(4)700 ℃时反应达到平衡,要使该平衡向右移动且能增大 CO2(g)的转化率,其他条件不变时,可以采取的措施有________ (填序号)。
A.升高温度到 900 ℃ B.通入 CO2
C.增加 Fe 的量 D.使用合适的催化剂
(5)700℃反应达到平衡,此时增大反应中 CO 的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和 CO2 的体积比值__________ (填“增大”、“减小”或 “不变”)。
已知反应: Fe(s)+CO2(g)
 FeO(s)+CO(g) △H =a kJ・mol-1,测得在不同温度下,平衡常数 K 值如下:
FeO(s)+CO(g) △H =a kJ・mol-1,测得在不同温度下,平衡常数 K 值如下:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)反应中的 a
(3)若 500℃时进行反应,CO2 起始浓度为 3mol・L-1,CO 的平衡浓度为
(4)700 ℃时反应达到平衡,要使该平衡向右移动且能增大 CO2(g)的转化率,其他条件不变时,可以采取的措施有
A.升高温度到 900 ℃ B.通入 CO2
C.增加 Fe 的量 D.使用合适的催化剂
(5)700℃反应达到平衡,此时增大反应中 CO 的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和 CO2 的体积比值
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+ O2(g) 2SO3(g) △H=mkJ·mol-1,K的大小与温度(T)的关系如右图中曲线所示,则m
2SO3(g) △H=mkJ·mol-1,K的大小与温度(T)的关系如右图中曲线所示,则m________ 0(填“>”“=”或“<”);b点时υ(正)_____ υ(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将_____________ (填“增大”、“减小”或“不变”)。

(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。

(3)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeSO4·7H2O),反应中作还原剂的物质是_________ 。
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是_____________________________________________
②在(NH4)2SO4溶液中存在:NH4++H2O⇌NH3·H2O+H+,则该反应常温下的平衡常数K=____________________ (已知:常温下, 的电离平衡常数Kb=1.7×10—5mol·L—1)
的电离平衡常数Kb=1.7×10—5mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)______________ 。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为_________________ mol/L(已知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
(1)某温度下,2SO2(g)+ O2(g)
 2SO3(g) △H=mkJ·mol-1,K的大小与温度(T)的关系如右图中曲线所示,则m
2SO3(g) △H=mkJ·mol-1,K的大小与温度(T)的关系如右图中曲线所示,则m
(2)若反应物起始的物质的量相同,下列关系图错误的是

(3)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeSO4·7H2O),反应中作还原剂的物质是
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2O⇌NH3·H2O+H+,则该反应常温下的平衡常数K=
 的电离平衡常数Kb=1.7×10—5mol·L—1)
的电离平衡常数Kb=1.7×10—5mol·L—1)(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)
您最近一年使用:0次
【推荐1】我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改变环境、实现绿色发展至关重要。因此,研发 利用技术、降低空气中
利用技术、降低空气中 含量成为化学科学家研究的热点。回答下列问题:
含量成为化学科学家研究的热点。回答下列问题:
(1)已知: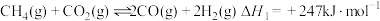
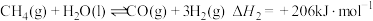
则
_______  。
。
(2)利用工业废气中的 可制取甲醇,其反应为
可制取甲醇,其反应为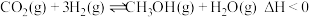 。为探究用
。为探究用 生产燃料
生产燃料 的反应原理,现进行如下实验:在T℃时,向2L恒容密闭容器中充入
的反应原理,现进行如下实验:在T℃时,向2L恒容密闭容器中充入 和
和 ,进行上述反应,10min时反应达到平衡,0~10min内,
,进行上述反应,10min时反应达到平衡,0~10min内, 的反应速率为
的反应速率为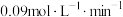 。该温度下的平衡常数K=
。该温度下的平衡常数K=_______ (保留三位有效数字)。
(3)电化学法将 转化为甲酸。科学家近年发明了一种新型
转化为甲酸。科学家近年发明了一种新型 水介质电池。如图-1所示,电极分别为金属铈和选择性催化材料,放电时,
水介质电池。如图-1所示,电极分别为金属铈和选择性催化材料,放电时, 被转化为储氢物质甲酸。
被转化为储氢物质甲酸。
注:双极隔膜为一层阳离子交换膜和一层阴离子交换膜复合而成,中间为水,作为电解质溶液中 和
和 的来源。
的来源。
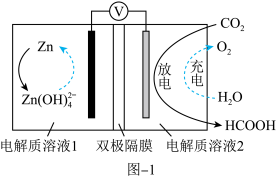
①放电时,正极电极反应式为_______ 。
②与Zn极室相连的离子交换膜为_______ 。
(4)热化学法将 转化为甲醇。
转化为甲醇。 催化加氢主要反应有:
催化加氢主要反应有:
反应Ⅰ.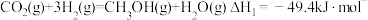
反应Ⅱ.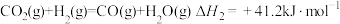
压强分别为 、
、 时,将
时,将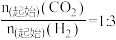 的混合气体置于密闭容器中反应,不同温度下平衡时体系中
的混合气体置于密闭容器中反应,不同温度下平衡时体系中 转化率和
转化率和 (或CO)选择性如图-2所示。
(或CO)选择性如图-2所示。

已知: (或CO)的选择性
(或CO)的选择性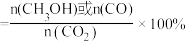
①曲线①代表的是_______ 的选择性曲线(填“ ”或“CO”)。
”或“CO”)。
②
_______  (选填“=”、“>”或“<”)。
(选填“=”、“>”或“<”)。
③温度高于250℃,曲线②或曲线③上升的原因是_______ 。
 利用技术、降低空气中
利用技术、降低空气中 含量成为化学科学家研究的热点。回答下列问题:
含量成为化学科学家研究的热点。回答下列问题:(1)已知:
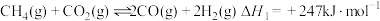
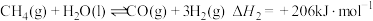
则

 。
。(2)利用工业废气中的
 可制取甲醇,其反应为
可制取甲醇,其反应为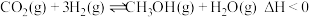 。为探究用
。为探究用 生产燃料
生产燃料 的反应原理,现进行如下实验:在T℃时,向2L恒容密闭容器中充入
的反应原理,现进行如下实验:在T℃时,向2L恒容密闭容器中充入 和
和 ,进行上述反应,10min时反应达到平衡,0~10min内,
,进行上述反应,10min时反应达到平衡,0~10min内, 的反应速率为
的反应速率为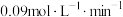 。该温度下的平衡常数K=
。该温度下的平衡常数K=(3)电化学法将
 转化为甲酸。科学家近年发明了一种新型
转化为甲酸。科学家近年发明了一种新型 水介质电池。如图-1所示,电极分别为金属铈和选择性催化材料,放电时,
水介质电池。如图-1所示,电极分别为金属铈和选择性催化材料,放电时, 被转化为储氢物质甲酸。
被转化为储氢物质甲酸。注:双极隔膜为一层阳离子交换膜和一层阴离子交换膜复合而成,中间为水,作为电解质溶液中
 和
和 的来源。
的来源。
①放电时,正极电极反应式为
②与Zn极室相连的离子交换膜为
(4)热化学法将
 转化为甲醇。
转化为甲醇。 催化加氢主要反应有:
催化加氢主要反应有:反应Ⅰ.
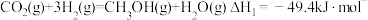
反应Ⅱ.
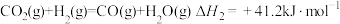
压强分别为
 、
、 时,将
时,将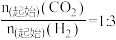 的混合气体置于密闭容器中反应,不同温度下平衡时体系中
的混合气体置于密闭容器中反应,不同温度下平衡时体系中 转化率和
转化率和 (或CO)选择性如图-2所示。
(或CO)选择性如图-2所示。
已知:
 (或CO)的选择性
(或CO)的选择性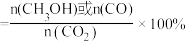
①曲线①代表的是
 ”或“CO”)。
”或“CO”)。②

 (选填“=”、“>”或“<”)。
(选填“=”、“>”或“<”)。③温度高于250℃,曲线②或曲线③上升的原因是
您最近一年使用:0次
【推荐2】硫化氢气体是石油钻井过程中经常遇到的腐蚀性气体之一,属于常见的酸性有害气体,其转化和综合应用是资源利用和环境保护的重要研究课题。
(1)工业上用克劳斯工艺处理含H2S的尾气获得硫磺,反应过程如下:
反应炉中的反应:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=-1035.6kJ·mol-1
催化转化器中的反应:2H2S(g)+SO2(g)=3S(g)+2H2O(g) △H=-92.8kJ·mol-1
则克劳斯工艺中获得气态硫磺的总反应的热化学方程式为:____ 。
(2)工业上可以通过硫化氢分解制得H2和硫蒸气,其中H2S气体的平衡转化率与温度、压强的关系如图1所示。

①由图1可知,2H2(g)+S2(g)=2H2S(g)△H____ 0(填“>”或“<”)。
②图1中压强(p1、p2、p3)的大小顺序为____ ,理由是____ 。
(3)Binoist等进行了H2S热分解实验:2H2S(g)=2H2(g)+S2(g),开始时,当1molH2S与23.75molAr混合,在101kPa及不同温度下反应达平衡时H2、H2S及S2(g)的体积分数如图2所示。其中曲线c为____ ,该反应在Q点对应温度下的平衡常数Kp=____ kPa(Kp为以分压表示的平衡常数,结果保留小数点后两位)。

(4)利用如图3所示的电化学装置处理工业尾气中的硫化氢,总反应为2H2S+O2=S2+2H2O,其中电势较高的电极为____ (填“A”或“B”),电极B发生反应的电极方程式为____ 。

(1)工业上用克劳斯工艺处理含H2S的尾气获得硫磺,反应过程如下:
反应炉中的反应:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=-1035.6kJ·mol-1
催化转化器中的反应:2H2S(g)+SO2(g)=3S(g)+2H2O(g) △H=-92.8kJ·mol-1
则克劳斯工艺中获得气态硫磺的总反应的热化学方程式为:
(2)工业上可以通过硫化氢分解制得H2和硫蒸气,其中H2S气体的平衡转化率与温度、压强的关系如图1所示。

①由图1可知,2H2(g)+S2(g)=2H2S(g)△H
②图1中压强(p1、p2、p3)的大小顺序为
(3)Binoist等进行了H2S热分解实验:2H2S(g)=2H2(g)+S2(g),开始时,当1molH2S与23.75molAr混合,在101kPa及不同温度下反应达平衡时H2、H2S及S2(g)的体积分数如图2所示。其中曲线c为

(4)利用如图3所示的电化学装置处理工业尾气中的硫化氢,总反应为2H2S+O2=S2+2H2O,其中电势较高的电极为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 加氢制化工原料对实现“碳中和”有重大意义。部分
加氢制化工原料对实现“碳中和”有重大意义。部分 加氢反应的热化学方程式如下:
加氢反应的热化学方程式如下:
反应Ⅰ: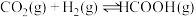

反应Ⅱ:

反应Ⅲ: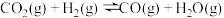

反应Ⅳ:

回答下列问题:
(1)已知:
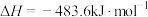


___________  。
。
(2) 催化加氢体系中,部分反应的
催化加氢体系中,部分反应的 与温度(T)关系如图1所示:
与温度(T)关系如图1所示:

①300K时,反应进行趋势最大的是___________ (填“Ⅱ”、“Ⅲ”或“Ⅳ”)。
②图1中Q点时,反应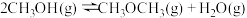 的
的
___________ 。
③实验测得 平衡转化率(曲线Y)和平衡时
平衡转化率(曲线Y)和平衡时 的选择性(曲线X)随温度变化如图2所示。
的选择性(曲线X)随温度变化如图2所示。 加氢制
加氢制 时,温度选择510~550K的原因为
时,温度选择510~550K的原因为___________ 。(已知: 的选择性
的选择性 )
)
④510K时,往刚性容器中通入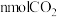 和一定量
和一定量 ,tmin达到平衡,tmin内
,tmin达到平衡,tmin内 的平均生成速率为
的平均生成速率为___________  。
。
(3)我国科学家以Bi为电极在酸性水溶液中可实现电催化还原 ,两种途径的反应机理如下图所示,其中,TS表示过渡态、数字表示微粒的相对总能量。
,两种途径的反应机理如下图所示,其中,TS表示过渡态、数字表示微粒的相对总能量。

①途径一, 电还原经两步反应生成HCOOH:第一步为
电还原经两步反应生成HCOOH:第一步为 (*表示微粒与Bi的接触位点);第二步为
(*表示微粒与Bi的接触位点);第二步为___________ 。
② 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是___________ 。
 加氢制化工原料对实现“碳中和”有重大意义。部分
加氢制化工原料对实现“碳中和”有重大意义。部分 加氢反应的热化学方程式如下:
加氢反应的热化学方程式如下:反应Ⅰ:
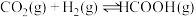

反应Ⅱ:


反应Ⅲ:
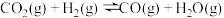

反应Ⅳ:


回答下列问题:
(1)已知:

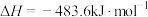


 。
。(2)
 催化加氢体系中,部分反应的
催化加氢体系中,部分反应的 与温度(T)关系如图1所示:
与温度(T)关系如图1所示:
①300K时,反应进行趋势最大的是
②图1中Q点时,反应
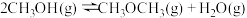 的
的
③实验测得
 平衡转化率(曲线Y)和平衡时
平衡转化率(曲线Y)和平衡时 的选择性(曲线X)随温度变化如图2所示。
的选择性(曲线X)随温度变化如图2所示。 加氢制
加氢制 时,温度选择510~550K的原因为
时,温度选择510~550K的原因为 的选择性
的选择性 )
)④510K时,往刚性容器中通入
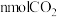 和一定量
和一定量 ,tmin达到平衡,tmin内
,tmin达到平衡,tmin内 的平均生成速率为
的平均生成速率为 。
。(3)我国科学家以Bi为电极在酸性水溶液中可实现电催化还原
 ,两种途径的反应机理如下图所示,其中,TS表示过渡态、数字表示微粒的相对总能量。
,两种途径的反应机理如下图所示,其中,TS表示过渡态、数字表示微粒的相对总能量。
①途径一,
 电还原经两步反应生成HCOOH:第一步为
电还原经两步反应生成HCOOH:第一步为 (*表示微粒与Bi的接触位点);第二步为
(*表示微粒与Bi的接触位点);第二步为②
 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是
您最近一年使用:0次



