Ti、Na、Mg、C、N、O、Fe等元素单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式___________ 。
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为___________ 。
(3)钠在火焰上灼烧产生的黄光是一种___________ (填字母)。
A.原子吸收光谱 B.原子发射光谱
(4)钢铁发生吸氧腐蚀时正极的电极反应式为:___________ 。为防止钢铁输水管的腐蚀,可用导线将其与镁块连接,这种防护方法为___________ 。(电化学保护法中的一种)
(5)基态 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为___________ ,其价电子轨道表示式为___________ 。
(6)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是___________ 。
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为
(3)钠在火焰上灼烧产生的黄光是一种
A.原子吸收光谱 B.原子发射光谱
(4)钢铁发生吸氧腐蚀时正极的电极反应式为:
(5)基态
 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为(6)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是
更新时间:2024-02-04 14:12:17
|
相似题推荐
【推荐1】氯和碳的单质和化合物与生产、生活关系密切,其综合利用是科研领域的传统热本点。
已知:①
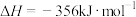
②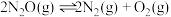
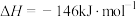
回答下列问题:
(1) 的燃烧热
的燃烧热
_______ 。
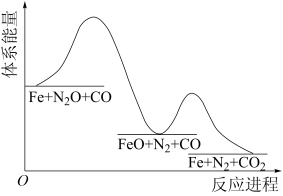
(2)如图为反应Ⅰ的能量变化示意图,两步过程中第_______ (填“1”或“2”)步的速率较快, 在反应中的作用是
在反应中的作用是_______ 。
(3)向体积为 的恒容密闭容器中充入
的恒容密闭容器中充入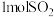 、
、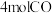 和催反应进程化剂,发生反应
和催反应进程化剂,发生反应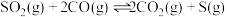
 ,测得温度对
,测得温度对 的转化率及催化剂效率的影响如下图所示:
的转化率及催化剂效率的影响如下图所示:
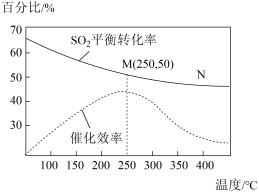
①该反应的
_______ 0(填>”或“<”,下同)
②若M点时的体系压强为P,求M点时的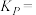
_______ 。
(4)向浓度均为 的
的 和
和 混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随
混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随 的变化如图所示[已知:
的变化如图所示[已知: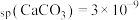 ]:
]:
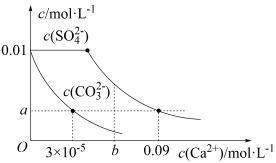
①图中
_______ 。
②该温度下,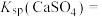
_______ 。
已知:①

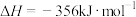
②
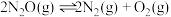
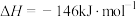
回答下列问题:
(1)
 的燃烧热
的燃烧热
(2)如图为反应Ⅰ的能量变化示意图,两步过程中第
 在反应中的作用是
在反应中的作用是
(3)向体积为
 的恒容密闭容器中充入
的恒容密闭容器中充入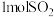 、
、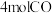 和催反应进程化剂,发生反应
和催反应进程化剂,发生反应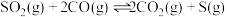
 ,测得温度对
,测得温度对 的转化率及催化剂效率的影响如下图所示:
的转化率及催化剂效率的影响如下图所示:
①该反应的

②若M点时的体系压强为P,求M点时的
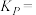
(4)向浓度均为
 的
的 和
和 混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随
混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随 的变化如图所示[已知:
的变化如图所示[已知: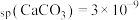 ]:
]:
①图中

②该温度下,
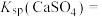
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.甲醇是一种高效清洁的新能源,已知在常温常压下:

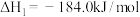

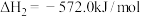
(1)则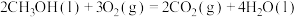

___________  。
。
Ⅱ.在恒温恒容的密闭容器中,工业上常用反应①: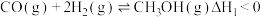 制备甲醇;其中的原料气常用反应②:
制备甲醇;其中的原料气常用反应②: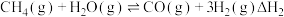 来制备。根据题意完成下列各题:
来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是___________ (填字母)。
A.容器中气体的压强不变
B.CO和 浓度相等
浓度相等
C.V消耗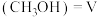 生成(CO)
生成(CO)
D.容器中混合气体的密度保持不变
E.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO的转化率,下列措施可行的是___________(填字母)。
(4)一定条件下,反应②中 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
___________ 0(填“<”、“>”或“=”),在T°C时的10L密闭容器中,充入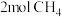 和
和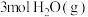 发生反应②,经过5min达到平衡,此时
发生反应②,经过5min达到平衡,此时 的转化率为50%,则从开始到平衡,
的转化率为50%,则从开始到平衡, 的平均反应速率为
的平均反应速率为___________ 。若向此10L密闭容器中,加入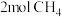 、
、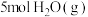 、
、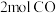 、和
、和 发生反应②,若温度仍为T°C,此时V(正)
发生反应②,若温度仍为T°C,此时V(正)___________ V(逆)(填“<”、“>”或“=”)。
(5)若某温度下,将 和
和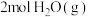 加入压强为200kPa的恒压密闭容器中发生反应②,正反应速率
加入压强为200kPa的恒压密闭容器中发生反应②,正反应速率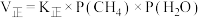 ,逆反应速率
,逆反应速率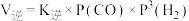 ,P为分压(分压=总压×物质的量分数),则该反应的压强平衡常数
,P为分压(分压=总压×物质的量分数),则该反应的压强平衡常数
___________ (以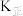 、
、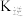 表示)。若
表示)。若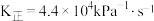 ,当
,当 消耗20%时,
消耗20%时,
___________  (保留两位有效数字)
(保留两位有效数字)

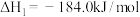

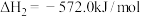
(1)则
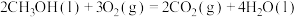

 。
。Ⅱ.在恒温恒容的密闭容器中,工业上常用反应①:
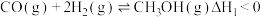 制备甲醇;其中的原料气常用反应②:
制备甲醇;其中的原料气常用反应②: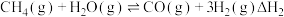 来制备。根据题意完成下列各题:
来制备。根据题意完成下列各题:(2)判断反应①达到平衡状态的标志是
A.容器中气体的压强不变
B.CO和
 浓度相等
浓度相等C.V消耗
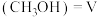 生成(CO)
生成(CO)D.容器中混合气体的密度保持不变
E.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO的转化率,下列措施可行的是___________(填字母)。
| A.减小容器容积 | B.升高温度 |
| C.向装置中再充入He | D.向装置中再充入 |
(4)一定条件下,反应②中
 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。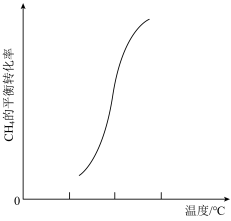

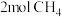 和
和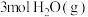 发生反应②,经过5min达到平衡,此时
发生反应②,经过5min达到平衡,此时 的转化率为50%,则从开始到平衡,
的转化率为50%,则从开始到平衡, 的平均反应速率为
的平均反应速率为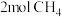 、
、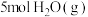 、
、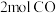 、和
、和 发生反应②,若温度仍为T°C,此时V(正)
发生反应②,若温度仍为T°C,此时V(正)(5)若某温度下,将
 和
和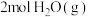 加入压强为200kPa的恒压密闭容器中发生反应②,正反应速率
加入压强为200kPa的恒压密闭容器中发生反应②,正反应速率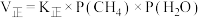 ,逆反应速率
,逆反应速率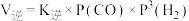 ,P为分压(分压=总压×物质的量分数),则该反应的压强平衡常数
,P为分压(分压=总压×物质的量分数),则该反应的压强平衡常数
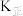 、
、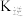 表示)。若
表示)。若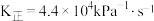 ,当
,当 消耗20%时,
消耗20%时,
 (保留两位有效数字)
(保留两位有效数字)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】液氨作为一种潜在的汽车燃料已受到人们的普遍重视。它在安全性、价格等方面比化石燃料和氢燃料有着较大的优势,氨的燃烧实验涉及下列两个反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
(1)反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=____ (用含有△H1、△H2的式子表示)。
(2)若NH3(g)
 N2(g)+
N2(g)+ H2(g)K=A,则N2(g)+3H2(g)
H2(g)K=A,则N2(g)+3H2(g) 2NH3(g)K′=
2NH3(g)K′=___ (用A表示)。
(3)向容积为3L的恒容密闭容器中投入4.0molN2和9.0molH2,在一定条件下发生反应N2(g)+3H2(g) 2NH3(g),仅改变温度测得平衡时的数据如表所示:
2NH3(g),仅改变温度测得平衡时的数据如表所示:
已知:断裂1.0molN2(g)和3.0molH2(g)中的化学键消耗的总能量小于断裂12.0molNH3(g)中的化学键消耗的能量。
①则T1____ T2(填“>”“<”或“=”)。
②在T2K下,经过10min达到化学平衡状态,则0~10min内,H2的平均反应速率v(H2)=____ mol/(L·min),平衡时N2的转化率α(N2)=____ 。
③下列图象分别代表焓变(△H)、混合气体的平均摩尔质量(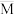 )、N2的体积分数φ(N2)和混合气体的密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是
)、N2的体积分数φ(N2)和混合气体的密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是____ (填标号)。
A.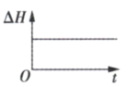 B.
B. C.
C.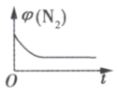 D.
D.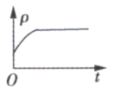
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
(1)反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=
(2)若NH3(g)

 N2(g)+
N2(g)+ H2(g)K=A,则N2(g)+3H2(g)
H2(g)K=A,则N2(g)+3H2(g) 2NH3(g)K′=
2NH3(g)K′=(3)向容积为3L的恒容密闭容器中投入4.0molN2和9.0molH2,在一定条件下发生反应N2(g)+3H2(g)
 2NH3(g),仅改变温度测得平衡时的数据如表所示:
2NH3(g),仅改变温度测得平衡时的数据如表所示:| 温度/K | 平衡时NH3的物质的量/mol |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1
②在T2K下,经过10min达到化学平衡状态,则0~10min内,H2的平均反应速率v(H2)=
③下列图象分别代表焓变(△H)、混合气体的平均摩尔质量(
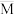 )、N2的体积分数φ(N2)和混合气体的密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是
)、N2的体积分数φ(N2)和混合气体的密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】氧化亚铜主要用于制造船底防污漆(用来杀死低级海生动物)、杀虫剂,以及各种铜盐、分析试剂、红色玻璃,还用于镀铜及镀铜合金溶液的配制。用某铜矿(主要含CuS、FeO)制备Cu2O的一种工艺流程如下图:
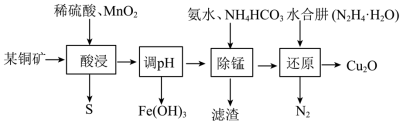
已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表:
请回答下列问题:
(1)基态Cu原子价层电子的排布图为_______ 。
(2)滤渣的主要成分是_______ (填化学式)。
(3)“酸浸”中加入MnO2的作用是_______ ;写出其中生成单质S的化学方程式_______ 。
(4)“调pH”的范围是_______ 。
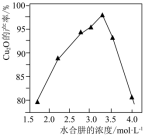
(5)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,水合肼被氧化的化学方程式为_______ ;一定体积下,保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。当水合肼浓度大于3.25mol·L-1时,[Cu(NH3)4]2+的转化率仍增大,但Cu2O的产率下降,其可能的原因是_______ 。

已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 4.8 | 1.9 | 7.5 | 8.8 |
| 沉淀完全的pH | 6.4 | 3.2 | 9.7 | 10.4 |
(1)基态Cu原子价层电子的排布图为
(2)滤渣的主要成分是
(3)“酸浸”中加入MnO2的作用是
(4)“调pH”的范围是
(5)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,水合肼被氧化的化学方程式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C、D、E是原子序数依次增大的前四周期元素。已知A元素基态原子的核外电子分占四个原子轨道;B元素与C元素同周期,B元素基态原子的成对电子数是未成对电子数的6倍;C元素基态原子只有一个不成对电子;D元素基态原子的L层与M层的电子数相等,且与s能级的电子总数相等;E3+的3d轨道中有5个电子。
请回答下列问题:
(1)基态E原子价层电子的轨道表示式为____ ;基态C原子电子占据最高能级的电子云轮廓图为____ 形。
(2)一般情况下,B元素的最高价氧化物的晶体类型为____ ;A、B元素最高价氧化物以及C元素与氧形成的化合物C2O,三种物质中心原子杂化类型相同的是____ (用化学式填空)。
(3)A、B、C、D四种元素的电负性按由大到小排序____ (用元素符号填空)。
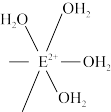
(4)[E(H2O)6]2+与NO反应生成的[E(NO)(H2O)5]2+中,NO以N原子与E2+形成配位键。请在[E(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体____ 。
请回答下列问题:
(1)基态E原子价层电子的轨道表示式为
(2)一般情况下,B元素的最高价氧化物的晶体类型为
(3)A、B、C、D四种元素的电负性按由大到小排序
(4)[E(H2O)6]2+与NO反应生成的[E(NO)(H2O)5]2+中,NO以N原子与E2+形成配位键。请在[E(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题:
(1)B元素原子的最外层轨道表示式是__ ,D离子的核外电子排布式是__ 。C和D形成的化合物的电子式为__ 。
(2)A、B、C、D的原子半径大小为:__ >__ >__ >__ (用元素符号表示)。
(3)D单质在B单质中燃烧的化学方程式为__ 。
(4)A和D两元素金属性较强的是(用元素符号表示)__ 。写出能证明该结论的一个实验事实__ 。
| A | 单质是热和电的良导体,熔点97.81℃,沸点882.9℃,在氧气中燃烧得到淡黄色固体 |
| B | 原子核外有7种运动状态不同的电子 |
| C | 单质常温、常压下是气体,原子的L层有一个未成对的p电子 |
| D | +2价阳离子的核外电子排布与氖原子相同 |
(1)B元素原子的最外层轨道表示式是
(2)A、B、C、D的原子半径大小为:
(3)D单质在B单质中燃烧的化学方程式为
(4)A和D两元素金属性较强的是(用元素符号表示)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
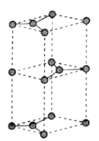
【推荐1】石墨是一种混合型晶体,具有多种晶体结构,其一种晶胞的结构如图所示.回答下列问题:____________ .
(2)碳、氮、氧三种元素的第一电离能由大到小的顺序为____________ .
(3) 是有机反应中重要的中间体,其空间结构为
是有机反应中重要的中间体,其空间结构为____________ .
(4)石墨晶体中碳原子的杂化形式为____________ ,晶体中微粒间的作用力有____________ (填字母),石墨熔点高于金刚石是因为存在____________ (填字母).
A.离子键 B.共价键 C. 键 D.氢键 E.范德华力
键 D.氢键 E.范德华力
(2)碳、氮、氧三种元素的第一电离能由大到小的顺序为
(3)
 是有机反应中重要的中间体,其空间结构为
是有机反应中重要的中间体,其空间结构为(4)石墨晶体中碳原子的杂化形式为
A.离子键 B.共价键 C.
 键 D.氢键 E.范德华力
键 D.氢键 E.范德华力
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN。
(1)基态氮原子核外电子有___________ 种不同的空间运动状态,与NO 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为___________ (写1种)。
(2)C、N、O、F四种元素的第一电离能由小到大的顺序为___________ 。
(3)在BF3分子中,F-B-F的键角是___________ ,B原子的杂化轨道类型为___________ ,BF3和过量NaF作用可生成NaBF4,BF 的立体结构为
的立体结构为___________ 。
(4)氮化硼晶体的结构与金刚石相似,其晶胞如图所示。
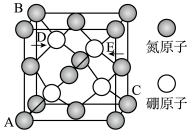
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则E原子的原子分数坐标为___________ 。
(5)氮化硼晶胞的俯视投影图是___________ 。
a.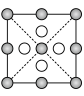 b.
b.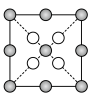 c.
c.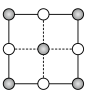 d.
d.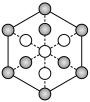
(1)基态氮原子核外电子有
 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为(2)C、N、O、F四种元素的第一电离能由小到大的顺序为
(3)在BF3分子中,F-B-F的键角是
 的立体结构为
的立体结构为(4)氮化硼晶体的结构与金刚石相似,其晶胞如图所示。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则E原子的原子分数坐标为
(5)氮化硼晶胞的俯视投影图是
a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】下图是元素周期表的一部分,其中所列字母分别代表某一元素
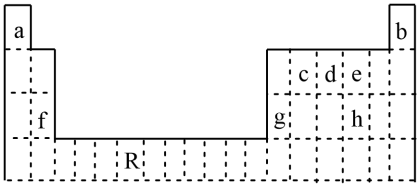
(1)写出元素R基态原子的核外电子排布式_______ 。
(2)f、g单质及fg形成的合金的硬度由大到小的顺序为_______ (用具体名称回答)
(3)写出用a,d,e三种元素组成酸、碱、盐的化学式_______ ,_______ ,_______ (每种类别写一种)
(4)元素C的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为_______ 。
(5)元素R的一种配合物的化学式为RCl3·6H2O。已知0.01molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀。此配合物最可能是_______。
(6)短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第_______ 族。
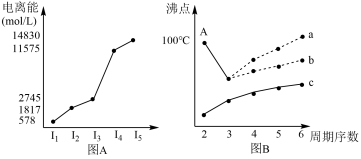
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第_______ 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:折线a和折线b,你认为正确的是_______ 。

(1)写出元素R基态原子的核外电子排布式
(2)f、g单质及fg形成的合金的硬度由大到小的顺序为
(3)写出用a,d,e三种元素组成酸、碱、盐的化学式
(4)元素C的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为
(5)元素R的一种配合物的化学式为RCl3·6H2O。已知0.01molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀。此配合物最可能是_______。
| A.[R(H2O)6]Cl3 | B.[R(H2O)5Cl]Cl2·H2O |
| C.[R(H2O)4Cl2]Cl·2H2O | D.[R(H2O)3Cl3]·3H2O |

图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
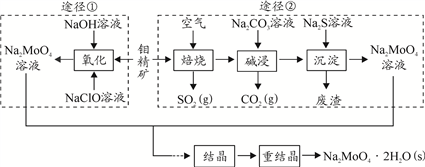
【推荐1】研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体( Na2MoO4·2H2O)的途径如图所示:
回答下列问题:
Ⅰ.(1)下列标志中,应贴在保存NaClO容器上的是___________ 。
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有_____________________ 。
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为_____________ 。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是_________________________ 。
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为______ %。(保留三位有效数字)[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起溶液体积变化可忽略]。
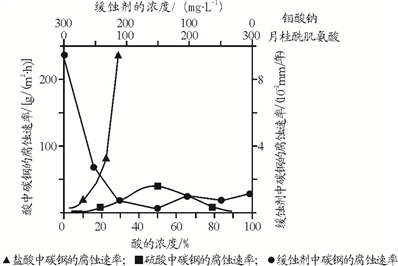
Ⅱ.(1)碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____ 。
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mg•L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为_________ (保留三位有效数字)。
回答下列问题:
Ⅰ.(1)下列标志中,应贴在保存NaClO容器上的是

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为
Ⅱ.(1)碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mg•L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
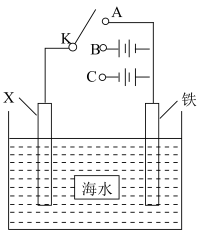
【推荐2】铁及其化合物在生产和生活中有着广泛的应用。
I.校本课程小组利用下图装置,模拟铁的电化学防护。___________ (填“A”“B”或“C”)处。若X为锌电极,开关K置于A处,该电化学保护法称为___________ 。
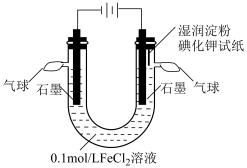
Ⅱ.校本课程小组探究不同条件对电解FeCl2溶液微粒放电能力的影响。设计如下实验,电解装置如图所示,并进行实验记录:
(2)分析实验①中阴极现象,在pH=5.52时,放电的微粒是___________ 。
(3)实验②中向阳极附近溶液滴加KSCN溶液变红,变红的原因是___________ (用离子方程式表示);实验②中阴极有气泡产生,说明pH=0.5时,阴极发生了电极反应:___________ 。
(4)溶液中有Fe2+、H+,对比①、②阴极现象,可以得出的结论是___________ 。
(5)分析阳极实验现象,甲同学得出结论:实验①、②条件下,Fe2+放电而Cl-没有放电。乙同学认为仅由实验①、②不能得出此结论,乙同学设计了实验①对照实验:在1.5V的电压、pH=5.52的情况下,电解0.2mol/L的NaCl溶液,观察阳极处是否有气泡产生,湿润的淀粉碘化钾是否变蓝。电解0.2mol/LNaCl溶液的化学方程式为___________ 。
I.校本课程小组利用下图装置,模拟铁的电化学防护。
Ⅱ.校本课程小组探究不同条件对电解FeCl2溶液微粒放电能力的影响。设计如下实验,电解装置如图所示,并进行实验记录:
| 序号 | 电压 | pH | 阳极现象 | 阴极现象 |
| ① | 1.5V | 5.52 | 无气泡产生,湿润淀粉碘化钾试纸不变蓝;电极表面逐渐析出红褐色沉淀 | 无气泡产生;电极表面有银灰色金属析出 |
| ② | 1.5V | 0.5 | 无气泡产生,湿润淀粉碘化钾试纸不变蓝;取阳极附近溶液,滴加KSCN溶液变红 | 有气泡产生;电极表面有极少量银灰色金属析出 |
(2)分析实验①中阴极现象,在pH=5.52时,放电的微粒是
(3)实验②中向阳极附近溶液滴加KSCN溶液变红,变红的原因是
(4)溶液中有Fe2+、H+,对比①、②阴极现象,可以得出的结论是
(5)分析阳极实验现象,甲同学得出结论:实验①、②条件下,Fe2+放电而Cl-没有放电。乙同学认为仅由实验①、②不能得出此结论,乙同学设计了实验①对照实验:在1.5V的电压、pH=5.52的情况下,电解0.2mol/L的NaCl溶液,观察阳极处是否有气泡产生,湿润的淀粉碘化钾是否变蓝。电解0.2mol/LNaCl溶液的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)已知: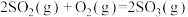
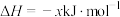
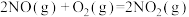
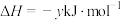
则反应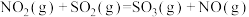 的
的 =
=______  。
。
(2)二十世纪初,工业上以 和
和 ,为原料在一定温度和压强下合成尿素。反应分两步:
,为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ. 和
和 生成
生成 ;
;
ⅱ. 分解生成尿素。
分解生成尿素。
①合成尿素反应的热化学方程式为______ 。
②结合反应过程中能量变化示意图1,下列说法正确的是______ (填序号)。

a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.对总反应速率影响较大的是反应ⅰ
(3)某研究团队合成的低配位Cu在碱性条件下催化 还原生成乙烯的电化学装置如图2所示。
还原生成乙烯的电化学装置如图2所示。
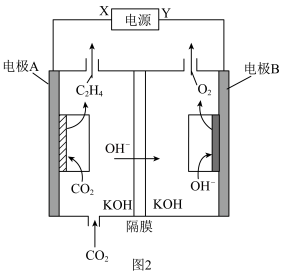
①Y为电源的______ (填“正极”或“负极”)。
②电极A上的电极反应式为______ 。
③理论上电极A上消耗的 与电极B上生成的
与电极B上生成的 的物质的量之比为
的物质的量之比为______ 。
(4)以Al和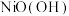 为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的
为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的______ 电极(填“Al”或“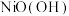 ”),该电化学防护法称为
”),该电化学防护法称为______ 。
(1)已知:
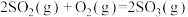
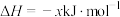
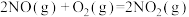
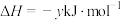
则反应
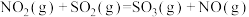 的
的 =
= 。
。(2)二十世纪初,工业上以
 和
和 ,为原料在一定温度和压强下合成尿素。反应分两步:
,为原料在一定温度和压强下合成尿素。反应分两步:ⅰ.
 和
和 生成
生成 ;
;ⅱ.
 分解生成尿素。
分解生成尿素。①合成尿素反应的热化学方程式为
②结合反应过程中能量变化示意图1,下列说法正确的是

a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.对总反应速率影响较大的是反应ⅰ
(3)某研究团队合成的低配位Cu在碱性条件下催化
 还原生成乙烯的电化学装置如图2所示。
还原生成乙烯的电化学装置如图2所示。
①Y为电源的
②电极A上的电极反应式为
③理论上电极A上消耗的
 与电极B上生成的
与电极B上生成的 的物质的量之比为
的物质的量之比为(4)以Al和
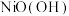 为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的
为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的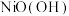 ”),该电化学防护法称为
”),该电化学防护法称为
您最近一年使用:0次



