解题方法
1 . 运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO还原NO的反应为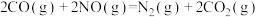 ,请回答下列问题:
,请回答下列问题:
①已知该反应为自发反应,则该反应的反应热△H_______ 0(填“>”或“<”或“=”)
②已知: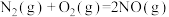


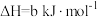
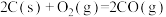

则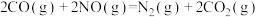 △H =
△H =______  (用含a、b、c的表达式表示)。
(用含a、b、c的表达式表示)。
③一定温度下,将2 mol CO、4 mol NO充入2 L密闭容器。5 min到达平衡,测得N2的物质的量为0.5 mol,则:
i.5min内v(NO)=_______ 。
ii.该条件下,可判断此反应到达平衡的标志是_______ 。
A.单位时间内,消耗2 mol CO同时形成1 mol N2
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
④某研究小组探究催化剂对CO、NO转化的影响。将CO和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
i.由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为___________ 。
ii.若低于200℃,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因为___________ 。
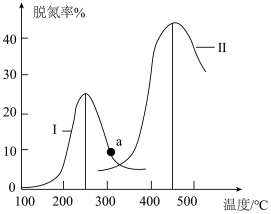
(2)用焦炭还原NO的反应为: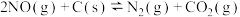 。恒容恒温条件下,向体积均为1 L的甲、乙、两三个容器中分别加入足量的焦炭和一定量的NO,测得各容器中NO的物质的量n(NO)随反应时间(t)的变化情况如下表所示:
。恒容恒温条件下,向体积均为1 L的甲、乙、两三个容器中分别加入足量的焦炭和一定量的NO,测得各容器中NO的物质的量n(NO)随反应时间(t)的变化情况如下表所示:
①T___________ 400℃(填“>”或“<”)。
②乙容器达平衡时n(N2)=___________ mol。
(1)CO还原NO的反应为
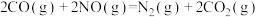 ,请回答下列问题:
,请回答下列问题:①已知该反应为自发反应,则该反应的反应热△H
②已知:
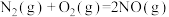


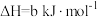
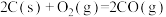

则
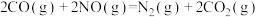 △H =
△H = (用含a、b、c的表达式表示)。
(用含a、b、c的表达式表示)。③一定温度下,将2 mol CO、4 mol NO充入2 L密闭容器。5 min到达平衡,测得N2的物质的量为0.5 mol,则:
i.5min内v(NO)=
ii.该条件下,可判断此反应到达平衡的标志是
A.单位时间内,消耗2 mol CO同时形成1 mol N2
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
④某研究小组探究催化剂对CO、NO转化的影响。将CO和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:

i.由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为
ii.若低于200℃,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因为
(2)用焦炭还原NO的反应为:
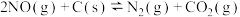 。恒容恒温条件下,向体积均为1 L的甲、乙、两三个容器中分别加入足量的焦炭和一定量的NO,测得各容器中NO的物质的量n(NO)随反应时间(t)的变化情况如下表所示:
。恒容恒温条件下,向体积均为1 L的甲、乙、两三个容器中分别加入足量的焦炭和一定量的NO,测得各容器中NO的物质的量n(NO)随反应时间(t)的变化情况如下表所示:
容器 | 0 | 40 | 80 | 120 | 160 |
| 甲/400℃ | 2.00 | 1.5 | 1.10 | 0.80 | 0.80 |
| 乙/400℃ | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| 丙/T℃ | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②乙容器达平衡时n(N2)=
您最近半年使用:0次
2 . 某温度时,ⅥA元素单质A2、B、D与H2反应生成气态H2X的热化学方程式如下:
 A2(g)+H2(g)=H2A(g)
A2(g)+H2(g)=H2A(g) 
B(g)+H2(g)=H2B(g)
D(g)+H2(g) H2D(g)
H2D(g) 
下列说法正确的是
 A2(g)+H2(g)=H2A(g)
A2(g)+H2(g)=H2A(g) 
B(g)+H2(g)=H2B(g)

D(g)+H2(g)
 H2D(g)
H2D(g) 
下列说法正确的是
| A.稳定性:H2A<H2B<H2D |
| B.降温有利于D与H2反应生成H2D |
| C.A2(g)+2H2B(g)=2H2A(g)+2B(g) ΔH=-444kJ·mol-1 |
| D.与H2的化合反应由易到难的顺序为:D>B>A2 |
您最近半年使用:0次
解题方法
3 . 煤的气化技术发展较早,近几年来煤的气化技术更多的倾向于用水煤浆与粉煤为原料的加压气化技术。煤的气化的流程示意图如下:
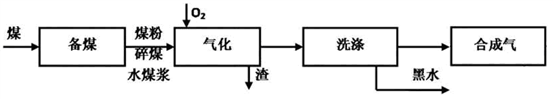
(1)煤的气化过程中,存在如下反应:
① C(s)+O2(g) CO2(g) △H1=-394.1kJ/mol
CO2(g) △H1=-394.1kJ/mol
②2CO(g)+O2(g) 2CO2(g) △H2=-566.0kJ/mol
2CO2(g) △H2=-566.0kJ/mol
③2H2(g)+O2(g) 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol
写出利用水煤浆生产水煤气的热化学方程式___________________ 。
(2)一定条件下,由H2和CO可直接制备二甲醚(CH3OCH3)(产物中还有水蒸气),结果如图所示: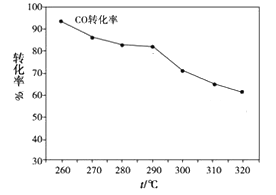
①合成二甲醚的化学方程式为___________________________
②其中CO的转化率随温度的升高而降低的原因_________________ 。
③有利于该反应充分进行的条件是______________ (填字母)
a.高温低压 b.低温高压 c.高温高压 d.低温低压
④在实际生产中选择了适宜温度和压强,原因是考虑了________ 因素
(3)图中,甲装置为CH3OCH3碱性燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
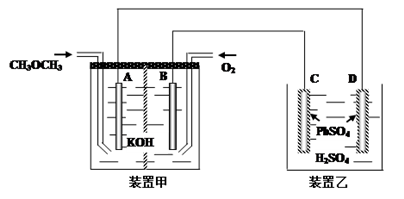
① 写出甲装置中B极的电极反应____________________________
② 写出乙装置中D极的电极反应式___________________________
③ 当有46克二甲醚参加反应时,电路中通过的电子的物质的量为____ mol

(1)煤的气化过程中,存在如下反应:
① C(s)+O2(g)
 CO2(g) △H1=-394.1kJ/mol
CO2(g) △H1=-394.1kJ/mol②2CO(g)+O2(g)
 2CO2(g) △H2=-566.0kJ/mol
2CO2(g) △H2=-566.0kJ/mol③2H2(g)+O2(g)
 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol写出利用水煤浆生产水煤气的热化学方程式
(2)一定条件下,由H2和CO可直接制备二甲醚(CH3OCH3)(产物中还有水蒸气),结果如图所示:

①合成二甲醚的化学方程式为
②其中CO的转化率随温度的升高而降低的原因
③有利于该反应充分进行的条件是
a.高温低压 b.低温高压 c.高温高压 d.低温低压
④在实际生产中选择了适宜温度和压强,原因是考虑了
(3)图中,甲装置为CH3OCH3碱性燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。

① 写出甲装置中B极的电极反应
② 写出乙装置中D极的电极反应式
③ 当有46克二甲醚参加反应时,电路中通过的电子的物质的量为
您最近半年使用:0次
4 . 第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=______ ;
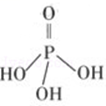
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为______ ,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为______ ;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)___________________________ ;
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:______ ;
原理上的不同点:______ ;
化学镀的优点:______ .
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为

(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:
原理上的不同点:
化学镀的优点:
您最近半年使用:0次
2014-06-17更新
|
1050次组卷
|
4卷引用:2015届北京市怀柔区高三4月模拟练习化学试卷
2015届北京市怀柔区高三4月模拟练习化学试卷(已下线)2013-2014宁夏银川市第一中学高三第二次模拟考试理综化学试卷贵州省织金县一中2019届高三上学期12月份考试化学试题山东省泰安市2020届高三化学一轮复习《化学与技术》专题测试





