1 . 将 转化为高附加值的化学品,对实现碳中和、可持续发展具有重要意义。
转化为高附加值的化学品,对实现碳中和、可持续发展具有重要意义。
Ⅰ.利用 催化加氢制备乙烯,反应过程主要分为两步。
催化加氢制备乙烯,反应过程主要分为两步。
ⅰ.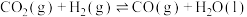

ⅱ.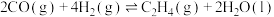
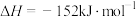
(1) 和
和 反应制备乙烯的热化学方程式为
反应制备乙烯的热化学方程式为___________ 。
(2)0.1MPa,投料比 的条件下研究反应ⅰ,在不同温度下达到平衡时各气体的物质的量分数如图1所示(水转化为液态,不计入)。
的条件下研究反应ⅰ,在不同温度下达到平衡时各气体的物质的量分数如图1所示(水转化为液态,不计入)。___________ 。
②800℃时, 的平衡转化率为
的平衡转化率为___________ 。
Ⅱ.利用煤气化灰渣(主要成分有CaO、 、
、 和MgO等)封存
和MgO等)封存 ,制备高纯碳酸钙。
,制备高纯碳酸钙。
ⅰ.浸出:向灰渣中加入稍过量盐酸,充分反应后过滤,得滤液a;
ⅱ.净化:向滤液a中逐渐加入氨水,金属氢氧化物分步沉淀,分步过滤,得到滤液b;
ⅲ.碳酸化:向滤液b中通入 ,过滤、洗涤、干燥,得到高纯
,过滤、洗涤、干燥,得到高纯 。
。
已知:一些金属氢氧化物在溶液中达到沉淀溶解平衡时的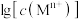 与pH关系如图2所示。
与pH关系如图2所示。___________ 。
(4)碳酸化时发生主要反应的离子方程式是___________ 。
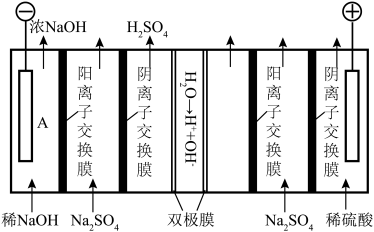
Ⅲ.利用双极膜电解 制备NaOH,捕集烟气中
制备NaOH,捕集烟气中 ,制备
,制备 。已知:双极膜为复合膜,可在直流电的作用下,将膜间的
。已知:双极膜为复合膜,可在直流电的作用下,将膜间的 解离,提供
解离,提供 和
和 。
。___________ 。
(6)当电路中转移2mol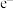 时,上图装置产生
时,上图装置产生___________ mol NaOH。
(7)制得的 固体样品中常混有
固体样品中常混有 。准确称量xg样品,下列方案中,能测定样品中
。准确称量xg样品,下列方案中,能测定样品中 纯度的是
纯度的是___________ 。
A.充分加热,固体减重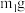
B.与足量稀盐酸充分反应,加热蒸干,得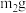 固体
固体
C.与足量稀硫酸充分反应并加热,逸出气体用碱石灰吸收,增重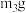
 转化为高附加值的化学品,对实现碳中和、可持续发展具有重要意义。
转化为高附加值的化学品,对实现碳中和、可持续发展具有重要意义。Ⅰ.利用
 催化加氢制备乙烯,反应过程主要分为两步。
催化加氢制备乙烯,反应过程主要分为两步。ⅰ.
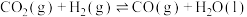

ⅱ.
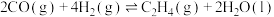
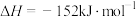
(1)
 和
和 反应制备乙烯的热化学方程式为
反应制备乙烯的热化学方程式为(2)0.1MPa,投料比
 的条件下研究反应ⅰ,在不同温度下达到平衡时各气体的物质的量分数如图1所示(水转化为液态,不计入)。
的条件下研究反应ⅰ,在不同温度下达到平衡时各气体的物质的量分数如图1所示(水转化为液态,不计入)。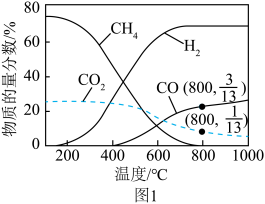
②800℃时,
 的平衡转化率为
的平衡转化率为Ⅱ.利用煤气化灰渣(主要成分有CaO、
 、
、 和MgO等)封存
和MgO等)封存 ,制备高纯碳酸钙。
,制备高纯碳酸钙。ⅰ.浸出:向灰渣中加入稍过量盐酸,充分反应后过滤,得滤液a;
ⅱ.净化:向滤液a中逐渐加入氨水,金属氢氧化物分步沉淀,分步过滤,得到滤液b;
ⅲ.碳酸化:向滤液b中通入
 ,过滤、洗涤、干燥,得到高纯
,过滤、洗涤、干燥,得到高纯 。
。已知:一些金属氢氧化物在溶液中达到沉淀溶解平衡时的
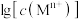 与pH关系如图2所示。
与pH关系如图2所示。
(4)碳酸化时发生主要反应的离子方程式是
Ⅲ.利用双极膜电解
 制备NaOH,捕集烟气中
制备NaOH,捕集烟气中 ,制备
,制备 。已知:双极膜为复合膜,可在直流电的作用下,将膜间的
。已知:双极膜为复合膜,可在直流电的作用下,将膜间的 解离,提供
解离,提供 和
和 。
。
(6)当电路中转移2mol
 时,上图装置产生
时,上图装置产生(7)制得的
 固体样品中常混有
固体样品中常混有 。准确称量xg样品,下列方案中,能测定样品中
。准确称量xg样品,下列方案中,能测定样品中 纯度的是
纯度的是A.充分加热,固体减重
B.与足量稀盐酸充分反应,加热蒸干,得
 固体
固体C.与足量稀硫酸充分反应并加热,逸出气体用碱石灰吸收,增重
您最近半年使用:0次
名校
解题方法
2 . 过渡金属氧化物离子(以MO+表示)在烃类的选择性氧化等方面应用广泛。MO+与CH4反应的过程如下图所示。不正确 的是
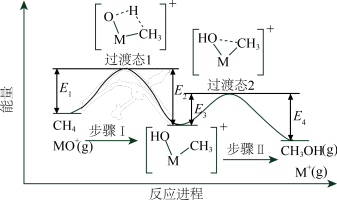
| A.反应速率:步骤I<步骤II |
| B.CH3OH分子中,键角:H—C—H>H—O—C |
| C.若MO+与CH3D反应,生成的氘代甲醇有2种 |
D.CH4(g) + MO+(g)=CH3OH(g) + M+(g)  = E2+E4-E1-E3 = E2+E4-E1-E3 |
您最近半年使用:0次
2024-04-01更新
|
464次组卷
|
5卷引用:北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题
北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)江苏省常州市第一中学2023-2024学年高二下学期4月期中考试化学试题(已下线)化学(天津卷03)-2024年高考化学押题预测卷(已下线)提升练03 反应历程探究与催化原理-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
3 .  和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
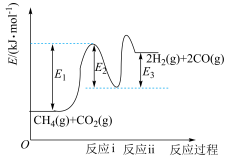
(1)干重整主反应的热化学方程式为_____ (用 、
、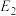 、
、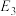 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定_____ (填“ⅰ”或“ⅱ”)。
(2)反应器中还同时存在副反应: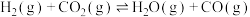
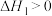
①下图表示投料比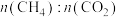 为
为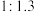 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是_____ 。(填字母)
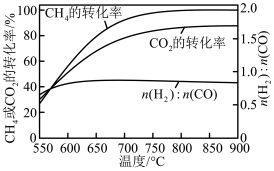
A.加压有利于增大 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率
B.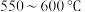 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡
C.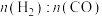 始终低于
始终低于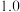 ,与副反应有关
,与副反应有关
②体系中会发生积炭反应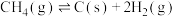
 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应_____ 的 。
。
③添加一定量的载氧剂 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大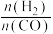 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式_____ 。
(3)文献中指出 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由_____ 。
 和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
(1)干重整主反应的热化学方程式为
 、
、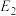 、
、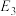 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定(2)反应器中还同时存在副反应:
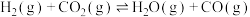
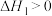
①下图表示投料比
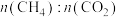 为
为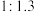 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是
A.加压有利于增大
 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率B.
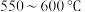 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡C.
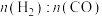 始终低于
始终低于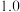 ,与副反应有关
,与副反应有关②体系中会发生积炭反应
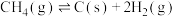
 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应 。
。③添加一定量的载氧剂
 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大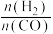 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式(3)文献中指出
 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由| 化学键 | 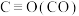 |  |  |  |
键能 | 1072 | 436 | 413 | 464 |
您最近半年使用:0次
解题方法
4 . 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。下图是1mol NO2(g)和 1mol CO(g)反应生成 1mol CO2(g)和 1mol NO(g)过程中能量变化示意图。
(1)请写出反应的热化学方程式___________ 。
(2)若在该反应体系中加入催化剂对反应热___________ (填“有”或“没有”)影响。原因是 ___________ 。

(1)请写出反应的热化学方程式
(2)若在该反应体系中加入催化剂对反应热
您最近半年使用:0次
5 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I.甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为___________ 。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) = CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol,相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是___________ 。
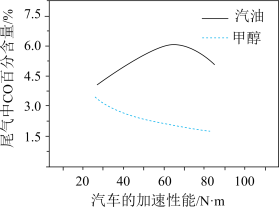
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如下图所示。根据下图信息分析,与汽油相比,甲醇作为燃料的优点是___________ 。
II.甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
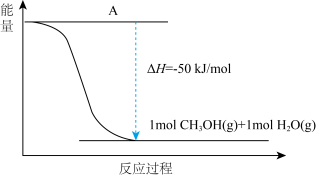
①补全上图:图中A处应填入___________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH___________ 。(填“变大”“变小”或“不变”)
(5)为了合成甲醇反应:CO(g) + 2H2(g) = CH3OH(g) ΔH =-91kJ/mol
已知:i.CO(g)+1/2 O2(g) = CO2(g) Δ H1=-283 kJ/mol
ii. ∙∙∙∙∙∙ ΔH2
iii.CH3OH(g) + 3/2 O2(g) = CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
还需要利用反应ii,请写出该反应的热化学反应方程式_______________________ 。
(6)用稀硫酸作电解质溶液,电解CO2也可制取CH3OH,装置如下图所示,电极b为电解池的___________ 极(填“阴”或“阳”),生成 的电极反应式是
的电极反应式是___________ 。

I.甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) = CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol,相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如下图所示。根据下图信息分析,与汽油相比,甲醇作为燃料的优点是

II.甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

①补全上图:图中A处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH
(5)为了合成甲醇反应:CO(g) + 2H2(g) = CH3OH(g) ΔH =-91kJ/mol
已知:i.CO(g)+1/2 O2(g) = CO2(g) Δ H1=-283 kJ/mol
ii. ∙∙∙∙∙∙ ΔH2
iii.CH3OH(g) + 3/2 O2(g) = CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
还需要利用反应ii,请写出该反应的热化学反应方程式
(6)用稀硫酸作电解质溶液,电解CO2也可制取CH3OH,装置如下图所示,电极b为电解池的
 的电极反应式是
的电极反应式是
您最近半年使用:0次
解题方法
6 . 研究CO2的回收和综合利用对航天建设有重要意义。
Ⅰ.载人航天器中,利用萨巴蒂尔反应可将航天员呼出的CO2转化为 H2O,再通过电解H2O 获得 O2,实现O2的再生,同时还能制备CH4。已知:
反应①:CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H = −252.9kJ/mol
反应②:2H2O(l)=2H2(g)+O2(g) ∆H = +571.6kJ/mol
请回答下列问题:
(1)反应①属于___________ (填“吸热”或“放热”)反应。
(2)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
已知2CH4(g)=C2H4(g)+2H2(g) ΔH =+167kJ/mol,则a=___________ 。
Ⅱ.回收利用CO2是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,科研人员研究出其物质转化途径如下图:
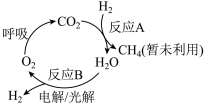
(3)反应A为CO2(g)+4H2(g) CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
已知:2H2(g) + O2(g) = 2H2O(g) ΔH = −483.6 kJ·mol−1
CH4(g) + 2O2(g) = 2H2O(g) + CO2(g) ΔH = −802.3 kJ·mol−1
反应A的ΔH =___________ kJ·mol−1
(4)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
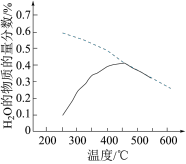
①理论上,能提高CO2平衡转化率的措施有___________ (写出一条即可)。
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是___________ 。
(5)下列关于空间站内物质和能量变化的说法中,不正确 的是___________ (填字母)。
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
(6)用CO2(g)+2H2(g) C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是___________ 。
Ⅰ.载人航天器中,利用萨巴蒂尔反应可将航天员呼出的CO2转化为 H2O,再通过电解H2O 获得 O2,实现O2的再生,同时还能制备CH4。已知:
反应①:CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H = −252.9kJ/mol
反应②:2H2O(l)=2H2(g)+O2(g) ∆H = +571.6kJ/mol
请回答下列问题:
(1)反应①属于
(2)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |
Ⅱ.回收利用CO2是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,科研人员研究出其物质转化途径如下图:

(3)反应A为CO2(g)+4H2(g)
 CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。已知:2H2(g) + O2(g) = 2H2O(g) ΔH = −483.6 kJ·mol−1
CH4(g) + 2O2(g) = 2H2O(g) + CO2(g) ΔH = −802.3 kJ·mol−1
反应A的ΔH =
(4)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。

①理论上,能提高CO2平衡转化率的措施有
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是
(5)下列关于空间站内物质和能量变化的说法中,
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
(6)用CO2(g)+2H2(g)
 C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
您最近半年使用:0次
解题方法
7 . 工业上可以利用水煤气( 、
、 )合成二甲醚(
)合成二甲醚( ),同时生成
),同时生成 。合成过程中,主要发生三个反应,
。合成过程中,主要发生三个反应, ℃时,有关反应及相关数据如下。
℃时,有关反应及相关数据如下。

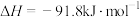
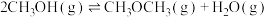
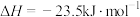


保持原料气组成、压强、反应时间等因素不变,进行实验,测得 转化率随温度变化曲线如下图。下列说法不正确的是
转化率随温度变化曲线如下图。下列说法不正确的是
 、
、 )合成二甲醚(
)合成二甲醚( ),同时生成
),同时生成 。合成过程中,主要发生三个反应,
。合成过程中,主要发生三个反应, ℃时,有关反应及相关数据如下。
℃时,有关反应及相关数据如下。
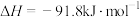
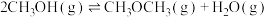
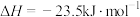


保持原料气组成、压强、反应时间等因素不变,进行实验,测得
 转化率随温度变化曲线如下图。下列说法不正确的是
转化率随温度变化曲线如下图。下列说法不正确的是
A. ℃时,水煤气合成二甲醚的热化学方程式: ℃时,水煤气合成二甲醚的热化学方程式:  |
B. ℃时,增大压强、加入催化剂均可提高 ℃时,增大压强、加入催化剂均可提高 的平衡转化率 的平衡转化率 |
C.220℃~240℃时,温度升高反应速率加快, 转化率升高 转化率升高 |
D.温度高于240℃时,温度升高 转化率降低的原因可能是平衡逆向移动 转化率降低的原因可能是平衡逆向移动 |
您最近半年使用:0次
名校
解题方法
8 . 将天然气(主要成分为 )中的
)中的 、
、 资源化转化在能源利用。环境保护等方面意义重大。
资源化转化在能源利用。环境保护等方面意义重大。
(1) 转化为CO、
转化为CO、 转化为S的反应如下:
转化为S的反应如下:
i.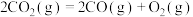
 kJ/mol
kJ/mol
ii.
 kJ/mol
kJ/mol
iii. 、
、 转化生成CO、S等物质的热化学方程是
转化生成CO、S等物质的热化学方程是___________ 。
(2) 性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的
性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的___________ ,提高反应速率。
a.活化能 b. c.平衡常数
c.平衡常数
(3)我国科学家通过研制新型催化剂,设计协同转化装置实现反应,工作原理如图所示。
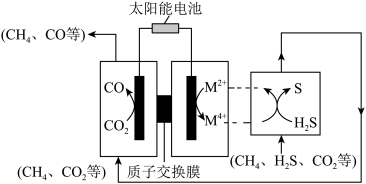
【方案1】若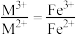
①结合化学用语说明生成S、CO的原理:___________ 。
【方案2】若
电流效率 的定义
的定义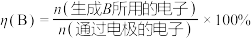
②测得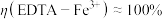 ,
,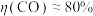 ,阴极放电的物质有
,阴极放电的物质有___________ ;
③为进一步确认 、
、 能协同转化,对CO的来源分析如下:
能协同转化,对CO的来源分析如下:
来源1: 通过电极反应产生CO;
通过电极反应产生CO;
来源2:电解质(含碳元素)等碳基材料发生降解,产生CO。
设计实验探究,证实来源2不成立。实验方案是___________ 。
结论:方案2明显优于方案1。该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
 )中的
)中的 、
、 资源化转化在能源利用。环境保护等方面意义重大。
资源化转化在能源利用。环境保护等方面意义重大。(1)
 转化为CO、
转化为CO、 转化为S的反应如下:
转化为S的反应如下:i.
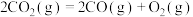
 kJ/mol
kJ/molii.

 kJ/mol
kJ/moliii.
 、
、 转化生成CO、S等物质的热化学方程是
转化生成CO、S等物质的热化学方程是(2)
 性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的
性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的a.活化能 b.
 c.平衡常数
c.平衡常数(3)我国科学家通过研制新型催化剂,设计协同转化装置实现反应,工作原理如图所示。

【方案1】若
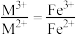
①结合化学用语说明生成S、CO的原理:
【方案2】若

电流效率
 的定义
的定义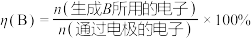
②测得
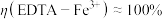 ,
,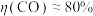 ,阴极放电的物质有
,阴极放电的物质有③为进一步确认
 、
、 能协同转化,对CO的来源分析如下:
能协同转化,对CO的来源分析如下:来源1:
 通过电极反应产生CO;
通过电极反应产生CO;来源2:电解质(含碳元素)等碳基材料发生降解,产生CO。
设计实验探究,证实来源2不成立。实验方案是
结论:方案2明显优于方案1。该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
您最近半年使用:0次
名校
9 . 下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
①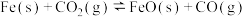  |  | 1.47 | 2.15 |
②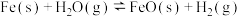  |  | 2.38 | 1.67 |
③  |  | a | b |
A.1173K时,反应①起始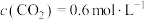 ,平衡时 ,平衡时 约为0.4 约为0.4 |
B.反应②是吸热反应, |
| C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动 |
D.相同温度下, ; ;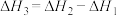 |
您最近半年使用:0次
2023-03-24更新
|
704次组卷
|
7卷引用:北京市丰台区2022-2023学年高三下学期第一次模拟练习化学试题
北京市丰台区2022-2023学年高三下学期第一次模拟练习化学试题(已下线)专题15 化学反应速率和化学平衡海南省海南中学2023届高三下学期第三次模拟考试化学试题湖北省黄冈市重点校2022-2023学年高一下学期期末综合选拔性联考化学试题北京市第一六一中学2023-2024学年高三上学期12月月考化学试题(已下线)题型13 化学平衡常数的计算及应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)北京市顺义区第二中学2023-2024学年高三下学期3月月考化学试题
10 . 氢能是一种清洁能源,按照生产过程中的碳排放情况分为灰氢、蓝氢和绿氢。
(1)煤的气化制得灰氢 :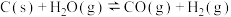 。该反应的平衡常数表达式K=
。该反应的平衡常数表达式K=_______ 。该方法生产过程有CO2排放。
(2)甲烷水蒸气催化重整制得蓝氢 ,步骤如下。
ⅰ.H2的制取: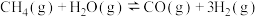
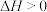 。为提高CH4的平衡转化率,可采取的措施有
。为提高CH4的平衡转化率,可采取的措施有_______ (写出两条即可)。
ⅱ.H2的富集:
 。已知830℃时,该反应的平衡常数K=1,向体积为1 L的恒容密闭容器中充入3 mol CO和3 mol H2O(g),某时刻测得H2为1 mol,此时反应
。已知830℃时,该反应的平衡常数K=1,向体积为1 L的恒容密闭容器中充入3 mol CO和3 mol H2O(g),某时刻测得H2为1 mol,此时反应_______ (填“已达到”或“未达到”)化学平衡状态,理由是_______ ,反应达平衡时CO的转化率为_______ 。
(3)热化学硫碘循环分解水制得绿氢 ,全程零碳排放。反应如下:
反应ⅰ: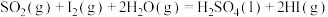
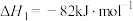
反应ⅱ: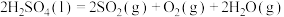
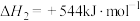
反应ⅲ:……
反应ⅰ~ⅲ循环可实现分解水:
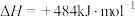
①已知破坏1 mol H2和破坏1 mol O2中化学键所消耗能量分别是436 kJ和498 kJ,则H2O中H-O键比H2中H-H键_______ (填“强”或“弱”)。
②写出反应ⅲ的热化学方程式_______ 。
(1)煤的气化制得
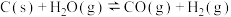 。该反应的平衡常数表达式K=
。该反应的平衡常数表达式K=(2)甲烷水蒸气催化重整制得
ⅰ.H2的制取:
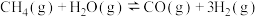
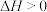 。为提高CH4的平衡转化率,可采取的措施有
。为提高CH4的平衡转化率,可采取的措施有ⅱ.H2的富集:

 。已知830℃时,该反应的平衡常数K=1,向体积为1 L的恒容密闭容器中充入3 mol CO和3 mol H2O(g),某时刻测得H2为1 mol,此时反应
。已知830℃时,该反应的平衡常数K=1,向体积为1 L的恒容密闭容器中充入3 mol CO和3 mol H2O(g),某时刻测得H2为1 mol,此时反应(3)热化学硫碘循环分解水制得
反应ⅰ:
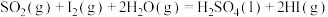
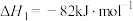
反应ⅱ:
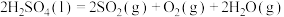
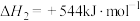
反应ⅲ:……
反应ⅰ~ⅲ循环可实现分解水:

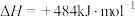
①已知破坏1 mol H2和破坏1 mol O2中化学键所消耗能量分别是436 kJ和498 kJ,则H2O中H-O键比H2中H-H键
②写出反应ⅲ的热化学方程式
您最近半年使用:0次
2023-01-14更新
|
141次组卷
|
2卷引用:北京市丰台区2022-2023学年高二上学期期中考试化学(A卷)试题



