1 .  和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
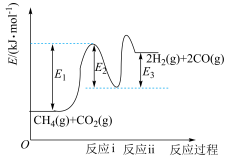
(1)干重整主反应的热化学方程式为_____ (用 、
、 、
、 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定_____ (填“ⅰ”或“ⅱ”)。
(2)反应器中还同时存在副反应: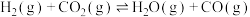
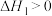
①下图表示投料比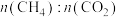 为
为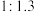 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是_____ 。(填字母)
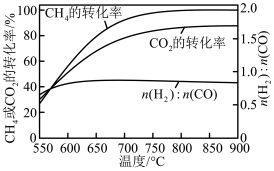
A.加压有利于增大 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率
B.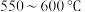 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡
C.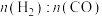 始终低于
始终低于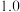 ,与副反应有关
,与副反应有关
②体系中会发生积炭反应
 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应_____ 的 。
。
③添加一定量的载氧剂 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式_____ 。
(3)文献中指出 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由_____ 。
 和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
(1)干重整主反应的热化学方程式为
 、
、 、
、 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定(2)反应器中还同时存在副反应:
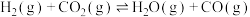
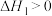
①下图表示投料比
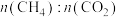 为
为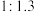 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是
A.加压有利于增大
 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率B.
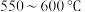 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡C.
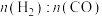 始终低于
始终低于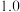 ,与副反应有关
,与副反应有关②体系中会发生积炭反应

 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应 。
。③添加一定量的载氧剂
 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式(3)文献中指出
 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由| 化学键 | 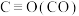 |  |  |  |
键能 | 1072 | 436 | 413 | 464 |
您最近一年使用:0次
2 .  资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:
反应I:

反应II: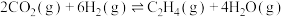

(1)基态镍原子核外电子的轨道表示式为____________
(2)将反应后气体通入______ (填试剂名称),可证明反应II发生。
(3)计算

______ (用 和
和 表示)
表示)
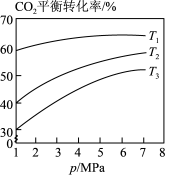
(4)相同投料比时,体系内 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为________ 。
(5)向1 L恒压、密闭容器中通入1 mol 和4 mol
和4 mol  ,测得有关物质的物质的量随温度变化如图。
,测得有关物质的物质的量随温度变化如图。
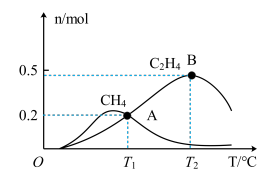
①催化剂在较低温度时主要选择______ (填“反应I”或“反应II”)
② 时
时 的转化率为
的转化率为______ ,反应I的平衡常数
______ 。
(6)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:
 +75 kJ/mol
+75 kJ/mol
消碳反应:
 -173 kJ/mol
-173 kJ/mol
其他条件相同时,催化剂表面积碳量与温度的关系如图所示, ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是______ 。

 资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:反应I:


反应II:
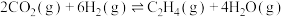

(1)基态镍原子核外电子的轨道表示式为
(2)将反应后气体通入
(3)计算


 和
和 表示)
表示)(4)相同投料比时,体系内
 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
(5)向1 L恒压、密闭容器中通入1 mol
 和4 mol
和4 mol  ,测得有关物质的物质的量随温度变化如图。
,测得有关物质的物质的量随温度变化如图。
①催化剂在较低温度时主要选择
②
 时
时 的转化率为
的转化率为
(6)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:

 +75 kJ/mol
+75 kJ/mol消碳反应:

 -173 kJ/mol
-173 kJ/mol其他条件相同时,催化剂表面积碳量与温度的关系如图所示,
 ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是
您最近一年使用:0次
名校
解题方法
3 . 利用工业废气中的 合成基础化工原料甲醇
合成基础化工原料甲醇 ,是
,是 资源化的重要方法,涉及的主要化学反应有:
资源化的重要方法,涉及的主要化学反应有:
反应ⅰ: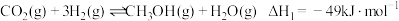
反应ⅱ: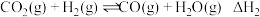
(1)反应ⅱ的化学平衡常数表达式为_______ 。
(2)已知: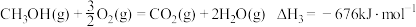 。利用
。利用 和
和 计算
计算 时,还需要利用
时,还需要利用_______ 反应的 。通过计算得出
。通过计算得出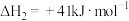 。
。
(3)控制反应条件(均使用了催化剂),研究投料比(反应物的物质的量之比)、压强、温度对反应体系的影响。
产率 和选择性S的定义:
和选择性S的定义: ,
,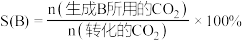
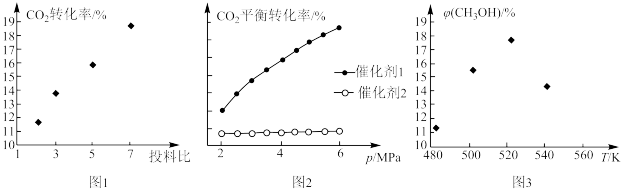
①图1中,投料比是指_______ (填“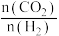 ”或“
”或“ ”);当投料比为5时,
”);当投料比为5时, 的转化率约为16%,
的转化率约为16%,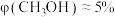 ,则
,则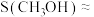
_______ 。
②图2中,在催化剂2的作用下,发生的主要反应是_______ (填“ⅰ”或“ⅱ”)。
③图3中,当温度高于 时,甲醇的产率随温度升高而减小,原因可能有
时,甲醇的产率随温度升高而减小,原因可能有_______ (写出2条)。
(4)一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入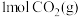 和
和 ,发生上述反应,t秒后达到平衡。此时容器中
,发生上述反应,t秒后达到平衡。此时容器中 为
为 ,
, 为
为 。
。
①平衡后 的浓度为
的浓度为_______  (用含a、b、V的代数式表示,下同)。
(用含a、b、V的代数式表示,下同)。
②用 的浓度变化表示
的浓度变化表示 秒内反应ⅱ的反应速率,
秒内反应ⅱ的反应速率,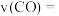
_______  。
。
③该条件下反应ⅰ的化学平衡常数为_______ 。
 合成基础化工原料甲醇
合成基础化工原料甲醇 ,是
,是 资源化的重要方法,涉及的主要化学反应有:
资源化的重要方法,涉及的主要化学反应有:反应ⅰ:
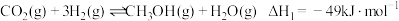
反应ⅱ:
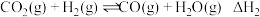
(1)反应ⅱ的化学平衡常数表达式为
(2)已知:
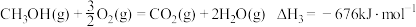 。利用
。利用 和
和 计算
计算 时,还需要利用
时,还需要利用 。通过计算得出
。通过计算得出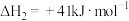 。
。(3)控制反应条件(均使用了催化剂),研究投料比(反应物的物质的量之比)、压强、温度对反应体系的影响。
产率
 和选择性S的定义:
和选择性S的定义: ,
,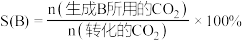

①图1中,投料比是指
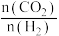 ”或“
”或“ ”);当投料比为5时,
”);当投料比为5时, 的转化率约为16%,
的转化率约为16%,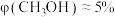 ,则
,则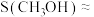
②图2中,在催化剂2的作用下,发生的主要反应是
③图3中,当温度高于
 时,甲醇的产率随温度升高而减小,原因可能有
时,甲醇的产率随温度升高而减小,原因可能有(4)一定条件下,向体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入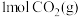 和
和 ,发生上述反应,t秒后达到平衡。此时容器中
,发生上述反应,t秒后达到平衡。此时容器中 为
为 ,
, 为
为 。
。①平衡后
 的浓度为
的浓度为 (用含a、b、V的代数式表示,下同)。
(用含a、b、V的代数式表示,下同)。②用
 的浓度变化表示
的浓度变化表示 秒内反应ⅱ的反应速率,
秒内反应ⅱ的反应速率,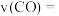
 。
。③该条件下反应ⅰ的化学平衡常数为
您最近一年使用:0次
2023-01-06更新
|
195次组卷
|
3卷引用:北京市丰台区2022-2023学年高二上学期期末考试化学试题
名校
解题方法
4 . 富钴结壳浸出液分离 制备
制备 的工业流程如下。
的工业流程如下。
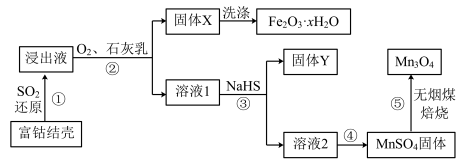
已知:i.浸出液中主要含有的金属离子为: 、
、 、
、 、
、 、
、
ii.25℃时,金属硫化物的溶度积常数。
(1)过程①中, 还原得到的浸出液中含硫元素的阴离子主要为
还原得到的浸出液中含硫元素的阴离子主要为_______ 。
(2)过程②中, 转化为
转化为 时,氧气和石灰乳的作用分别是
时,氧气和石灰乳的作用分别是_______ 。
(3)固体Y中主要物质的化学式为_______ 。
(4)已知, 在
在 时完全沉淀转化为
时完全沉淀转化为 。过程③中沉淀剂不选择
。过程③中沉淀剂不选择 的原因可能是
的原因可能是_______ 。
(5)已知,温度高于20℃时, 在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是
在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是_______ 。
(6)过程⑤中发生下列反应。



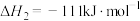
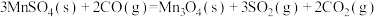

利用 和
和 计算
计算 时,还需要利用
时,还需要利用_______ 反应的 。
。
(7)流程中可循环使用的物质是_______ 。
 制备
制备 的工业流程如下。
的工业流程如下。
已知:i.浸出液中主要含有的金属离子为:
 、
、 、
、 、
、 、
、
ii.25℃时,金属硫化物的溶度积常数。
| 金属硫化物 | NiS | CoS | CuS | MnS |
 | 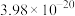 | 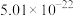 | 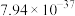 | 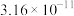 |
 还原得到的浸出液中含硫元素的阴离子主要为
还原得到的浸出液中含硫元素的阴离子主要为(2)过程②中,
 转化为
转化为 时,氧气和石灰乳的作用分别是
时,氧气和石灰乳的作用分别是(3)固体Y中主要物质的化学式为
(4)已知,
 在
在 时完全沉淀转化为
时完全沉淀转化为 。过程③中沉淀剂不选择
。过程③中沉淀剂不选择 的原因可能是
的原因可能是(5)已知,温度高于20℃时,
 在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是
在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是(6)过程⑤中发生下列反应。



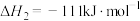
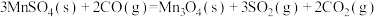

利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。(7)流程中可循环使用的物质是
您最近一年使用:0次
2023-01-05更新
|
317次组卷
|
2卷引用:北京市丰台区2022-2023学年高三上学期期末考试化学试题
名校
解题方法
5 . 工业上制硫酸的主要反应之一为: ,反应过程中能量的变化如图所示。
,反应过程中能量的变化如图所示。
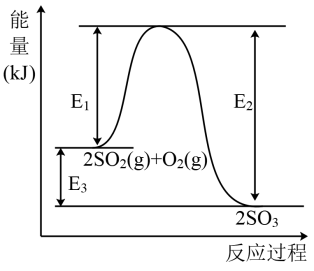
(1)向反应体系中加入催化剂后,图中
_______ (填“增大”、“减小”或“不变”,下同),
_______ 。
(2)已知:
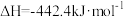

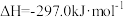
若 与
与 反应产生
反应产生 和
和 ,则反应的热化学方程式为
,则反应的热化学方程式为_______ 。
(3)某温度下,反应的起始浓度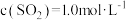 ,
,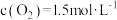 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为_______ 。
(4)在 温度时,该反应的平衡常数
温度时,该反应的平衡常数 ,若在此温度下,向
,若在此温度下,向 的恒容密闭容器中,充入
的恒容密闭容器中,充入 、
、 和
和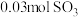 ,则反应开始时正反应速率
,则反应开始时正反应速率_______ (填“>”、“=”或“<”)逆反应速率。
(5)恒温恒容条件下,下列叙述能证明该反应已达化学平衡状态的是_______。(填字母)
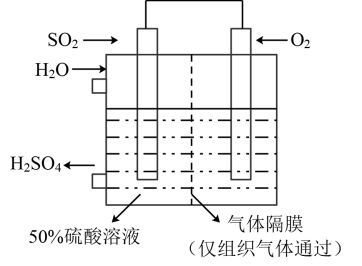
(6)若以如图所示装置生产硫酸,将 、
、 以一定压强喷到活性电极上反应。负极的电极反应式为
以一定压强喷到活性电极上反应。负极的电极反应式为_______ 。
 ,反应过程中能量的变化如图所示。
,反应过程中能量的变化如图所示。
(1)向反应体系中加入催化剂后,图中


(2)已知:

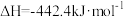

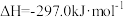
若
 与
与 反应产生
反应产生 和
和 ,则反应的热化学方程式为
,则反应的热化学方程式为(3)某温度下,反应的起始浓度
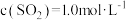 ,
,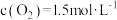 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为(4)在
 温度时,该反应的平衡常数
温度时,该反应的平衡常数 ,若在此温度下,向
,若在此温度下,向 的恒容密闭容器中,充入
的恒容密闭容器中,充入 、
、 和
和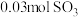 ,则反应开始时正反应速率
,则反应开始时正反应速率(5)恒温恒容条件下,下列叙述能证明该反应已达化学平衡状态的是_______。(填字母)
A. 的体积分数不再发生变化 的体积分数不再发生变化 |
| B.恒容时,容器内压强不再发生变化 |
| C.容器内,气体原子总数不再发生变化 |
D.相同时间内消耗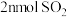 的同时生成 的同时生成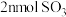 |
 、
、 以一定压强喷到活性电极上反应。负极的电极反应式为
以一定压强喷到活性电极上反应。负极的电极反应式为
您最近一年使用:0次
2022-01-21更新
|
283次组卷
|
2卷引用:北京市丰台区2021~2022学年高二上学期期末考试化学试题
名校
6 . 某天然气含CH4和一定量的CO2。以天然气为原料制备苯和氢气的工艺流程如下图所示:_______ 。
(2)由甲烷制备苯的过程中存在如下反应:
芳构化反应:6CH4(g) C6H6(g)+9H2(g) ΔH1
C6H6(g)+9H2(g) ΔH1
积碳反应:CH4(g) C(s)+2H2(g) ΔH2
C(s)+2H2(g) ΔH2
若要用ΔH1计算ΔH2,则还需要利用_______ 反应的ΔH。
(3)已知不同温度和压强下,甲烷芳构化反应中甲烷的平衡转化率如图所示:_______ 0(填“>”或“<”)
②P1、P2的大小关系是_______ ,理由是_______ 。
(4)在适宜温度下,以金属Mo作催化剂,由甲烷制备苯,几个小时后,单位时间内苯的产量迅速下降,主要原因是_______ 。

(2)由甲烷制备苯的过程中存在如下反应:
芳构化反应:6CH4(g)
 C6H6(g)+9H2(g) ΔH1
C6H6(g)+9H2(g) ΔH1积碳反应:CH4(g)
 C(s)+2H2(g) ΔH2
C(s)+2H2(g) ΔH2若要用ΔH1计算ΔH2,则还需要利用
(3)已知不同温度和压强下,甲烷芳构化反应中甲烷的平衡转化率如图所示:

②P1、P2的大小关系是
(4)在适宜温度下,以金属Mo作催化剂,由甲烷制备苯,几个小时后,单位时间内苯的产量迅速下降,主要原因是
您最近一年使用:0次
2022-01-14更新
|
369次组卷
|
5卷引用:北京市丰台区2021-2022学年高三上学期期末考试化学试题
北京市丰台区2021-2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题山东省临沂市沂水县2022-2023学年高二上学期学科素养(期中)检测化学试题北京市第五十五中学2023-2024学年高二下学期期中调研化学试题
7 . CO2可用于合成多种化工原料。用 CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
(1)反应A的平衡常数表达式是_________ 。
(2)已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH2
H2O(g)=H2O(l) ΔH3
ΔH1不易直接测得,为了通过ΔH2和ΔH3计算得到ΔH1,还需测定如下反应的反应热:_______ 。
(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。
①反应 A 的ΔH1________ 0(填“>”或“<”)。
②曲线 c 对应的投料是_________ 。
③T1℃时,曲线c 对应的化学平衡常数_________ 1(填“>”、“<”或“=”)。
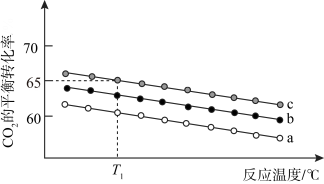
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。
由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_______ 。
(1)反应A的平衡常数表达式是
(2)已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH2
H2O(g)=H2O(l) ΔH3
ΔH1不易直接测得,为了通过ΔH2和ΔH3计算得到ΔH1,还需测定如下反应的反应热:
(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。

①反应 A 的ΔH1
②曲线 c 对应的投料是
③T1℃时,曲线c 对应的化学平衡常数
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。

由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是
您最近一年使用:0次
8 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:
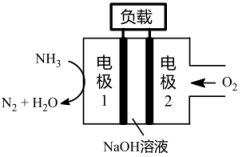
①电极1为_______ (填“正极”或“负极”),电极2的反应式为_______ 。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:i.2H2(g)+O2(g)=2H2O(g) ΔH1
ii.N2(g)+3H2(g)⇌2NH3(g) ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=_______ 。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是_______ 。
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是_______ 。。
②列举一条既能提高速率又能提高原料转化率的措施_______ 。
(3)常温常压下电解法合成氨的原理如下图所示:
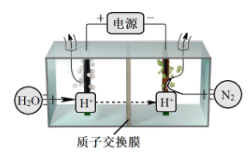
①阳极产生的气体是_______ 。
②阴极生成氨的电极反应式为_______ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式_______ 。
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有_______ 性。
(1)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:

①电极1为
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:i.2H2(g)+O2(g)=2H2O(g) ΔH1
ii.N2(g)+3H2(g)⇌2NH3(g) ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是
②列举一条既能提高速率又能提高原料转化率的措施
(3)常温常压下电解法合成氨的原理如下图所示:

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有
您最近一年使用:0次
2021-01-22更新
|
257次组卷
|
2卷引用:北京市丰台区2020-2021学年高二上学期期末考试化学试题
9 . 零价纳米铁在环境修复中具有广泛应用,可用来处理地下水中的铼酸根离子( )。
)。
资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。
(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式___ 。
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑
①氮气作用下烘干的目的是___ 。
②每生成1molFe,转移电子数为___ 。
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。
①写出反应的离子方程式___ 。
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是___ 。
③研究表明pH过高或过低会使 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是___ 。
 )。
)。资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO
 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2
 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑①氮气作用下烘干的目的是
②每生成1molFe,转移电子数为
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、
 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。①写出反应的离子方程式
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是
③研究表明pH过高或过低会使
 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是
您最近一年使用:0次
2021-01-22更新
|
331次组卷
|
2卷引用:北京市丰台区2021届高三上学期期末考试化学试题
名校
10 . 氧化亚铜是一种重要的工业原料。已知1 g C(s)燃烧生成一氧化碳放出9.2 kJ的热量,氧化亚铜与氧气反应的能量变化如图所示。下列有关判断正确的是


| A.碳[C(s)]的燃烧热△H = -110.4 kJ·mol-1 |
| B.氧化亚铜与氧气的反应为吸热反应 |
| C.氧化亚铜与氧气反应的活化能为292 kJ·mol-1 |
| D.C(s)+2CuO(s)=Cu2O(s)+CO(g) △H= +35.6 kJ·mol-1 |
您最近一年使用:0次
2020-11-06更新
|
333次组卷
|
5卷引用:北京市第八十中学2022-2023学年高二上学期期末适应测试化学试题



