1 .  和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
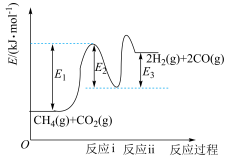
(1)干重整主反应的热化学方程式为_____ (用 、
、 、
、 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定_____ (填“ⅰ”或“ⅱ”)。
(2)反应器中还同时存在副反应: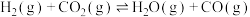
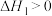
①下图表示投料比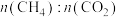 为
为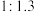 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是_____ 。(填字母)
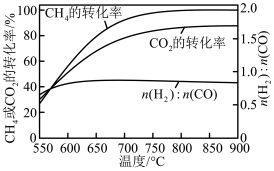
A.加压有利于增大 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率
B.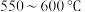 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡
C.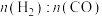 始终低于
始终低于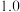 ,与副反应有关
,与副反应有关
②体系中会发生积炭反应
 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应_____ 的 。
。
③添加一定量的载氧剂 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式_____ 。
(3)文献中指出 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由_____ 。
 和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
(1)干重整主反应的热化学方程式为
 、
、 、
、 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定(2)反应器中还同时存在副反应:
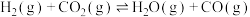
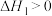
①下图表示投料比
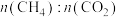 为
为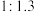 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是
A.加压有利于增大
 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率B.
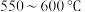 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡C.
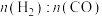 始终低于
始终低于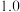 ,与副反应有关
,与副反应有关②体系中会发生积炭反应

 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应 。
。③添加一定量的载氧剂
 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式(3)文献中指出
 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由| 化学键 | 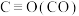 |  |  |  |
键能 | 1072 | 436 | 413 | 464 |
您最近一年使用:0次
名校
解题方法
2 . 将天然气(主要成分为 )中的
)中的 、
、 资源化转化在能源利用。环境保护等方面意义重大。
资源化转化在能源利用。环境保护等方面意义重大。
(1) 转化为CO、
转化为CO、 转化为S的反应如下:
转化为S的反应如下:
i.
 kJ/mol
kJ/mol
ii.
 kJ/mol
kJ/mol
iii. 、
、 转化生成CO、S等物质的热化学方程是
转化生成CO、S等物质的热化学方程是___________ 。
(2) 性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的
性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的___________ ,提高反应速率。
a.活化能 b. c.平衡常数
c.平衡常数
(3)我国科学家通过研制新型催化剂,设计协同转化装置实现反应,工作原理如图所示。
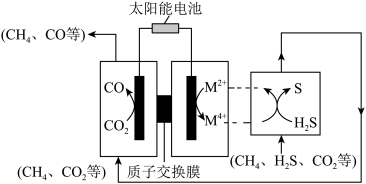
【方案1】若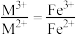
①结合化学用语说明生成S、CO的原理:___________ 。
【方案2】若
电流效率 的定义
的定义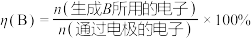
②测得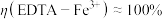 ,
,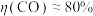 ,阴极放电的物质有
,阴极放电的物质有___________ ;
③为进一步确认 、
、 能协同转化,对CO的来源分析如下:
能协同转化,对CO的来源分析如下:
来源1: 通过电极反应产生CO;
通过电极反应产生CO;
来源2:电解质(含碳元素)等碳基材料发生降解,产生CO。
设计实验探究,证实来源2不成立。实验方案是___________ 。
结论:方案2明显优于方案1。该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
 )中的
)中的 、
、 资源化转化在能源利用。环境保护等方面意义重大。
资源化转化在能源利用。环境保护等方面意义重大。(1)
 转化为CO、
转化为CO、 转化为S的反应如下:
转化为S的反应如下:i.

 kJ/mol
kJ/molii.

 kJ/mol
kJ/moliii.
 、
、 转化生成CO、S等物质的热化学方程是
转化生成CO、S等物质的热化学方程是(2)
 性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的
性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的a.活化能 b.
 c.平衡常数
c.平衡常数(3)我国科学家通过研制新型催化剂,设计协同转化装置实现反应,工作原理如图所示。

【方案1】若
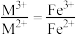
①结合化学用语说明生成S、CO的原理:
【方案2】若

电流效率
 的定义
的定义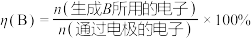
②测得
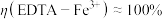 ,
,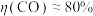 ,阴极放电的物质有
,阴极放电的物质有③为进一步确认
 、
、 能协同转化,对CO的来源分析如下:
能协同转化,对CO的来源分析如下:来源1:
 通过电极反应产生CO;
通过电极反应产生CO;来源2:电解质(含碳元素)等碳基材料发生降解,产生CO。
设计实验探究,证实来源2不成立。实验方案是
结论:方案2明显优于方案1。该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
您最近一年使用:0次
名校
解题方法
3 . 富钴结壳浸出液分离 制备
制备 的工业流程如下。
的工业流程如下。
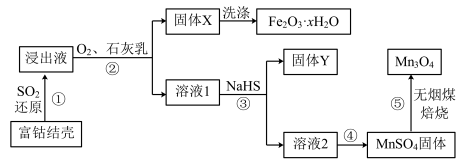
已知:i.浸出液中主要含有的金属离子为: 、
、 、
、 、
、 、
、
ii.25℃时,金属硫化物的溶度积常数。
(1)过程①中, 还原得到的浸出液中含硫元素的阴离子主要为
还原得到的浸出液中含硫元素的阴离子主要为_______ 。
(2)过程②中, 转化为
转化为 时,氧气和石灰乳的作用分别是
时,氧气和石灰乳的作用分别是_______ 。
(3)固体Y中主要物质的化学式为_______ 。
(4)已知, 在
在 时完全沉淀转化为
时完全沉淀转化为 。过程③中沉淀剂不选择
。过程③中沉淀剂不选择 的原因可能是
的原因可能是_______ 。
(5)已知,温度高于20℃时, 在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是
在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是_______ 。
(6)过程⑤中发生下列反应。



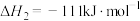
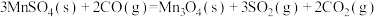

利用 和
和 计算
计算 时,还需要利用
时,还需要利用_______ 反应的 。
。
(7)流程中可循环使用的物质是_______ 。
 制备
制备 的工业流程如下。
的工业流程如下。
已知:i.浸出液中主要含有的金属离子为:
 、
、 、
、 、
、 、
、
ii.25℃时,金属硫化物的溶度积常数。
| 金属硫化物 | NiS | CoS | CuS | MnS |
 | 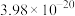 | 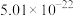 | 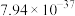 | 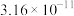 |
 还原得到的浸出液中含硫元素的阴离子主要为
还原得到的浸出液中含硫元素的阴离子主要为(2)过程②中,
 转化为
转化为 时,氧气和石灰乳的作用分别是
时,氧气和石灰乳的作用分别是(3)固体Y中主要物质的化学式为
(4)已知,
 在
在 时完全沉淀转化为
时完全沉淀转化为 。过程③中沉淀剂不选择
。过程③中沉淀剂不选择 的原因可能是
的原因可能是(5)已知,温度高于20℃时,
 在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是
在水中的溶解度随温度升高迅速降低。过程④中,采用的操作是(6)过程⑤中发生下列反应。



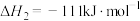
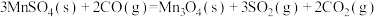

利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。(7)流程中可循环使用的物质是
您最近一年使用:0次
2023-01-05更新
|
317次组卷
|
2卷引用:北京市丰台区2022-2023学年高三上学期期末考试化学试题
名校
4 . 某天然气含CH4和一定量的CO2。以天然气为原料制备苯和氢气的工艺流程如下图所示:_______ 。
(2)由甲烷制备苯的过程中存在如下反应:
芳构化反应:6CH4(g) C6H6(g)+9H2(g) ΔH1
C6H6(g)+9H2(g) ΔH1
积碳反应:CH4(g) C(s)+2H2(g) ΔH2
C(s)+2H2(g) ΔH2
若要用ΔH1计算ΔH2,则还需要利用_______ 反应的ΔH。
(3)已知不同温度和压强下,甲烷芳构化反应中甲烷的平衡转化率如图所示:_______ 0(填“>”或“<”)
②P1、P2的大小关系是_______ ,理由是_______ 。
(4)在适宜温度下,以金属Mo作催化剂,由甲烷制备苯,几个小时后,单位时间内苯的产量迅速下降,主要原因是_______ 。

(2)由甲烷制备苯的过程中存在如下反应:
芳构化反应:6CH4(g)
 C6H6(g)+9H2(g) ΔH1
C6H6(g)+9H2(g) ΔH1积碳反应:CH4(g)
 C(s)+2H2(g) ΔH2
C(s)+2H2(g) ΔH2若要用ΔH1计算ΔH2,则还需要利用
(3)已知不同温度和压强下,甲烷芳构化反应中甲烷的平衡转化率如图所示:

②P1、P2的大小关系是
(4)在适宜温度下,以金属Mo作催化剂,由甲烷制备苯,几个小时后,单位时间内苯的产量迅速下降,主要原因是
您最近一年使用:0次
2022-01-14更新
|
369次组卷
|
5卷引用:北京市丰台区2021-2022学年高三上学期期末考试化学试题
北京市丰台区2021-2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题山东省临沂市沂水县2022-2023学年高二上学期学科素养(期中)检测化学试题北京市第五十五中学2023-2024学年高二下学期期中调研化学试题
名校
解题方法
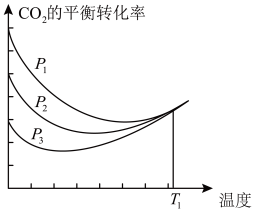
5 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
2021-04-04更新
|
1237次组卷
|
10卷引用:北京市丰台区2021届高三一模化学试题
北京市丰台区2021届高三一模化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)河北省武邑中学2021届高考七模化学试题黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题山东省烟台市龙口市2023-2024学年高二上学期10月统考化学试题云南省保山市腾冲市第八中学2020-2021学年高二下学期期中考试化学试卷
名校
解题方法
6 . 减少CO2的排放,合理利用CO2使其资源化具有重要意义。
(1)CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃,101KPa下:
H2(g)+ O2(g)=H2O(g) ΔH1=−242kJ/mol
O2(g)=H2O(g) ΔH1=−242kJ/mol
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH2=−676kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2=−676kJ/mol
①写出CO2和H2生成气态甲醇等产物的热化学方程式_____ 。
②下面表示合成甲醇反应的能量变化示意图,正确的是_____ (填字母)。
a. b.
b.  c.
c.  d.
d.
③工业上用合成得到的甲醇制成微生物燃料电池,结构示意图如图1:

该电池外电路电子的流动方向为_____ (填写“从A到B”或“从B到A”)。A电极附近甲醇发生的电极反应式为_____ 。
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图2:

①写出X的化学式_____ 。
②在阳极区发生的反应为:_____ 和H++HCO =H2O+CO2↑。
=H2O+CO2↑。
③简述K2CO3在阴极区再生的原理_____ 。
(1)CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃,101KPa下:
H2(g)+
 O2(g)=H2O(g) ΔH1=−242kJ/mol
O2(g)=H2O(g) ΔH1=−242kJ/molCH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) ΔH2=−676kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2=−676kJ/mol①写出CO2和H2生成气态甲醇等产物的热化学方程式
②下面表示合成甲醇反应的能量变化示意图,正确的是
a.
 b.
b.  c.
c.  d.
d.
③工业上用合成得到的甲醇制成微生物燃料电池,结构示意图如图1:

该电池外电路电子的流动方向为
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图2:

①写出X的化学式
②在阳极区发生的反应为:
 =H2O+CO2↑。
=H2O+CO2↑。③简述K2CO3在阴极区再生的原理
您最近一年使用:0次
2020-11-09更新
|
250次组卷
|
2卷引用:北京市丰台区 2020-2021 学年高三上学期期中考试化学试题
7 . 氮及其化合物存在如下转化关系:

(1)在氨氮废水中通入一定量的氯气,利用产生的HClO可除去废水中含有的游离氨或铵盐。
已知 NH4+ + HClO NH2Cl + H+ + H2O H = a kJmol-1
NH2Cl + H+ + H2O H = a kJmol-1
2NH2Cl + HClO N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
则 2NH4+ + 3HClO N2 + 3H2O + 5H+ + 3Cl- H =
N2 + 3H2O + 5H+ + 3Cl- H =______ kJmol-1
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
① 电解时,阳极的电极反应式为________ 。
② 电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示。

图1 Cl-浓度对氨氮去除速率、能耗的影响 图2初始pH对氨氮去除速率、能耗的影响
图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是________ ;图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是________ 。
③ 当溶液中Cl-浓度较高时,测得溶液中的NO 浓度会随之增大,可能的原因是
浓度会随之增大,可能的原因是________ 。
(3)某工厂将含NH4+废水的去除与工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分)的去除结合起来,设计了如下方案:

① 固体I的成分为________ 。
② 为使100L 150 mg/L(浓度均以氮原子计,下同)的含NH4+ 废水达到国家二级排放标准10mg/L,图中通入的氧气在标准状况下的体积至少为________ L。

(1)在氨氮废水中通入一定量的氯气,利用产生的HClO可除去废水中含有的游离氨或铵盐。
已知 NH4+ + HClO
 NH2Cl + H+ + H2O H = a kJmol-1
NH2Cl + H+ + H2O H = a kJmol-12NH2Cl + HClO
 N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
N2 + H2O + 3H+ + 3Cl- H = b kJmol-1则 2NH4+ + 3HClO
 N2 + 3H2O + 5H+ + 3Cl- H =
N2 + 3H2O + 5H+ + 3Cl- H =(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
① 电解时,阳极的电极反应式为
② 电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示。

图1 Cl-浓度对氨氮去除速率、能耗的影响 图2初始pH对氨氮去除速率、能耗的影响
图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是
③ 当溶液中Cl-浓度较高时,测得溶液中的NO
 浓度会随之增大,可能的原因是
浓度会随之增大,可能的原因是(3)某工厂将含NH4+废水的去除与工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分)的去除结合起来,设计了如下方案:

① 固体I的成分为
② 为使100L 150 mg/L(浓度均以氮原子计,下同)的含NH4+ 废水达到国家二级排放标准10mg/L,图中通入的氧气在标准状况下的体积至少为
您最近一年使用:0次
8 . 以煤为主要原料可以制备乙二醇,相关工艺流程如下:

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式_______
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是_____ 填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成分为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为____________________ 。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g) HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________ (填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备 (草酸氢钾),
(草酸氢钾), 溶液呈酸性,用化学平衡原理解释:
溶液呈酸性,用化学平衡原理解释:__________________ 。
②在一定的 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______ (填字母)。
A.
B.
C.
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_____ 填“正”或“负”)极,负极反应式为_______________ 。

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成分为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)
 HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol为提高乙二醇的产量和速率,宜采用的措施是
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O
 HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH①草酸是二元弱酸,可以制备
 (草酸氢钾),
(草酸氢钾), 溶液呈酸性,用化学平衡原理解释:
溶液呈酸性,用化学平衡原理解释:②在一定的
 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是A.

B.

C.

(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的
您最近一年使用:0次
2016-12-12更新
|
774次组卷
|
4卷引用:2015届北京市丰台区高三第一学期期末练习化学试卷



