解题方法
1 . 大气中 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。
(1) 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ: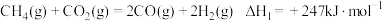
Ⅱ: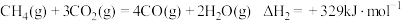
反应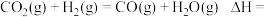
___________
(2)工业上可利用 制备
制备 :
:
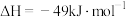
① 时,该反应的平衡常数
时,该反应的平衡常数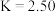 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②提高反应速率且增大 的平衡产率,可采取的措施
的平衡产率,可采取的措施___________ 。
A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出
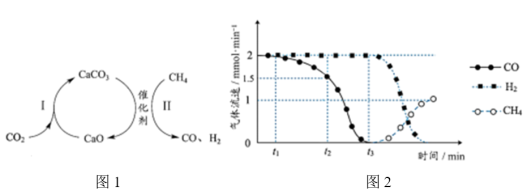
(3)一种捕获 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。___________ 。
② 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因___________ 。
③ 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为___________ 。
(4)在铜基配合物的催化作用下,利用电化学原理可将 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。___________ 。
②当有 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为___________ 。
 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。(1)
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:
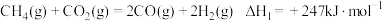
Ⅱ:
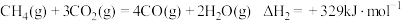
反应
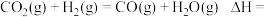
(2)工业上可利用
 制备
制备 :
:
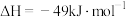
①
 时,该反应的平衡常数
时,该反应的平衡常数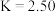 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②提高反应速率且增大
 的平衡产率,可采取的措施
的平衡产率,可采取的措施A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出

(3)一种捕获
 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。
②
 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因③
 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为(4)在铜基配合物的催化作用下,利用电化学原理可将
 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。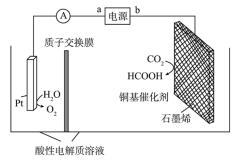
②当有
 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为
您最近半年使用:0次
2 .  的转化有助于实现碳循环和碳减排。
的转化有助于实现碳循环和碳减排。
(1)工业用 和
和 在一定条件下分两步反应生产尿素
在一定条件下分两步反应生产尿素 ,其能量变化示意图如下:
,其能量变化示意图如下:
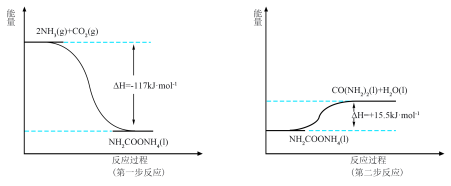
合成尿素总反应的热化学方程式是___________ 。
(2)近年科学家提出“绿色自由”构想。 与
与 在300℃、
在300℃、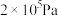 的条件下可生成甲醇,不同温度下,在
的条件下可生成甲醇,不同温度下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化如图所示:
的转化率随温度的变化如图所示:
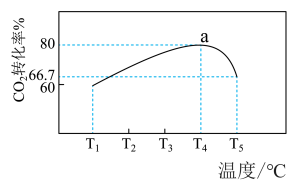
① 阶段温度升高
阶段温度升高 的转化率下降,该反应的
的转化率下降,该反应的
_____ 0(填“ ”或“
”或“ ”),理由是
”),理由是_______ 。
②计算温度为 时a点的平衡常数为
时a点的平衡常数为_______ 。
(3)利用电催化可将 同时转化为多种有机燃料,其原理如图所示。
同时转化为多种有机燃料,其原理如图所示。
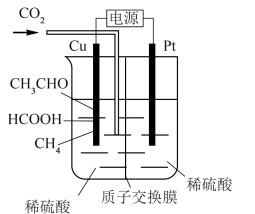
①铜电极上产生 的电极反应式为
的电极反应式为_______ 。
②若铜电极上只生成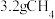 ,则有
,则有____ 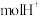 通过质子交换膜。
通过质子交换膜。
③在实际生产中当 过低时,有机燃料产率降低,可能的原因是
过低时,有机燃料产率降低,可能的原因是________ 。
 的转化有助于实现碳循环和碳减排。
的转化有助于实现碳循环和碳减排。(1)工业用
 和
和 在一定条件下分两步反应生产尿素
在一定条件下分两步反应生产尿素 ,其能量变化示意图如下:
,其能量变化示意图如下:
合成尿素总反应的热化学方程式是
(2)近年科学家提出“绿色自由”构想。
 与
与 在300℃、
在300℃、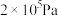 的条件下可生成甲醇,不同温度下,在
的条件下可生成甲醇,不同温度下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化如图所示:
的转化率随温度的变化如图所示:
①
 阶段温度升高
阶段温度升高 的转化率下降,该反应的
的转化率下降,该反应的
 ”或“
”或“ ”),理由是
”),理由是②计算温度为
 时a点的平衡常数为
时a点的平衡常数为(3)利用电催化可将
 同时转化为多种有机燃料,其原理如图所示。
同时转化为多种有机燃料,其原理如图所示。
①铜电极上产生
 的电极反应式为
的电极反应式为②若铜电极上只生成
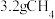 ,则有
,则有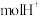 通过质子交换膜。
通过质子交换膜。③在实际生产中当
 过低时,有机燃料产率降低,可能的原因是
过低时,有机燃料产率降低,可能的原因是
您最近半年使用:0次
名校
解题方法
3 . CO2减排能有效降低温室效应,同时,CO2也是一种重要的资源,因此CO2捕集与转化技术研究备受关注。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为_______ 。若反应①为慢反应(活化能高),下列图中能体现上述能量变化的是_______ 。
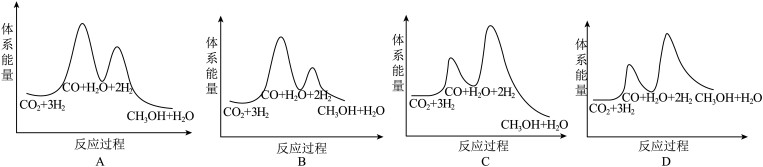
Ⅱ.离子液体聚合物捕集CO2
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
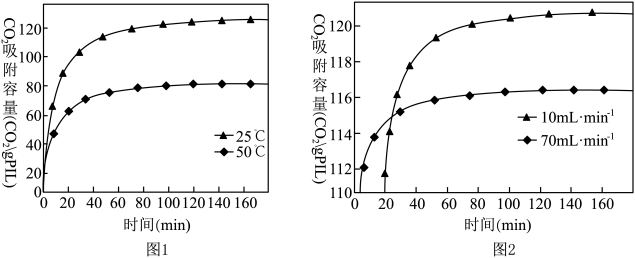
结合图1和图2分析:
①离子液体聚合物捕集CO2的反应为_______ (填“吸热”或“放热”)反应。
②离子液体聚合物捕集CO2的有利条件是_______ 。
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。
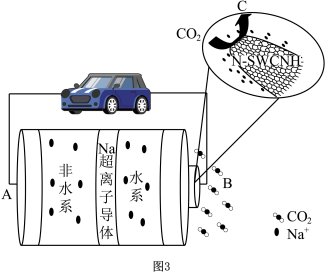
(3)A极为该电池的极_______ (填“正”或“负”)。
(4)B极的电极反应为_______ 。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为

Ⅱ.离子液体聚合物捕集CO2
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。

结合图1和图2分析:
①离子液体聚合物捕集CO2的反应为
②离子液体聚合物捕集CO2的有利条件是
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。

(3)A极为该电池的极
(4)B极的电极反应为
您最近半年使用:0次
4 . 碳酸钠晶体( )失水可得到
)失水可得到 或
或 ,两个化学反应的能量变化示意图如下:
,两个化学反应的能量变化示意图如下:

下列说法不正确 的是
 )失水可得到
)失水可得到 或
或 ,两个化学反应的能量变化示意图如下:
,两个化学反应的能量变化示意图如下:
下列说法
A.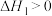 |
B.碳酸钠晶体( )失水是化学变化 )失水是化学变化 |
C.向 中滴加几滴水,温度升高 中滴加几滴水,温度升高 |
D. 失水生成 失水生成 : :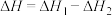 |
您最近半年使用:0次
2023-05-13更新
|
1177次组卷
|
8卷引用:北京市房山区2022-2023学年高三二模化学试题
北京市房山区2022-2023学年高三二模化学试题(已下线)题型13 突破反应热图象(已下线)专题08 化学反应中的能量变化(已下线)第12练 有关反应热的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)【知识图鉴】单元讲练测选择性必修1第1单元02基础练河北省石家庄市第一中学2022-2023学年高一下学期7月期末化学试题北京工业大学附属中学2023-2024学年高二上学期期中考试化学试题上海市奉贤中学2023-2024学年高二上学期12月练习化学试题
5 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
Ⅰ.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
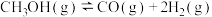
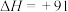 kJ·mol
kJ·mol

 kJ·mol
kJ·mol
写出以甲醇为原料制取氢气的热化学方程式___________ 。
(2)理论上,能提高 平衡产率的措施有
平衡产率的措施有___________ (写出一条即可)。
Ⅱ.储存氢气
硼氢化钠( )是研究最广泛的储氢材料之一
)是研究最广泛的储氢材料之一
已知:
i.B的电负性为2.0,H的电负性为2.1
ii.25℃下 在水中的溶解度为55 g,
在水中的溶解度为55 g, 在水中的溶解度为0.28 g
在水中的溶解度为0.28 g
(3)在配制 溶液时,为了防止发生水解反应,可以加入少量的
溶液时,为了防止发生水解反应,可以加入少量的___________ (填写化学式)。
(4)向 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(
水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠( )和氢气。写出该反应的化学方程式
)和氢气。写出该反应的化学方程式___________ 。
(5)在研究浓度对催化剂Ru/NGR活性的影响时,发现B点后(见图1)增加 的浓度,制氢速率反而下降,推断可能的原因是
的浓度,制氢速率反而下降,推断可能的原因是___________ 。

(6)用惰性电极电解 溶液可制得
溶液可制得 ,实现物质的循环使用,制备装置如图2所示。
,实现物质的循环使用,制备装置如图2所示。

①钛电极的电极反应式是___________ 。
②电解过程中,阴极区溶液pH___________ (填“增大”“减小”或“不变”)
Ⅰ.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
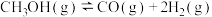
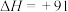 kJ·mol
kJ·mol

 kJ·mol
kJ·mol
写出以甲醇为原料制取氢气的热化学方程式
(2)理论上,能提高
 平衡产率的措施有
平衡产率的措施有Ⅱ.储存氢气
硼氢化钠(
 )是研究最广泛的储氢材料之一
)是研究最广泛的储氢材料之一已知:
i.B的电负性为2.0,H的电负性为2.1
ii.25℃下
 在水中的溶解度为55 g,
在水中的溶解度为55 g, 在水中的溶解度为0.28 g
在水中的溶解度为0.28 g(3)在配制
 溶液时,为了防止发生水解反应,可以加入少量的
溶液时,为了防止发生水解反应,可以加入少量的(4)向
 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(
水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠( )和氢气。写出该反应的化学方程式
)和氢气。写出该反应的化学方程式(5)在研究浓度对催化剂Ru/NGR活性的影响时,发现B点后(见图1)增加
 的浓度,制氢速率反而下降,推断可能的原因是
的浓度,制氢速率反而下降,推断可能的原因是
(6)用惰性电极电解
 溶液可制得
溶液可制得 ,实现物质的循环使用,制备装置如图2所示。
,实现物质的循环使用,制备装置如图2所示。
①钛电极的电极反应式是
②电解过程中,阴极区溶液pH
您最近半年使用:0次
6 .  的综合利用具有重要意义。回答下列问题:
的综合利用具有重要意义。回答下列问题:
(1)我国科研人员提出了由 和
和 转化为高附加值产品
转化为高附加值产品 的催化反应历程。该历程示意图如下。
的催化反应历程。该历程示意图如下。

用化学方程式表示该过程_______ ,该反应为_______ 反应。(填“吸热”或“放热”)
(2) 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: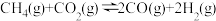
已知:
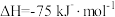
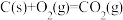
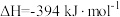
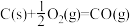
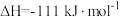
①该催化重整反应的
_______ 
②有利于提高 平衡转化率的条件是
平衡转化率的条件是_______ (填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)将 和
和 的混合气体在固态金属氧化物电解池中电解可制备
的混合气体在固态金属氧化物电解池中电解可制备 和
和 ,是一种新的能源利用方式,基本原理如下图所示。
,是一种新的能源利用方式,基本原理如下图所示。
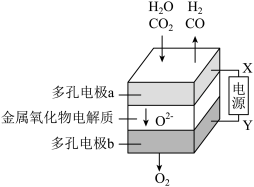
①X是电源的_______ (填“正极”或“负极”),a电极上发生的电极反应式为: 和
和_______ 。
②a和b两电极生成的气体的物质的量之比_______ 。
 的综合利用具有重要意义。回答下列问题:
的综合利用具有重要意义。回答下列问题:(1)我国科研人员提出了由
 和
和 转化为高附加值产品
转化为高附加值产品 的催化反应历程。该历程示意图如下。
的催化反应历程。该历程示意图如下。
用化学方程式表示该过程
(2)
 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: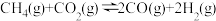
已知:

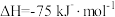
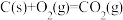
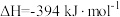
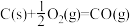
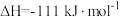
①该催化重整反应的


②有利于提高
 平衡转化率的条件是
平衡转化率的条件是A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)将
 和
和 的混合气体在固态金属氧化物电解池中电解可制备
的混合气体在固态金属氧化物电解池中电解可制备 和
和 ,是一种新的能源利用方式,基本原理如下图所示。
,是一种新的能源利用方式,基本原理如下图所示。
①X是电源的
 和
和②a和b两电极生成的气体的物质的量之比
您最近半年使用:0次
名校
7 . 氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g) 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为_______ 。在一定条件下氨的平衡含量如表:
①该反应为_______ (填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是_______ 。
(2)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。

①曲线a对应的温度是____________ 。
②M、N、Q点平衡常数K的大小关系是______________ 。
(3)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为_______ 。

(4)NH3转化为NO是工业制取硝酸的重要一步。已知:100kPa、298K时:
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=—1268kJ/mol
2N2(g)+6H2O(g) ΔH=—1268kJ/mol
2NO(g) N2(g)+O2(g) ΔH=—180.5kJ/mol
N2(g)+O2(g) ΔH=—180.5kJ/mol
请写出NH3转化为NO的热化学方程式_______ 。
(1)反应N2(g)+3H2(g)
 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
(2)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。

①曲线a对应的温度是
②M、N、Q点平衡常数K的大小关系是
(3)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为

(4)NH3转化为NO是工业制取硝酸的重要一步。已知:100kPa、298K时:
4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH=—1268kJ/mol
2N2(g)+6H2O(g) ΔH=—1268kJ/mol2NO(g)
 N2(g)+O2(g) ΔH=—180.5kJ/mol
N2(g)+O2(g) ΔH=—180.5kJ/mol请写出NH3转化为NO的热化学方程式
您最近半年使用:0次
2022-12-01更新
|
191次组卷
|
6卷引用:北京市房山区2022届高三第二次模拟测试化学试题
8 . 工业上利用 CO2和 H2反应生成甲醇,也是减少CO2的一种方法。在容积为1 L的恒温密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
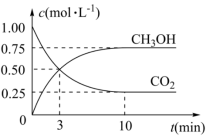
(1)反应达到平衡的时刻是第_______ min(填“3”或“10”)。
(2)能判断该反应达到化学平衡状态的依据是_______。
(3)达平衡后,H2的转化率是_______ 。为了提高H2的转化率,可采取_______ (填“增大”或“减小”)CO2浓度的措施。
(4)工业上也可用CO和H2合成甲醇
已知:①CO(g)+ O2(g)=CO2(g) H1=-283.0 kJ·mol-1
O2(g)=CO2(g) H1=-283.0 kJ·mol-1
②H2(g)+ O2(g)=H2O(g) H2=-241.8 kJ·mol-1
O2(g)=H2O(g) H2=-241.8 kJ·mol-1
③CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) H3=-192.2 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) H3=-192.2 kJ·mol-1
则反应CO(g)+2H2(g)=CH3OH(g) H=_______ kJ·mol-1
 CH3OH(g)+H2O(g) H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)反应达到平衡的时刻是第
(2)能判断该反应达到化学平衡状态的依据是_______。
| A.容器内压强不再变化 | B.混合气体中c(CO2)不变 |
| C.反应停止,不再进行 | D.c(CH3OH)=c(H2O) |
(4)工业上也可用CO和H2合成甲醇
已知:①CO(g)+
 O2(g)=CO2(g) H1=-283.0 kJ·mol-1
O2(g)=CO2(g) H1=-283.0 kJ·mol-1②H2(g)+
 O2(g)=H2O(g) H2=-241.8 kJ·mol-1
O2(g)=H2O(g) H2=-241.8 kJ·mol-1③CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) H3=-192.2 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) H3=-192.2 kJ·mol-1则反应CO(g)+2H2(g)=CH3OH(g) H=
您最近半年使用:0次
9 . Ⅰ:载人航天器中,利用萨巴蒂尔反应将航天员呼出的 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。
的再生。
已知:①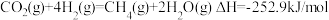
②
请回答:
(1)反应②属于_______ (填“吸热”或“放热”)反应。
(2)反应①消耗 时,反应
时,反应_______ (填“吸热”或“放热”)热量,其数值为_______ kJ。
(3)反应②热量变化为 时,生成
时,生成 的质量为
的质量为_______ 。
(4)反应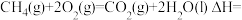
_______  。
。
Ⅱ: 资源化利用的方法之一是合成二甲醚
资源化利用的方法之一是合成二甲醚 。
。 催化加氢合成二甲醚的过程中主要发生下列反应:
催化加氢合成二甲醚的过程中主要发生下列反应:
反应Ⅰ:
反应Ⅱ:
(5)其中,反应Ⅱ:分以下①②两步完成,请写出反应①的热化学方程式。
①_______ 。
②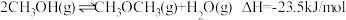
 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。
的再生。已知:①
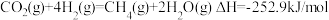
②

请回答:
(1)反应②属于
(2)反应①消耗
 时,反应
时,反应(3)反应②热量变化为
 时,生成
时,生成 的质量为
的质量为(4)反应
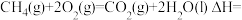
 。
。Ⅱ:
 资源化利用的方法之一是合成二甲醚
资源化利用的方法之一是合成二甲醚 。
。 催化加氢合成二甲醚的过程中主要发生下列反应:
催化加氢合成二甲醚的过程中主要发生下列反应:反应Ⅰ:

反应Ⅱ:

(5)其中,反应Ⅱ:分以下①②两步完成,请写出反应①的热化学方程式。
①
②
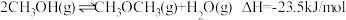
您最近半年使用:0次
名校
解题方法
10 . 已知下列热化学方程式: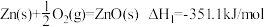 ;
;
 ,由此可知
,由此可知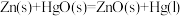 的
的 ,其中
,其中 的值是
的值是
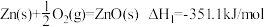 ;
; ,由此可知
,由此可知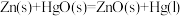 的
的 ,其中
,其中 的值是
的值是A.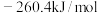 | B.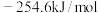 |
C.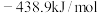 | D.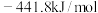 |
您最近半年使用:0次
2022-10-22更新
|
225次组卷
|
3卷引用:北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题



