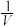1 . 利用太阳能分解H2O获得氢气,再通过CO2加氢制甲醇(CH3OH)等燃料,从而实现可再生能源和 CO2的资源化利用。
(1)过程Ⅰ的能量转化形式为,由___________ 能转化为___________ 能。
(2)活化CO2需从外界输入电子,CO2中易于获得电子的原子是___________ 。
(3)过程Ⅱ中CO2催化加氢制取甲醇,反应如下:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) ∆H1=-49.0kJ·mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) ∆H2 = + 41.2 kJ·mol-1
CO(g)+H2O(g) ∆H2 = + 41.2 kJ·mol-1
①CO、H2生成CH3OH的热化学方程式是___________ 。
②提高CH3OH在平衡体系中的含量,可采取如下措施:___________ (写出两条即可)。
(4)过程Ⅲ中制得的H2中混有CO,去除CO的反应如下: CO(g)+H2O(g) CO2(g)+H2(g)。在容积不变的密闭容器中,将0.1 mol CO、0.1 mol H2O混合加热到830℃,平衡时 CO的转化率为50%,反应的平衡常数K=
CO2(g)+H2(g)。在容积不变的密闭容器中,将0.1 mol CO、0.1 mol H2O混合加热到830℃,平衡时 CO的转化率为50%,反应的平衡常数K=___________ 。

(1)过程Ⅰ的能量转化形式为,由
(2)活化CO2需从外界输入电子,CO2中易于获得电子的原子是
(3)过程Ⅱ中CO2催化加氢制取甲醇,反应如下:
主反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) ∆H1=-49.0kJ·mol-1副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2 = + 41.2 kJ·mol-1
CO(g)+H2O(g) ∆H2 = + 41.2 kJ·mol-1①CO、H2生成CH3OH的热化学方程式是
②提高CH3OH在平衡体系中的含量,可采取如下措施:
(4)过程Ⅲ中制得的H2中混有CO,去除CO的反应如下: CO(g)+H2O(g)
 CO2(g)+H2(g)。在容积不变的密闭容器中,将0.1 mol CO、0.1 mol H2O混合加热到830℃,平衡时 CO的转化率为50%,反应的平衡常数K=
CO2(g)+H2(g)。在容积不变的密闭容器中,将0.1 mol CO、0.1 mol H2O混合加热到830℃,平衡时 CO的转化率为50%,反应的平衡常数K=
您最近一年使用:0次
2 . 依据图示关系,下列说法不正确 的是


| A.反应①是吸热反应 |
| B.△H3=△H1+△H2 |
| C.反应③是一个熵增的反应 |
| D.数据表明:V2O5(s)的能量比V2O4(s)低,更稳定 |
您最近一年使用:0次
2021-05-03更新
|
512次组卷
|
5卷引用:北京市丰台区2021届高三第二次模拟考试化学试题
北京市丰台区2021届高三第二次模拟考试化学试题(已下线)第17讲 化学能与热能(精练)-2022年高考化学一轮复习讲练测2020年北京高考化学真题变式题11-19江苏省宿迁市泗阳县2022-2023学年高二上学期11月期中化学试题山东省威海大光华学校2023-2024学年高二11月月考化学试题
名校
解题方法
3 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
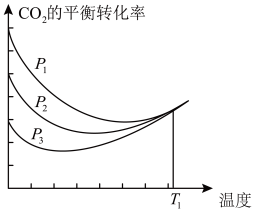
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
2021-04-04更新
|
1237次组卷
|
10卷引用:北京市丰台区2021届高三一模化学试题
北京市丰台区2021届高三一模化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)河北省武邑中学2021届高考七模化学试题黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题云南省保山市腾冲市第八中学2020-2021学年高二下学期期中考试化学试卷湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题山东省烟台市龙口市2023-2024学年高二上学期10月统考化学试题
名校
解题方法
4 . 工业上常用天然气作为制备CH3OH的原料。已知:
①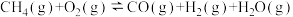 △H=-321.5 kJ/ mol
△H=-321.5 kJ/ mol
②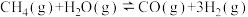 △H=+250. 3 kJ/mol
△H=+250. 3 kJ/mol
③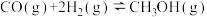 △H=-90.0 kJ/mol
△H=-90.0 kJ/mol
(1)CH4(g)与O2(g)化合生成CH3OH(g)的热化学方程式是_______ 。
(2)利用③的原理,向密闭容器中充入1 mol CO与2mol H2,在不同压强下合成甲醇。CO的平衡转化率与温度、压强(p)的关系如下图所示:
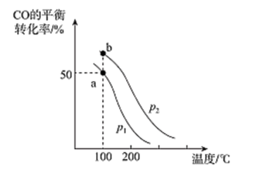
①压强p1_______ p2(填“<”或“>”)。
②根据图中a点的数据(此时容器体积为V L),将下表中空格处填写完整。
③若反应刚好至a点时,所需时间为t min,则t min内用H2表示该反应的化学反应速率v(H2)=____ 。
④b点时,该反应的平衡常数K=_______ 。
①
 △H=-321.5 kJ/ mol
△H=-321.5 kJ/ mol②
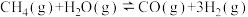 △H=+250. 3 kJ/mol
△H=+250. 3 kJ/mol③
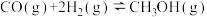 △H=-90.0 kJ/mol
△H=-90.0 kJ/mol(1)CH4(g)与O2(g)化合生成CH3OH(g)的热化学方程式是
(2)利用③的原理,向密闭容器中充入1 mol CO与2mol H2,在不同压强下合成甲醇。CO的平衡转化率与温度、压强(p)的关系如下图所示:

①压强p1
②根据图中a点的数据(此时容器体积为V L),将下表中空格处填写完整。
c(CO) | c(H2) | c(CH3OH) | |
起始时 |
|
| 0 |
转化 |
| ||
平衡时 |
④b点时,该反应的平衡常数K=
您最近一年使用:0次
2021-02-03更新
|
157次组卷
|
2卷引用:北京市八十中2020-2021学年高二下学期开学考试化学试题
名校
解题方法
5 . 工业上处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为S和CO2。已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol; S(s)+O2(g)=SO2(g) ΔH=-296 kJ/mol;则该条件下2CO(g)+SO2(g)=S(s)+2CO2(g)的ΔH等于
| A.- 270 kJ/mol | B.+26 kJ/mol | C.-582 kJ/mol | D.+270 kJ/mol |
您最近一年使用:0次
2021-01-24更新
|
1507次组卷
|
29卷引用:北京市八十中2020-2021学年高二下学期开学考试化学试题
北京市八十中2020-2021学年高二下学期开学考试化学试题北京市西城区2020-2021学年高二上学期期末考试化学试题北京市回民学校2021-2022学年高二上学期期中考试化学试题北京市第十五中学2021-2022学年高二上学期期中考试化学试题北京市师范大学亚太实验学校2021-2022学年高二上学期期中考试化学试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题北京市清华附中2021-2022学年高一下学期期末考试化学试题第一章化学反应的热效应北京十四中2022-2023学年高二上学期期中检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京师范大学第二附属中学2022-2023学年高二上学期期中考试化学试题北京市顺义区顺义第一中学2022-2023学年高二上学期期中考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题广西百色民族高级中学2022-2023学年高二上学期10月阶段检测化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题新疆阿勒泰地区2022-2023学年高一下学期期末考试化学试题(已下线)专题02 盖斯定律、反应热的计算【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)北京市育才学校2023-2024学年高二上学期10月月考化学试题北京市东直门中学2022-2023学年高二上学期期中考试化学试题北京市北京医学院附属中学2022-2023学年高二上学期期中考试化学试题江西省抚州市临川第一中学2023-2024学年高二上学期期中考试 化学试卷北京市西城区2022-2023学年育才学校高二上学期化学期中考试北京市顺义区2023-2024学年第九中学高二上学期化学期中试题北京市中国人民大学附属中学通州校区2023-2024学年高二上学期10月月考化学试题北京市通州区2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高二上学期期中考试化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题北京师范大学附属昌平学校2023-2024学年高二上学期12月月考化学试题
6 . CO2可用于合成多种化工原料。用 CO2生产绿色燃料甲醇时发生反应A:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
(1)反应A的平衡常数表达式是_________ 。
(2)已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH2
H2O(g)=H2O(l) ΔH3
ΔH1不易直接测得,为了通过ΔH2和ΔH3计算得到ΔH1,还需测定如下反应的反应热:_______ 。
(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。
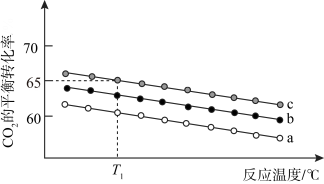
①反应 A 的ΔH1________ 0(填“>”或“<”)。
②曲线 c 对应的投料是_________ 。
③T1℃时,曲线c 对应的化学平衡常数_________ 1(填“>”、“<”或“=”)。
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。
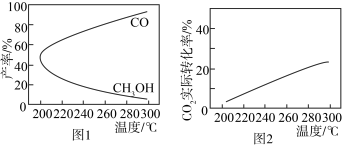
由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_______ 。
(1)反应A的平衡常数表达式是
(2)已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH2
H2O(g)=H2O(l) ΔH3
ΔH1不易直接测得,为了通过ΔH2和ΔH3计算得到ΔH1,还需测定如下反应的反应热:
(3)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。

①反应 A 的ΔH1
②曲线 c 对应的投料是
③T1℃时,曲线c 对应的化学平衡常数
(4)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。

由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是
您最近一年使用:0次
7 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:
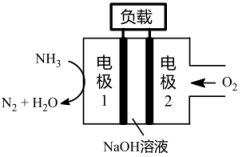
①电极1为_______ (填“正极”或“负极”),电极2的反应式为_______ 。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:i.2H2(g)+O2(g)=2H2O(g) ΔH1
ii.N2(g)+3H2(g)⇌2NH3(g) ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=_______ 。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是_______ 。
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是_______ 。。
②列举一条既能提高速率又能提高原料转化率的措施_______ 。
(3)常温常压下电解法合成氨的原理如下图所示:
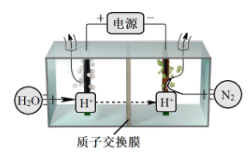
①阳极产生的气体是_______ 。
②阴极生成氨的电极反应式为_______ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式_______ 。
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有_______ 性。
(1)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:

①电极1为
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:i.2H2(g)+O2(g)=2H2O(g) ΔH1
ii.N2(g)+3H2(g)⇌2NH3(g) ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是
②列举一条既能提高速率又能提高原料转化率的措施
(3)常温常压下电解法合成氨的原理如下图所示:

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有
您最近一年使用:0次
2021-01-22更新
|
257次组卷
|
2卷引用:北京市丰台区2020-2021学年高二上学期期末考试化学试题
8 . 零价纳米铁在环境修复中具有广泛应用,可用来处理地下水中的铼酸根离子( )。
)。
资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。
(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式___ 。
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑
①氮气作用下烘干的目的是___ 。
②每生成1molFe,转移电子数为___ 。
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。
①写出反应的离子方程式___ 。
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是___ 。
③研究表明pH过高或过低会使 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是___ 。
 )。
)。资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO
 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2
 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑①氮气作用下烘干的目的是
②每生成1molFe,转移电子数为
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、
 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。①写出反应的离子方程式
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是
③研究表明pH过高或过低会使
 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是
您最近一年使用:0次
2021-01-22更新
|
331次组卷
|
2卷引用:北京市丰台区2021届高三上学期期末考试化学试题