1 . 火力发电厂释放出大量气体会造成环境污染。对燃煤废气进行处理,可实现绿色环保、废物利用等目的。
(1)CO可以与H2O(g)发生反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0,在甲、乙、丙三个恒容密闭容器中,起始时按照如表进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) △H<0,在甲、乙、丙三个恒容密闭容器中,起始时按照如表进行投料,在800℃时达到平衡状态,K=1.0。
①该反应的平衡常数表达式为___________ 。
②平衡时,丙容器中H2O的物质的量是___________ mol,甲容器中CO的转化率是 ___________ ,容器中CO的转化率:乙 ___________ 甲(填“>”、“=”或“<”)。
③丙容器中,其它条件不变时,温度___________ (填“升高”或“降低”),CO的平衡转化率升高。
(2)除去氮氧化物:
①利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=﹣1160kJ•mol﹣1
甲烷直接将NO2还原为N2的热化学方程式为___________ 。
②也可用氨气与之发生反应:NOx+NH3→N2+2H2O。现有NO2和NO的混合气体3.0L,和3.4L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2和NO的体积比是___________ 。
(1)CO可以与H2O(g)发生反应:CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0,在甲、乙、丙三个恒容密闭容器中,起始时按照如表进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) △H<0,在甲、乙、丙三个恒容密闭容器中,起始时按照如表进行投料,在800℃时达到平衡状态,K=1.0。| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为
②平衡时,丙容器中H2O的物质的量是
③丙容器中,其它条件不变时,温度
(2)除去氮氧化物:
①利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=﹣1160kJ•mol﹣1
甲烷直接将NO2还原为N2的热化学方程式为
②也可用氨气与之发生反应:NOx+NH3→N2+2H2O。现有NO2和NO的混合气体3.0L,和3.4L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2和NO的体积比是
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)对温室气体CO2进行减排和综合治理具有十分重要的意义。CH4•CO2催化重整不仅对温室气体的减排有重要意义,还可以得到合成气(CO和H2)。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ•mol﹣1
②CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H2=+165.0kJ•mol﹣1
写出该催化重整反应的热化学方程式:___________ 。
(2)若适量的N2和O2完全反应,每生成92gNO2需要吸收67.8kJ热量,则表示该反应的热化学方程式为___________ 。
(3)在0℃、101kPa时,44.8LH2在足量O2中完全燃烧生成H2O(1)放出571.6k]的热量,则表示H2燃烧热的热化学方程式为___________ 。
(4)我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到;C2H6(g) C2H4(g)+H2(g),相关化学键的键能数据如表所示,则上述反应的△H等于
C2H4(g)+H2(g),相关化学键的键能数据如表所示,则上述反应的△H等于 ___________ 。
(5)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) △H1
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2
再燃料水煤气:2CO(g)+O2(g)=2CO2(g) △H3
2H2(g)+O2(g)=2H2O(g) △H4
则△H1=___________ (用△H2、△H3、△H4表示)。
(1)对温室气体CO2进行减排和综合治理具有十分重要的意义。CH4•CO2催化重整不仅对温室气体的减排有重要意义,还可以得到合成气(CO和H2)。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ•mol﹣1
②CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H2=+165.0kJ•mol﹣1
写出该催化重整反应的热化学方程式:
(2)若适量的N2和O2完全反应,每生成92gNO2需要吸收67.8kJ热量,则表示该反应的热化学方程式为
(3)在0℃、101kPa时,44.8LH2在足量O2中完全燃烧生成H2O(1)放出571.6k]的热量,则表示H2燃烧热的热化学方程式为
(4)我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到;C2H6(g)
 C2H4(g)+H2(g),相关化学键的键能数据如表所示,则上述反应的△H等于
C2H4(g)+H2(g),相关化学键的键能数据如表所示,则上述反应的△H等于 | 化学键 | C﹣H | C﹣C | C=C | H﹣H |
| 键能/(kJ•mol﹣1) | 410 | 345 | 610 | 430 |
(5)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) △H1
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2
再燃料水煤气:2CO(g)+O2(g)=2CO2(g) △H3
2H2(g)+O2(g)=2H2O(g) △H4
则△H1=
您最近一年使用:0次
解题方法
3 . 将CO2还原成甲烷,是实现CO2资源化利用的有效途径之一。
I.CO2甲烷化
CO2甲烷化过程可能发生反应:
ⅰ.CO2(g) + 4H2(g) CH4(g) + 2H2O(g) ΔH1
CH4(g) + 2H2O(g) ΔH1
ⅱ.CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+41.2 kJ∙mol−1
CO(g) + H2O(g) ΔH2=+41.2 kJ∙mol−1
ⅲ.CO(g) + 3H2(g) CH4(g) + H2O(g) ΔH3=-206.1 kJ∙mol−1
CH4(g) + H2O(g) ΔH3=-206.1 kJ∙mol−1
……
(1)ΔH1=______ kJ∙mol−1。
(2)不同条件下,按照n(CO2):n(H2)=1:4投料,CO2的平衡转化率如图所示。


①压强p1、p2、p3由大到小的顺序是______ 。
②压强为p1时,随着温度升高,CO2的平衡转化率先减小后增大。解释温度高于600℃之后,随着温度升高CO2转化率增大的原因______ 。
Ⅱ.微生物电化学法
微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如上图所示。
(3)阴极的电极反应式是______ 。
(4)若生成1 mol CH4,理论上阳极室生成CO2的体积是______ L(标准状况,忽略气体的溶解)。
I.CO2甲烷化
CO2甲烷化过程可能发生反应:
ⅰ.CO2(g) + 4H2(g)
 CH4(g) + 2H2O(g) ΔH1
CH4(g) + 2H2O(g) ΔH1ⅱ.CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH2=+41.2 kJ∙mol−1
CO(g) + H2O(g) ΔH2=+41.2 kJ∙mol−1ⅲ.CO(g) + 3H2(g)
 CH4(g) + H2O(g) ΔH3=-206.1 kJ∙mol−1
CH4(g) + H2O(g) ΔH3=-206.1 kJ∙mol−1……
(1)ΔH1=
(2)不同条件下,按照n(CO2):n(H2)=1:4投料,CO2的平衡转化率如图所示。


①压强p1、p2、p3由大到小的顺序是
②压强为p1时,随着温度升高,CO2的平衡转化率先减小后增大。解释温度高于600℃之后,随着温度升高CO2转化率增大的原因
Ⅱ.微生物电化学法
微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如上图所示。
(3)阴极的电极反应式是
(4)若生成1 mol CH4,理论上阳极室生成CO2的体积是
您最近一年使用:0次
名校
解题方法
4 . 正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
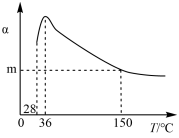
下列说法不正确 的是

名称 | 熔点/℃ | 沸点/℃ | 燃烧热 ∆H /kJ•mol-1 |
正戊烷 | -130 | 36 | –3506.1 |
异戊烷 | -159.4 | 27.8 | –3504.1 |
| A.25 ℃,101 kPa时,正戊烷异构化成异戊烷的热化学反应方程式为:CH3CH2CH2CH2CH3(l) = (CH3)2CHCH2CH3(l) ∆H = –2.0 kJ/mol |
| B.28~36 ℃时,随温度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动 |
| C.36~150 ℃时,随温度升高,正戊烷异构化反应的平衡常数增大 |
| D.150 ℃时,体系压强从100 kPa升高到500 kPa,正戊烷的平衡转化率基本不变 |
您最近一年使用:0次
2021-04-05更新
|
1180次组卷
|
12卷引用:北京市石景山区2021届高三一模化学试题
北京市石景山区2021届高三一模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(01)湖南省长沙市第一中学2021届高三第一次模拟考试化学试题广东省汕头市金山中学2021届高三下学期第三次模拟考试化学试题重庆市西南大学附属中学2020-2021学年高三下学期第六次月考化学试题(已下线)第22讲 化学平衡常数及转化率的计算(精练)-2022年高考化学一轮复习讲练测天津市宁河区芦台第一中学2022届高三下学期线上模拟(一)化学试题湖北省武汉市第一中学2023届高三上学期第一次月考化学试题北京市朝阳区2023届高三下学期三模化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题辽宁省沈阳市东北育才双语学校2023-2024学年高二上学期自主测评化学试题
5 . 已知热化学方程式:
①C(金刚石,s)+O2(g)=CO2(g) ΔH1
②C(石墨,s)+O2(g)=CO2(g) ΔH2
③C(石墨,s)=C(金刚石,s) ΔH3=+1.9kJ∙mol-1
下列说法正确的是( )
①C(金刚石,s)+O2(g)=CO2(g) ΔH1
②C(石墨,s)+O2(g)=CO2(g) ΔH2
③C(石墨,s)=C(金刚石,s) ΔH3=+1.9kJ∙mol-1
下列说法正确的是( )
| A.石墨转化成金刚石的反应是吸热反应 |
| B.金刚石比石墨稳定 |
| C.ΔH3=ΔH1-ΔH2 |
| D.ΔH1>ΔH2 |
您最近一年使用:0次
2020-10-16更新
|
425次组卷
|
23卷引用:北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题
北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题新疆乌苏市第一中学2021-2022学年高二上学期10月月考化学试题(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练新疆石河子第二中学2021-2022学年高二上学期第二次月考化学试题2014-2015学年福建省清流一中高二上学期月考化学理试卷2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷2017届广西桂林市第十八中学高三上第二次月考化学试卷高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第二课时(反应热的计算)河南省郑州市第106中学2018-2019学年高二上学期第一次月考化学试题陕西省汉中中学2018-2019学年高二上学期期中考试化学试题河南省周口中英文学校2019-2020学年高二上学期第一次月考化学试题辽宁省建平第二高级中学2019-2020学年高二上学期9月月考化学试题天津市静海区大邱庄中学等四校2019-2020学年高二10联考化学试题陕西省渭南三贤中学2019-2020学年高二上学期期中考试化学试题云南省玉溪市江川区二中2019-2020学年高二上学期期末考试化学试题(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)陕西省西安市第七十五中学2019-2020学年高二第一次月考化学试题(已下线)湖南省邵东县第一中学2018-2019学年高二上学期第三次月考化学(理)试题陕西省咸阳百灵中学2020-2021学年高二上学期第一次月考化学试题黑龙江伊春林业管理局第二中学2021届高三上学期期中考试化学试题四川省南充市第一中学2021-2022学年高一下学期6月月考化学试题福建省莆田第七中学2021-2022学年高二上学期期末考试化学试题第一章 第二节 反应热的计算



