名校
解题方法
1 .  、
、 下,①
下,①
②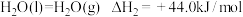
下列说法不正确 的是
 、
、 下,①
下,①
②
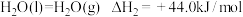
下列说法
| A.液态水变为水蒸气破坏的是分子间作用力 |
| B.水分解为氢气和氧气,断键吸收的总能量大于成键放出的总能量 |
C.标准状况下, 水中含共用电子对总数约为 水中含共用电子对总数约为 |
D. 、 、 下, 下,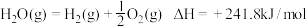 |
您最近一年使用:0次
2023-01-05更新
|
647次组卷
|
4卷引用:北京市石景山区2022-2023学年高三上学期期末考试化学试题
2 . CO2分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用CO2作为碳源,通过CO2催化加氢方式,不仅可以减少温室气体的排放,还可以将CO2转化为高附加值的化学产品,具有重要的战略意义。
(1)若活化CO2,通常需要采取适当的方式使CO2的分子结构从_______ (填分子的空间结构名称)变为弯曲型,便于下一步反应。
(2)一种CO2直接加氢的反应机理如图a所示。

①写出总反应的化学方程式_______ 。
②MgOCO2也可以写成MgCO3,写出CO 的VSEPR模型名称
的VSEPR模型名称_______ 。
(3)①已知:主反应CO2催化加氢制甲醇是放热反应
2H2(g)+O2(g)=2H2O(g) ΔH1
2CH3OH(g)+3O2(g)=4H2O(g)+2CO2(g) ΔH2
写出CO2催化加氢制甲醇的热化学方程式_______ (ΔH用含ΔH1和ΔH2的代数式表示)。
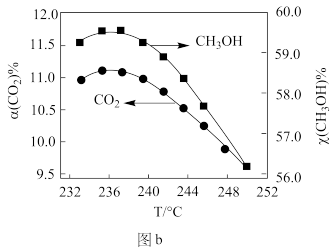
②CO2催化加氢制甲醇过程中的主要竞争反应为:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41kJ/mol,在恒温密闭容器中,维持压强和投料不变,将CO2和H2按一定流速通过反应器,CO2转化率和CH3OH选择性[x(CH3OH)%=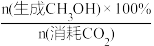 ]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因
]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因_______ 。
③我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式_______ 。
(1)若活化CO2,通常需要采取适当的方式使CO2的分子结构从
(2)一种CO2直接加氢的反应机理如图a所示。

①写出总反应的化学方程式
②MgOCO2也可以写成MgCO3,写出CO
 的VSEPR模型名称
的VSEPR模型名称(3)①已知:主反应CO2催化加氢制甲醇是放热反应
2H2(g)+O2(g)=2H2O(g) ΔH1
2CH3OH(g)+3O2(g)=4H2O(g)+2CO2(g) ΔH2
写出CO2催化加氢制甲醇的热化学方程式
②CO2催化加氢制甲醇过程中的主要竞争反应为:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41kJ/mol,在恒温密闭容器中,维持压强和投料不变,将CO2和H2按一定流速通过反应器,CO2转化率和CH3OH选择性[x(CH3OH)%=
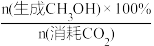 ]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因
]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因
③我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式
您最近一年使用:0次
名校
3 . 已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol
CO(g)+ O2(g)=CO2(g) ΔH2=-283kJ/mol
O2(g)=CO2(g) ΔH2=-283kJ/mol
理论上2mol石墨不充分燃烧,生成等物质的量的CO(g)和CO2(g)放出的热量是
CO(g)+
 O2(g)=CO2(g) ΔH2=-283kJ/mol
O2(g)=CO2(g) ΔH2=-283kJ/mol理论上2mol石墨不充分燃烧,生成等物质的量的CO(g)和CO2(g)放出的热量是
| A.676.5kJ | B.504kJ | C.283kJ | D.110.5kJ |
您最近一年使用:0次
2022-01-17更新
|
482次组卷
|
6卷引用:北京市石景山区2021-2022学年高三上学期期末考试化学试题
北京市石景山区2021-2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)河北省石家庄市第二中学2021-2022学年高一下学期期中考试化学试题北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题山东省临沂市沂水县2022-2023学年高二上学期学科素养(期中)检测化学试题(已下线)第02讲 反应热的计算-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
解题方法
4 . 合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH1=−akJ·mol-1
O2(g)+2H2(g)=2H2O(l) ΔH2=−bkJ·mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是___________ 。
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2的转化率为___________ ,平衡常数K=___________ (可用分数表示)。
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
③L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

i.X代表的物理量是___________ 。
ii.判断L1、L2的大小关系,并简述理由___________ 。
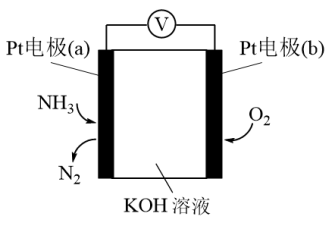
(3)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示,则a极的电极反应式为___________ 。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH1=−akJ·mol-1
O2(g)+2H2(g)=2H2O(l) ΔH2=−bkJ·mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
| 物质 | N2 | H2 | NH3 |
| 平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
| 物质 | N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.5 | 1.5 | 0.5 |

i.X代表的物理量是
ii.判断L1、L2的大小关系,并简述理由
(3)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示,则a极的电极反应式为

您最近一年使用:0次



