名校
解题方法
1 . 已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0 kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
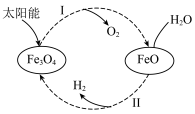
| A.过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子 |
| B.过程Ⅱ的热化学方程式为3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+128.9 kJ/mol |
| C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
| D.铁氧化合物循环制H2具有成本低、产物易分离等优点 |
您最近一年使用:0次
2023-09-19更新
|
359次组卷
|
25卷引用:【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题
【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题海南省海南中学2019-2020学年高二上学期期末考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题10-2020年北京新高考化学模拟试题(已下线)专题九 化学能与热能(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节综合训练高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 第二节综合训练河北省沧州市泊头市第一中学2020-2021学年高二上学期第一次月考化学试题山东省德州市夏津第一中学2020-2021学年高二上学期9月月考化学试题辽源市第五中学2019-2020学年高一下学期第二次月考化学试题湖南省中方一中2020-2021学年高二上学期期中考试化学试题河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研二化学试题河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题(已下线)模块七 化学反应与能量(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)贵州省黔西南州赛文高级中学 2021-2022学年高二上学期期中考试化学试题河北省沧州市泊头市第一中学2021-2022学年高二上学期第一次月考化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用(已下线)题型98 结合反应能量图示或物质循环图示书写热化学方程式山东省烟台市招远第一中学2022-2023学年高一下学期期中考试化学(等级考)试题(已下线)章末综合评价(六)河南省洛阳市宜阳县第一高级中学清北园2023-2024学年高一上学期第七次能力达标测试化学试卷
10-11高三上·北京石景山·期末
名校
2 . 已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=﹣870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=﹣393.5 kJ·mol-1
③H2(g) + O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=﹣870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=﹣393.5 kJ·mol-1
③H2(g) +
 O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为
| A.﹣488.3 kJ·mol-1 | B.﹣224.15 kJ·mol-1 |
| C.488.3 kJ·mol-1 | D.244.15 kJ·mol-1 |
您最近一年使用:0次
2021-11-17更新
|
1507次组卷
|
90卷引用:北京市石景山区2010学年第一学期期末考试试卷
(已下线)北京市石景山区2010学年第一学期期末考试试卷(已下线)2011届浙江金华一中高三上学期期中考试化学试卷(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2011届江西省吉安市高三第三次模拟考试(理综)化学部分(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2012届山东省枣庄十八中高三10月份质量检测化学试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012学年湖南省凤凰县华鑫中学高二上12月月考化学试卷(已下线)2012届北京市密云二中高三10月月考化学试卷(已下线)2010-2011学年安徽省怀宁县高河中学高二下学期第二次月考化学试卷(已下线)2011-2012学年陕西省宝鸡中学高一下学期期中考试化学试卷(已下线)2012-2013学年辽宁省盘锦市第二高级中学高二9月月考化学试卷(已下线)2012-2013学年江西省九江一中高二第一次月考化学试卷(已下线)2012-2013学年重庆市重庆一中高二上学期期中考试理科化学试卷(已下线)2012-2013学年广东省汕头市金山中学高二上学期期末考试化学试卷(已下线)2012-2013学年江苏省新马高级中学高二下学期期末考试化学试卷(已下线)2014年高二化学人教版选修四 4化学反应热的计算练习卷(已下线)2013-2014吉林省长春市十一中高二下学期期末考试化学试卷(已下线)2015届安徽望江中学同步课时练(人教选修4)1.3化学反应热的计算(已下线)2014-2015学年吉林省汪清县第六中学高二上学期期中考试化学试卷(已下线)2014秋安徽省黄山市屯溪一中高二上学期期中考试化学试卷2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷2015-2016学年四川省雅安中学高二上期中考试化学试卷2015-2016学年宁夏育才中学高二上期末考试化学试卷2015-2016学年辽宁省五校协作体高一下学期期中考试化学试卷2017届湖北省松滋市第一中学高三上学期9月月考化学试卷2016-2017学年内蒙古集宁一中高二上期中化学试卷2016-2017学年广西宾阳中学高二上9月月考化学试卷2016-2017学年江西省宜春市奉新一中高二上月考一化学试卷苏教版2017届高三单元精练检测六化学试题苏教版2017届高三单元精练检测六化学试题甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题河南省南阳市七校2017-2018学年高二上学期第一次联考化学试题山东省济南市第一中学2017-2018学年高二10月阶段测试化学试题山东省济南第一中学2017-2018学年高二上学期期中考试化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第二次月考化学试题黑龙江省哈尔滨三中2017-2018学年高二上学期11月第一次验收考试化学试题人教版2017届高三单元精练检测六化学试题(已下线)2018年9月12日 《每日一题》一轮复习-反应热的计算【校级联考】福建省长汀、连城一中等六校2018-2019学年高二年上学期期中考联考化学试题安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点(已下线)2019年4月14日《每日一题》三轮复习—— 每周一测【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期4月月考化学试题【全国百强校】广东省中山市第一中学2018-2019学年高一下学期第二次(5月)段考化学试题(已下线)2019年8月30日 《每日一题》人教选修4——盖斯定律的应用黑龙江省伊春市第二中学2018届高三上学期期中考试化学试题河南省林州市第一中学2019-2020学年高二9月月考化学试题河南林州一中2019-2020学年高二上9月化学测试题辽宁省葫芦岛市第八高级中学2020届高三10月月考化学试题湖北省黄冈市2019-2020学年高二10月月考化学试题海南省东方市八所中学2019-2020学年高二上学期第一次月考化学试题宁夏育才中学2019-2020学年高二上学期第一次月考化学试题陕西省榆林市第二中学2020届高三第四次模拟考试化学试题安徽省肥东县第二中学2019-2020学年高二上学期期中考试化学试题吉林省油田第十一中学2019-2020学年高二上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用甘肃省临夏中学2019-2020学年高二上学期期中考试化学(理)试题山西省祁县第二中学校2019-2020学年高二上学期期中考试化学试题山西省实验中学2020届高三化学复习针对性试题集(四)河南省开封市五县联考2019-2020学年高二上学期期末考试化学试题湖北省咸宁市崇阳一中2019-2020学年高二3月月考化学试题内蒙古自治区呼和浩特市土默特左旗第一中学2019-2020学年高一下学期期末考试化学试题河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题(已下线)1.3.1+盖斯定律-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)【南昌新东方】9.湾里一中 梁莎河南省南阳市第十中学2020-2021学年高二上学期第一次月考化学试题青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题江西宜春市第九中学2020-2021学年高二上学期第一次月考化学试题辽宁省营口市2020-2021学年高二上学期期末考试化学试题江西省抚州市崇仁第二中学2021-2022学年高二上学期第一次月考化学试题广东省深圳市宝安第一外国语学校2021-2022学年高二10月月考化学试题江西省南城第二中学2021-2022学年高二上学期第一次月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期第一次月考化学(理)试题广东省清远市第一中学2021-2022学年高二上学期期中调研考试化学试题山东省泰安肥城市2021-2022学年高二上学期期中考试化学试题山西省太原市第五十六中学2021-2022学年高二上学期10月月考化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题陕西省渭南市咸林中学2021-2022学年高二上学期第三阶段检测化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题陕西省渭南市富平县蓝光中学2021-2022学年高二上学期期末质量检测化学(理)试题山西省太原市第五十六中学2022-2023学年高二上学期10月联考化学试题广东省江门广雅中学2022-2023学年高二上学期期中考试化学试题新疆乌鲁木齐市第八中学2022-2023学年高二下学期第一次质量检测(开学摸底)化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题四川省华蓥中学2023-2024学年高二上学期9月月考化学试题山东省海阳第一中学2023-2024学年高一下学期3月份月考化学试题陕西省西安市周至县第四中学2023-2024学年高二上学期1月期末化学试题
3 . 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在钢基催化剂上的反应机理相能量图如下:
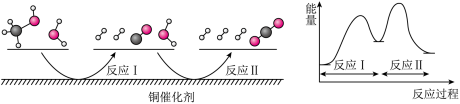
下列说法正确的是( )

下列说法正确的是( )
| A.反应II的热化学方程式为:CO(g)+H2O(g)→H2(g)+CO2(g) -Q kJ(Q>0) |
| B.1 mol CH3OH(g)和l mol H2O(g)的总能量大于l mol CO2(g)和3 mol H2(g)的总能量 |
| C.选择优良的催化剂降低反应I和II的活化能,有利于减少过程中的能耗 |
| D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂 |
您最近一年使用:0次
2020-10-23更新
|
513次组卷
|
22卷引用:北京市石景山区2020届高三第一次模拟化学试题
北京市石景山区2020届高三第一次模拟化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:热化学 电化学天津市红桥区2020届高三第二次模拟考试化学试题北京市北京师范大学燕化附属中学2019-2020 学年高二下学期期末考试化学试题北京市延庆区2019-2020学年高二下学期期末考试化学试题广州市天河中学2019—2020学年高二下学期期末测试化学试卷山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题上海市复旦大学附属中学2021届高三上学期第一次教学质量检测化学试题吉林省长春市第一五一中学2020-2021学年高二上学期第一次月考化学试题(希望班)江西省赣州市十五县市十六校2020-2021学年高二上学期期中联考化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)专题1.1.2 热化学方程式的书写(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)福建省武平县第一中学2021-2022学年高二上学期10月月考化学试题江西省赣州市2021-2022学高三上学期期末考试化学试题北京市日坛中学2021-2022学年高二上学期期中考试化学试题北京市西城区第一六一中学2022届高三考前热身测试化学试题(已下线)第15讲 化学反应的热效应 (练)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省武汉市青山区2021-2022学年高二上学期期末考试化学试题上海行知中学2022-2023学年高三上学期第一次月考化学试题广东省广州市玉岩中学2022-2023学年高二上学期10月月考化学试题河南省鹤壁市高中2022-2023学年高三上学期第三次模拟考试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题16-20)
4 . 已知热化学方程式:
①C(金刚石,s)+O2(g)=CO2(g) ΔH1
②C(石墨,s)+O2(g)=CO2(g) ΔH2
③C(石墨,s)=C(金刚石,s) ΔH3=+1.9kJ∙mol-1
下列说法正确的是( )
①C(金刚石,s)+O2(g)=CO2(g) ΔH1
②C(石墨,s)+O2(g)=CO2(g) ΔH2
③C(石墨,s)=C(金刚石,s) ΔH3=+1.9kJ∙mol-1
下列说法正确的是( )
| A.石墨转化成金刚石的反应是吸热反应 |
| B.金刚石比石墨稳定 |
| C.ΔH3=ΔH1-ΔH2 |
| D.ΔH1>ΔH2 |
您最近一年使用:0次
2020-10-16更新
|
425次组卷
|
23卷引用:2014-2015学年福建省清流一中高二上学期月考化学理试卷
2014-2015学年福建省清流一中高二上学期月考化学理试卷2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷2017届广西桂林市第十八中学高三上第二次月考化学试卷高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第二课时(反应热的计算)河南省郑州市第106中学2018-2019学年高二上学期第一次月考化学试题陕西省汉中中学2018-2019学年高二上学期期中考试化学试题河南省周口中英文学校2019-2020学年高二上学期第一次月考化学试题辽宁省建平第二高级中学2019-2020学年高二上学期9月月考化学试题天津市静海区大邱庄中学等四校2019-2020学年高二10联考化学试题陕西省渭南三贤中学2019-2020学年高二上学期期中考试化学试题云南省玉溪市江川区二中2019-2020学年高二上学期期末考试化学试题(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)陕西省西安市第七十五中学2019-2020学年高二第一次月考化学试题(已下线)湖南省邵东县第一中学2018-2019学年高二上学期第三次月考化学(理)试题陕西省咸阳百灵中学2020-2021学年高二上学期第一次月考化学试题黑龙江伊春林业管理局第二中学2021届高三上学期期中考试化学试题北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题新疆乌苏市第一中学2021-2022学年高二上学期10月月考化学试题(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练四川省南充市第一中学2021-2022学年高一下学期6月月考化学试题新疆石河子第二中学2021-2022学年高二上学期第二次月考化学试题福建省莆田第七中学2021-2022学年高二上学期期末考试化学试题第一章 第二节 反应热的计算
5 . 已知A、B、C、D、E、F是原子序数依次增大的六种短周期主族元素,A原子最外层电子数是次外层电子数的2倍,C是地壳中含量最多的元素,D是短周期原子半径最大的元素,E原子最外层电子数与C原子最外层电子数相等。回答下列问题:
(1)C元素在周期表中的位置是______________ 。
(2)从原子结构的角度解释最高价氧化物对应的水化物的酸性F的大于E的原因_______ 。
(3)E元素的低价氧化物与D元素的最高价氧化物对应的水化物反应生成的酸式盐,溶于水,溶液中所有离子由大到小的排列顺序是________ 。
(4)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO (g)=N2 (g) + O2 (g) △H=﹣180.5kJ•mol﹣1
2H2O (l)=2H2 (g) + O2 (g) △H= + 571.6kJ•mol﹣1
则H2 (g)与NO (g)反应生成N2 (g)和H2O (l)的热化学方程式是_________ 。
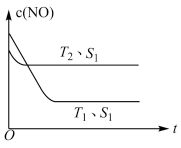
(5)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应2NO (g) + 2CO(g)⇌2CO2 (g) + N2 (g)中,NO的浓度c (NO)随温度 (T)、催化剂表面积 (S)和时间 (t)的变化曲线。该反应的△H____ 0 (填“>”或“<”)。
(6)实验室制取F的单质时,常含有少量HCl气体,可用_________ (试剂)除去HCl,请用平衡移动的原理解释原因:________ 。
(1)C元素在周期表中的位置是
(2)从原子结构的角度解释最高价氧化物对应的水化物的酸性F的大于E的原因
(3)E元素的低价氧化物与D元素的最高价氧化物对应的水化物反应生成的酸式盐,溶于水,溶液中所有离子由大到小的排列顺序是
(4)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO (g)=N2 (g) + O2 (g) △H=﹣180.5kJ•mol﹣1
2H2O (l)=2H2 (g) + O2 (g) △H= + 571.6kJ•mol﹣1
则H2 (g)与NO (g)反应生成N2 (g)和H2O (l)的热化学方程式是
(5)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应2NO (g) + 2CO(g)⇌2CO2 (g) + N2 (g)中,NO的浓度c (NO)随温度 (T)、催化剂表面积 (S)和时间 (t)的变化曲线。该反应的△H

(6)实验室制取F的单质时,常含有少量HCl气体,可用
您最近一年使用:0次
名校
6 . 环戊二烯是重要的有机化工原料,制备环戊烯涉及的反应如下:
ⅰ.解聚反应: ΔH>0
ΔH>0
ⅱ.氢化反应: ΔH=-100.5kJ·mol-1
ΔH=-100.5kJ·mol-1
ⅲ.副反应: ΔH=-109.4kJ·mol-1
ΔH=-109.4kJ·mol-1
(1)反应 的∆H=
的∆H=__ kJ·mol-1。
(2)解聚反应ⅰ在刚性容器中进行。
①其它条件不变时,有利于提高双环戊二烯平衡转化率的条件是__ ,__ 。
②实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为70kPa的双环戊二烯和水蒸气,达到平衡后总压为115kPa,双环戊二烯的转化率为90%,则体系中PH2O=__ kPa。
(3)研究环戊二烯氢化制备环戊烯在不同温度下催化剂的活性。下表是以Pd/Al2O3为催化剂,相同反应时间测得不同温度的数据(其它条件相同)。
说明:选择性= ×100%,收率=
×100%,收率= ×100%,
×100%,
常用收率来衡量催化剂的活性。
①最佳的反应温度为__ ,选择该温度的原因是__ 。
②表中实验数据表明,升高温度,环戊二烯转化率提高而环戊烯选择性降低,其原因是__ 。
ⅰ.解聚反应:
 ΔH>0
ΔH>0ⅱ.氢化反应:
 ΔH=-100.5kJ·mol-1
ΔH=-100.5kJ·mol-1ⅲ.副反应:
 ΔH=-109.4kJ·mol-1
ΔH=-109.4kJ·mol-1(1)反应
 的∆H=
的∆H=(2)解聚反应ⅰ在刚性容器中进行。
①其它条件不变时,有利于提高双环戊二烯平衡转化率的条件是
②实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为70kPa的双环戊二烯和水蒸气,达到平衡后总压为115kPa,双环戊二烯的转化率为90%,则体系中PH2O=
(3)研究环戊二烯氢化制备环戊烯在不同温度下催化剂的活性。下表是以Pd/Al2O3为催化剂,相同反应时间测得不同温度的数据(其它条件相同)。
| 温度/℃ | 25 | 30 | 35 | 40 | 45 |
| 环戊二烯转化率/% | 84.9 | 93.9 | 100.0 | 100.0 | 100.0 |
| 环戊烯选择性/% | 81.3 | 88.6 | 75.5 | 60.6 | 51.3 |
说明:选择性=
 ×100%,收率=
×100%,收率= ×100%,
×100%,常用收率来衡量催化剂的活性。
①最佳的反应温度为
②表中实验数据表明,升高温度,环戊二烯转化率提高而环戊烯选择性降低,其原因是
您最近一年使用:0次
2020-01-13更新
|
228次组卷
|
2卷引用:北京市石景山区2020届高三上学期期末考试化学试题
名校
解题方法
7 . 尿素[CO(NH2)2] 是首个由无机物合成的有机化合物,通常用作植物的氮肥。合成尿素的主要反应如下:
i. 2NH3(l) + CO2(g)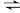
 (l)(氨基甲酸铵) △H=-a kJ/mol
(l)(氨基甲酸铵) △H=-a kJ/mol
ii. (l)
(l) 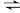
 (l) + H2O(l) △H=+b kJ/mol
(l) + H2O(l) △H=+b kJ/mol
iii. 2
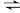
 (缩二脲)+NH3 (副反应,程度较小)
(缩二脲)+NH3 (副反应,程度较小)
(1)实验室制取氨气的化学方程式是__________________ 。
(2)CO(NH2)2中C为+4价,N的化合价_______ 。
(3)CO2和NH3合成尿素的热化学方程式为___________________________ 。
(4)工业上提高氨碳比( ),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因
),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因______ 。
(5)某科研小组模拟工业合成尿素,一定条件下,在0.5L的密闭容器中投入4molNH3和1molCO2,测得反应中各组分的物质的量随时间变化如图1所示:

①反应进行到10min时,用CO2表示反应i的速率υ(CO2)=________ 。
②合成总反应的快慢由慢的一步决定,则合成尿素的总反应的快慢由第______ 步反应决定(填“i”或“ii”)。
(6)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图2)。总反应为:CO(NH2)2+H2O 3H2↑+N2↑+CO2↑。
3H2↑+N2↑+CO2↑。
①A电极连接电源的_______ 极(填“正”或“负”)。
②A电极的电极反应为______ 。
i. 2NH3(l) + CO2(g)
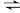
 (l)(氨基甲酸铵) △H=-a kJ/mol
(l)(氨基甲酸铵) △H=-a kJ/molii.
 (l)
(l) 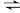
 (l) + H2O(l) △H=+b kJ/mol
(l) + H2O(l) △H=+b kJ/moliii. 2

 (缩二脲)+NH3 (副反应,程度较小)
(缩二脲)+NH3 (副反应,程度较小)(1)实验室制取氨气的化学方程式是
(2)CO(NH2)2中C为+4价,N的化合价
(3)CO2和NH3合成尿素的热化学方程式为
(4)工业上提高氨碳比(
 ),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因
),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因(5)某科研小组模拟工业合成尿素,一定条件下,在0.5L的密闭容器中投入4molNH3和1molCO2,测得反应中各组分的物质的量随时间变化如图1所示:

①反应进行到10min时,用CO2表示反应i的速率υ(CO2)=
②合成总反应的快慢由慢的一步决定,则合成尿素的总反应的快慢由第
(6)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图2)。总反应为:CO(NH2)2+H2O
 3H2↑+N2↑+CO2↑。
3H2↑+N2↑+CO2↑。①A电极连接电源的
②A电极的电极反应为
您最近一年使用:0次
2019-04-03更新
|
576次组卷
|
2卷引用:【区级联考】北京市石景山区2019届高三一模考试化学试题
名校
8 . 某废水中含有的NH 在一定条件下可被O2氧化,反应过程如下:
在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH = -273kJ/mol
②NO2-(aq)+1/2O2(g)=NO3-(aq) ΔH = -73kJ/mol
下列叙述不正确 的是
 在一定条件下可被O2氧化,反应过程如下:
在一定条件下可被O2氧化,反应过程如下:①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH = -273kJ/mol
②NO2-(aq)+1/2O2(g)=NO3-(aq) ΔH = -73kJ/mol
下列叙述
| A.1mol的NH3和1mol 的NH4+都有10×6.02×1023个电子 |
| B.室温下,0.1 mol/L HNO2溶液pH>1,则NaNO2溶液显碱性 |
| C.NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH= -346kJ/mol |
| D.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
您最近一年使用:0次
2017-06-02更新
|
628次组卷
|
3卷引用:北京市石景山区精华学校2019-2020学年高三上学期二次月考化学试题
名校
解题方法
9 . 氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
①分析数据可知:大气固氮反应属于_______ (填“吸热”或“放热”)反应。
②分析数据可知:现代工业生产不采用“大气固氮”原理的原因:_______ 。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因______________ 。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是____ (填“A”或“B”);比较P1、P2的大小关系_______ 。

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是__________ 。

(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),则其反应热△H=________ 。(已知:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)⇌2H2O(l) △H=-571.6kJ·mol-1)
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)⇌2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:现代工业生产不采用“大气固氮”原理的原因:
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是

(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),则其反应热△H=
您最近一年使用:0次
2016-12-09更新
|
686次组卷
|
5卷引用:2015届北京市石景山区高三一模理综化学试卷
2014·北京石景山·一模
10 . 氮氧化合物是大气污染的重要因素。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为__________ 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=________ kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为________ (填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是__________ (填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后, 溶液的碱性明显增强。则反应的离子方程式为:_____________ 。
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为:___________ (选填“A”或“B”),阴极反应式为:________________ 。
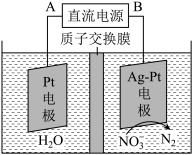
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为
NO2 + G
 N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。下列化合物中,满足上述反应式中的G是
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后, 溶液的碱性明显增强。则反应的离子方程式为:
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为:

您最近一年使用:0次



