已知A、B、C、D、E、F是原子序数依次增大的六种短周期主族元素,A原子最外层电子数是次外层电子数的2倍,C是地壳中含量最多的元素,D是短周期原子半径最大的元素,E原子最外层电子数与C原子最外层电子数相等。回答下列问题:
(1)C元素在周期表中的位置是______________ 。
(2)从原子结构的角度解释最高价氧化物对应的水化物的酸性F的大于E的原因_______ 。
(3)E元素的低价氧化物与D元素的最高价氧化物对应的水化物反应生成的酸式盐,溶于水,溶液中所有离子由大到小的排列顺序是________ 。
(4)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO (g)=N2 (g) + O2 (g) △H=﹣180.5kJ•mol﹣1
2H2O (l)=2H2 (g) + O2 (g) △H= + 571.6kJ•mol﹣1
则H2 (g)与NO (g)反应生成N2 (g)和H2O (l)的热化学方程式是_________ 。
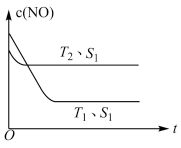
(5)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应2NO (g) + 2CO(g)⇌2CO2 (g) + N2 (g)中,NO的浓度c (NO)随温度 (T)、催化剂表面积 (S)和时间 (t)的变化曲线。该反应的△H____ 0 (填“>”或“<”)。
(6)实验室制取F的单质时,常含有少量HCl气体,可用_________ (试剂)除去HCl,请用平衡移动的原理解释原因:________ 。
(1)C元素在周期表中的位置是
(2)从原子结构的角度解释最高价氧化物对应的水化物的酸性F的大于E的原因
(3)E元素的低价氧化物与D元素的最高价氧化物对应的水化物反应生成的酸式盐,溶于水,溶液中所有离子由大到小的排列顺序是
(4)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO (g)=N2 (g) + O2 (g) △H=﹣180.5kJ•mol﹣1
2H2O (l)=2H2 (g) + O2 (g) △H= + 571.6kJ•mol﹣1
则H2 (g)与NO (g)反应生成N2 (g)和H2O (l)的热化学方程式是
(5)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应2NO (g) + 2CO(g)⇌2CO2 (g) + N2 (g)中,NO的浓度c (NO)随温度 (T)、催化剂表面积 (S)和时间 (t)的变化曲线。该反应的△H

(6)实验室制取F的单质时,常含有少量HCl气体,可用
更新时间:2020-02-22 09:39:10
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是一个重要研究方向, 既可变废为宝,又可减少碳的排放。工业上可用CO2和H2制备被誉为“21世纪的清洁燃料”二甲醚(CH3OCH3):
如在500℃时,在密闭容器中将炼焦中的CO2转化为二甲醚,其相关反应为:
主反应I:2CO2 (g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH1
CH3OCH3(g)+3H2O(g) ΔH1
副反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
(1)已知:①CO(g)+2H2(g) CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) H= -41.0kJ/mol
CO2(g)+H2(g) H= -41.0kJ/mol
则主反应I的ΔH1=______ 。
(2)在一定温度下某密闭容器中按CO2和H2的浓度比为1∶3投料进行反应,测得不同时间段部分物质的浓度如下表:
①10-20min内,CH3OCH3的平均反应速率v(CH3OCH3)=_______ 。
②根据以上数据计算主反应I的平衡常数K=______ (列式,代入数据,不计算结果)。
(3)欲提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是_______ 。
(4)对于反应II,温度对CO2的转化率及催化剂的效率影响如图所示:下列有关说法不正确的是_______ 。
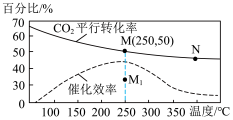
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于Ml
B.温度低于250°C时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化
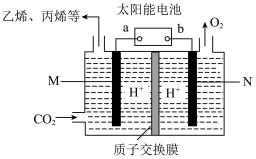
(5)利用太阳能电池将CO2转化为乙烯、丙烯等有机化工原料,其工作原理如图所示。则a为太阳能电池的_______ 极,写M极上生成丙烯的电极反应式为_________ 。
如在500℃时,在密闭容器中将炼焦中的CO2转化为二甲醚,其相关反应为:
主反应I:2CO2 (g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH1
CH3OCH3(g)+3H2O(g) ΔH1副反应II:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2(1)已知:①CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) H= -41.0kJ/mol
CO2(g)+H2(g) H= -41.0kJ/mol则主反应I的ΔH1=
(2)在一定温度下某密闭容器中按CO2和H2的浓度比为1∶3投料进行反应,测得不同时间段部分物质的浓度如下表:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| H2 | 1.00mol/L | 0.68 mol/L | 0.40 mol/L | 0.30 mol/L | 0.30 mol/L |
| CH3OCH3 | 0 mol/L | 0.05 mol/L | 0.08 mol/L | 0.10 mol/L | 0.10 mol/L |
①10-20min内,CH3OCH3的平均反应速率v(CH3OCH3)=
②根据以上数据计算主反应I的平衡常数K=
(3)欲提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是
(4)对于反应II,温度对CO2的转化率及催化剂的效率影响如图所示:下列有关说法不正确的是

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于Ml
B.温度低于250°C时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化
(5)利用太阳能电池将CO2转化为乙烯、丙烯等有机化工原料,其工作原理如图所示。则a为太阳能电池的

您最近一年使用:0次
【推荐2】工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g) CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5kJ/mol、285.5 kJ/mol、283.0kJ/mol,则x=__ 。
(2)TK下,在容积为1.00L的某密闭容器中进行上述反应相关数据如图一。
①该化学反应0-10min的平均速率v(H2)=___ 。
②10min时容器内CO的体积分数为___ 。
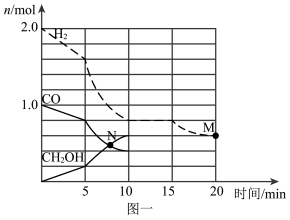
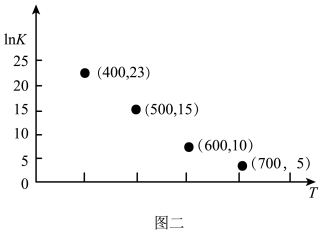
③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK下三种气体的平衡气体总压强为xMPa,则该反应Kp=__ (计算表达式表示)。实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图二,请分析lnK随T呈现上述变化趋势的原因是__ 。
(3)干燥的甲醇可用于制造燃料电池。
某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C和O2。其阳极电极反应式为__ 。
 CH3OH(l) △H=x。
CH3OH(l) △H=x。(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5kJ/mol、285.5 kJ/mol、283.0kJ/mol,则x=
(2)TK下,在容积为1.00L的某密闭容器中进行上述反应相关数据如图一。
①该化学反应0-10min的平均速率v(H2)=
②10min时容器内CO的体积分数为

③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK下三种气体的平衡气体总压强为xMPa,则该反应Kp=

(3)干燥的甲醇可用于制造燃料电池。
某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C和O2。其阳极电极反应式为
您最近一年使用:0次
【推荐3】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。减少CO2排放是一项重要课题。
(1)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料,用甲醇、CO、CO2在常压、70~120℃和催化剂条件下合成DMC。
已知:①CO的燃烧热为△H =﹣283.0 kJ·mol-1
②H2O(l)= H2O(g) △H = + 44.0 kJ·mol-1
③2CH3OH(g)+CO2(g) CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+1/2O2(g) CH3OCOOCH3 (g)+ H2O(l) △H =
CH3OCOOCH3 (g)+ H2O(l) △H =_______________ 。
(2)在密闭容器中按n(CH3OH):n(CO2)=2:1投料直接合成DMC,一定条件下,平衡时CO2的转化率如图1所示,则:
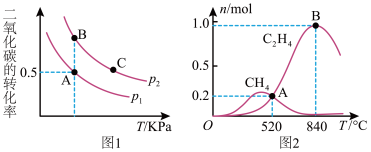
①v(A)、v(B)、v(C)由快到慢的顺序为____________________ ;
②K(A)、K(B)、K(C)由大到小的顺序为___________________ ;
③下列能说明在此条件下反应达到平衡状态的是__________ 。
A.2v正(CH3OH)= v逆(CO2) B.CH3OH与CO2的物质的量之比保持不变
C.容器内气体的密度保持不变 D.各组分的物质的量分数保持不变
(3)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
为分析催化剂对反应的选择性,在1 L密闭容器中充入1 molCO2和2 mol H2,测得有关物质的物质的量随温度变化如图2所示。
该催化剂在较低温度时主要选择________ (填“反应Ⅰ”或“反应II”)。520℃时,反应II的平衡常数K=___________ (只列算式不计算)。
(1)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料,用甲醇、CO、CO2在常压、70~120℃和催化剂条件下合成DMC。
已知:①CO的燃烧热为△H =﹣283.0 kJ·mol-1
②H2O(l)= H2O(g) △H = + 44.0 kJ·mol-1
③2CH3OH(g)+CO2(g)
 CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1则2CH3OH(g)+CO(g)+1/2O2(g)
 CH3OCOOCH3 (g)+ H2O(l) △H =
CH3OCOOCH3 (g)+ H2O(l) △H =(2)在密闭容器中按n(CH3OH):n(CO2)=2:1投料直接合成DMC,一定条件下,平衡时CO2的转化率如图1所示,则:

①v(A)、v(B)、v(C)由快到慢的顺序为
②K(A)、K(B)、K(C)由大到小的顺序为
③下列能说明在此条件下反应达到平衡状态的是
A.2v正(CH3OH)= v逆(CO2) B.CH3OH与CO2的物质的量之比保持不变
C.容器内气体的密度保持不变 D.各组分的物质的量分数保持不变
(3)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)反应II:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)为分析催化剂对反应的选择性,在1 L密闭容器中充入1 molCO2和2 mol H2,测得有关物质的物质的量随温度变化如图2所示。
该催化剂在较低温度时主要选择
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】以CO、 为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.

回答下列问题:
(1)已知某反应的平衡常数表达式为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为__________ 。
(2)向一容积为2L的恒容密闭容器中通入1mol 和3mol
和3mol ,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得
,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时总压为________ Pa。
②0~20min内,用 表示的平均反应速率
表示的平均反应速率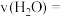
________  ,
, 的平衡浓度
的平衡浓度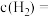
________ 
(3)在一定条件下发生反应Ⅰ、Ⅲ( 过量),若反应Ⅰ中
过量),若反应Ⅰ中 的转化率为90%,Ⅲ中
的转化率为90%,Ⅲ中 的转化率为40%,则
的转化率为40%,则 的产率为
的产率为________ .
(4)工业上,以一定比例混合的 与
与 的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ.
的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ. 转化率与温度的关系如图1所示.在催化剂b作用下,温度高于
转化率与温度的关系如图1所示.在催化剂b作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是__________ 。 分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中
分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中 的体积分数(
的体积分数( )如图2所示。
)如图2所示。 、
、 和
和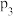 由大到小的顺序是
由大到小的顺序是________ 。
②若在250℃、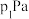 的条件下,反应达到平衡,则该反应的平衡常数
的条件下,反应达到平衡,则该反应的平衡常数
________ 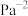 (分压
(分压 总压
总压 物质的量分数)。
物质的量分数)。
 为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:Ⅰ.


Ⅱ.


Ⅲ.


Ⅳ.


回答下列问题:
(1)已知某反应的平衡常数表达式为
 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)向一容积为2L的恒容密闭容器中通入1mol
 和3mol
和3mol ,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得
,一定温度下发生反应Ⅰ.起始总压为pPa,20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时总压为
②0~20min内,用
 表示的平均反应速率
表示的平均反应速率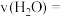
 ,
, 的平衡浓度
的平衡浓度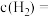

(3)在一定条件下发生反应Ⅰ、Ⅲ(
 过量),若反应Ⅰ中
过量),若反应Ⅰ中 的转化率为90%,Ⅲ中
的转化率为90%,Ⅲ中 的转化率为40%,则
的转化率为40%,则 的产率为
的产率为(4)工业上,以一定比例混合的
 与
与 的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ.
的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ. 转化率与温度的关系如图1所示.在催化剂b作用下,温度高于
转化率与温度的关系如图1所示.在催化剂b作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是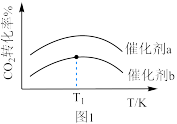
 分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中
分别为1mol、2mol时,发生反应Ⅳ,平衡后混合物中 的体积分数(
的体积分数( )如图2所示。
)如图2所示。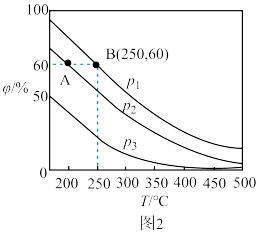
 、
、 和
和 由大到小的顺序是
由大到小的顺序是②若在250℃、
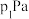 的条件下,反应达到平衡,则该反应的平衡常数
的条件下,反应达到平衡,则该反应的平衡常数
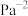 (分压
(分压 总压
总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】 的捕集和利用具有重要意义。
的捕集和利用具有重要意义。
 .
. 的催化氧化
的催化氧化
(1) 在
在 表面催化氧化的过程始于
表面催化氧化的过程始于 与
与 形成的酸性位点(如图所示),并生成金属硫酸盐(
形成的酸性位点(如图所示),并生成金属硫酸盐(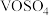 )中间体。
)中间体。___________ 。
②写出中间体受热分解产生 、
、 的化学方程式:
的化学方程式:___________ 。
(2)一定温度下,恒压密闭容器中发生反应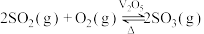
 ,
, 平衡转化率与反应温度和压强的关系如图所示。
平衡转化率与反应温度和压强的关系如图所示。
___________ (填“=0”或“>0”或“<0”)。
②实际生产中选择图中C点的反应条件,不选择A、B点的理由分别是___________ 。
 .
. 的催化还原
的催化还原
(3) 催化剂能催化CO还原
催化剂能催化CO还原 ,反应为
,反应为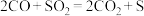 。将
。将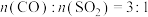 的混合气体(载气为
的混合气体(载气为 )匀速通过装有
)匀速通过装有 催化剂的反应器,测得催化剂活化(催化剂在活化过程中一般经历反应物的吸附、脱附和催化活化等阶段)前后的X-射线衍射图如下图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同,峰越强,物质含量越多)。
催化剂的反应器,测得催化剂活化(催化剂在活化过程中一般经历反应物的吸附、脱附和催化活化等阶段)前后的X-射线衍射图如下图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同,峰越强,物质含量越多)。___________ (填化学式)。
②谱峰4在活化前后也发生了一定变化,即部分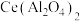 转变为
转变为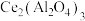 ,写出对应的化学反应方程式:
,写出对应的化学反应方程式:___________ 。
③实验中反应物的配比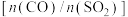 设定为3∶1而不是2∶1的可能原因是
设定为3∶1而不是2∶1的可能原因是___________ 。
 的捕集和利用具有重要意义。
的捕集和利用具有重要意义。 .
. 的催化氧化
的催化氧化(1)
 在
在 表面催化氧化的过程始于
表面催化氧化的过程始于 与
与 形成的酸性位点(如图所示),并生成金属硫酸盐(
形成的酸性位点(如图所示),并生成金属硫酸盐(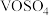 )中间体。
)中间体。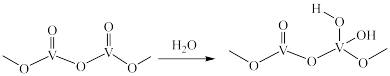
②写出中间体受热分解产生
 、
、 的化学方程式:
的化学方程式:(2)一定温度下,恒压密闭容器中发生反应
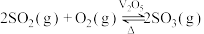
 ,
, 平衡转化率与反应温度和压强的关系如图所示。
平衡转化率与反应温度和压强的关系如图所示。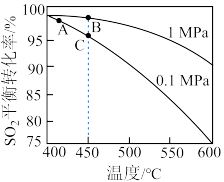

②实际生产中选择图中C点的反应条件,不选择A、B点的理由分别是
 .
. 的催化还原
的催化还原(3)
 催化剂能催化CO还原
催化剂能催化CO还原 ,反应为
,反应为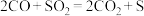 。将
。将 的混合气体(载气为
的混合气体(载气为 )匀速通过装有
)匀速通过装有 催化剂的反应器,测得催化剂活化(催化剂在活化过程中一般经历反应物的吸附、脱附和催化活化等阶段)前后的X-射线衍射图如下图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同,峰越强,物质含量越多)。
催化剂的反应器,测得催化剂活化(催化剂在活化过程中一般经历反应物的吸附、脱附和催化活化等阶段)前后的X-射线衍射图如下图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同,峰越强,物质含量越多)。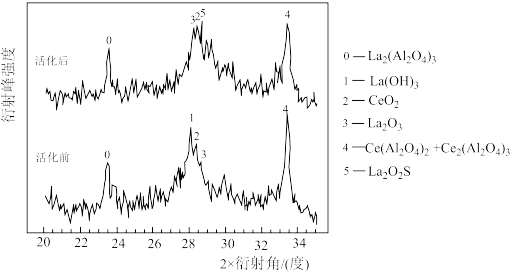
②谱峰4在活化前后也发生了一定变化,即部分
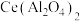 转变为
转变为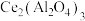 ,写出对应的化学反应方程式:
,写出对应的化学反应方程式:③实验中反应物的配比
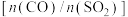 设定为3∶1而不是2∶1的可能原因是
设定为3∶1而不是2∶1的可能原因是
您最近一年使用:0次
【推荐3】【加试题】二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2
的成功范例。在尿素合成塔中的主要反应可表示如下:
反应 I:2NH3(g)+CO2(g) NH2COONH4(s)ΔH1=-159.47 kJ·mol-1
NH2COONH4(s)ΔH1=-159.47 kJ·mol-1
反应II:NH2COONH4(s) CO(NH2)2(s)+H2O(g)ΔH2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g)ΔH2=+72.49kJ·mol-1
请回答下列问题:
(l)写出CO2和NH3为原料生成尿素和气态水的热化学反应方程式_______ ,反应II自发进行的条件是_____ 。
(2)CO2和NH3为原料合成尿素的反应中影响CO2转化率的因素很多,下图为某待定条件下,不同水碳比[n(H2O)/n(CO2)]和温度影响CO2转化率变化的趋势曲线。

下列说法不正确的是__________ 。
A.温度升高该反应平衡常数逐渐减小,移走部分尿素平衡向正方向移动
B.当温度低于190℃,随温度升高CO2转化率逐渐增大,其原因可能是温度升高平衡向正方向移动
C.当温度高于190℃后,随温度升高CO2转化率逐渐减小,其原因可能是温度升高发生了副反应
D.其他条件相同时,为提高CO2的转化率,生产中可以采取的措施是提高水碳比
(3)某研究小组为探究反应I中影响C(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡,其c(CO2)随时间t变化趋势曲线如下图所示。则其逆反应的平衡常数为_____ 。若其他条件不变,t1时将容器体积压缩到1L,请画出t1〜t2时间段C(CO2)随时间t变化趋势曲线(t2时达到新的平衡)。__________
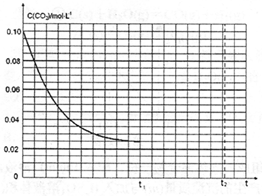
(4)电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下图,请写出在A电极上发生的电极反应式_____ 。

的成功范例。在尿素合成塔中的主要反应可表示如下:
反应 I:2NH3(g)+CO2(g)
 NH2COONH4(s)ΔH1=-159.47 kJ·mol-1
NH2COONH4(s)ΔH1=-159.47 kJ·mol-1反应II:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g)ΔH2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g)ΔH2=+72.49kJ·mol-1请回答下列问题:
(l)写出CO2和NH3为原料生成尿素和气态水的热化学反应方程式
(2)CO2和NH3为原料合成尿素的反应中影响CO2转化率的因素很多,下图为某待定条件下,不同水碳比[n(H2O)/n(CO2)]和温度影响CO2转化率变化的趋势曲线。

下列说法不正确的是
A.温度升高该反应平衡常数逐渐减小,移走部分尿素平衡向正方向移动
B.当温度低于190℃,随温度升高CO2转化率逐渐增大,其原因可能是温度升高平衡向正方向移动
C.当温度高于190℃后,随温度升高CO2转化率逐渐减小,其原因可能是温度升高发生了副反应
D.其他条件相同时,为提高CO2的转化率,生产中可以采取的措施是提高水碳比
(3)某研究小组为探究反应I中影响C(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡,其c(CO2)随时间t变化趋势曲线如下图所示。则其逆反应的平衡常数为

(4)电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下图,请写出在A电极上发生的电极反应式

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】I.工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,反应为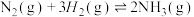
 ,
,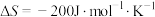 。请回答下列问题:
。请回答下列问题:
(1)常温下,合成氨反应________ (填“能”或“不能”)自发进行,其平衡常数表达式K=________ 。
(2)________ 温(填“高”或“低”)有利于提高反应速率,________ 温(填“高”或“低”)有利于提高平衡转化率,综合考虑催化剂活性等因素,工业常采用400∼500℃。
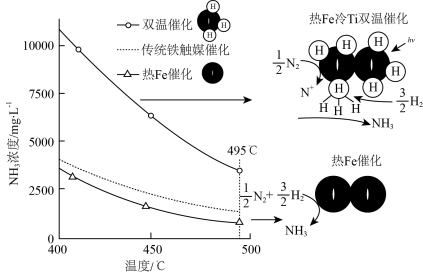
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2·xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2·xHy的温度为415℃)。(纵坐标为反应达平衡时NH3的浓度)________________ 。
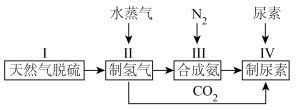
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下: ,
, ,恒容容器中,对于以上反应,能加快反应速率的是
,恒容容器中,对于以上反应,能加快反应速率的是________ 。
A.升高温度 B.充入He C.加入催化剂
(5)已知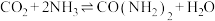 ,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成
,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成________ 吨尿素。
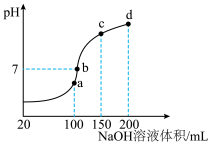
Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:________ ;
(7)在b点,溶液中各离子浓度由大到小的排列顺序是________ ;
(8)在cd段发生反应的离子方程式为________ 。
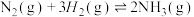
 ,
,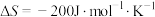 。请回答下列问题:
。请回答下列问题:(1)常温下,合成氨反应
(2)
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2·xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2·xHy的温度为415℃)。(纵坐标为反应达平衡时NH3的浓度)
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:
 ,
, ,恒容容器中,对于以上反应,能加快反应速率的是
,恒容容器中,对于以上反应,能加快反应速率的是A.升高温度 B.充入He C.加入催化剂
(5)已知
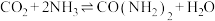 ,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成
,整个合成尿素的流程中,甲烷的利用率为80%,100吨甲烷为原料能够合成Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
(7)在b点,溶液中各离子浓度由大到小的排列顺序是
(8)在cd段发生反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①溶液中粒子种类:Na2CO3溶液_____ NaHCO3溶液(填“>”、“<”或“=”)。
②已知25℃时CO32-第一步水解的平衡常数K1=2×10-4mol/L.溶液中c(HCO3-):c(CO32-)=20:1时,溶液的pH=______ 。
③泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________ 。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得IL溶液A,溶液B为0.1mol/LCH3COONa溶液,则两份溶液中c(NO3-)、c( NO2-)和c(CH3COO-)由小到大的顺序为___________ (已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是_____ (填字母序号)。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
(3) SO2会引起酸雨,可利用氢氧化钠溶液吸收,吸收SO2的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下表:
①上表判断NaHSO3溶液显_______ 性,用化学平衡原理解释:______________ 。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____
a. c(Na+)=2c(SO32-) +c(HSO3-)
b. c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.(Na+)+c(H+)=c(SO32-)+c(HSO3-) +c(OH-)
③当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
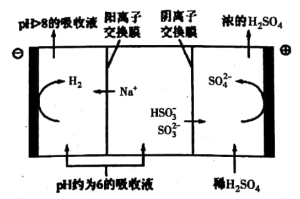
HSO3-在阳极放电的电极反应式是__________________ 。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①溶液中粒子种类:Na2CO3溶液
②已知25℃时CO32-第一步水解的平衡常数K1=2×10-4mol/L.溶液中c(HCO3-):c(CO32-)=20:1时,溶液的pH=
③泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得IL溶液A,溶液B为0.1mol/LCH3COONa溶液,则两份溶液中c(NO3-)、c( NO2-)和c(CH3COO-)由小到大的顺序为
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
(3) SO2会引起酸雨,可利用氢氧化钠溶液吸收,吸收SO2的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a. c(Na+)=2c(SO32-) +c(HSO3-)
b. c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.(Na+)+c(H+)=c(SO32-)+c(HSO3-) +c(OH-)
③当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:

HSO3-在阳极放电的电极反应式是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】为探索某工厂的废金属屑(主要成分为Fe、Cu、Al、Al2O3等)的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体( )和水处理剂高铁酸钾(K2FeO4)。
)和水处理剂高铁酸钾(K2FeO4)。
(1)试剂X可以是___________。(填编号)
(2)试剂Y可以是___________。
(3)关于溶液D的说法正确的是___________。
(4)从CuSO4溶液中获取胆矾晶体的操作是___________ 、___________ 过滤、洗涤。
(5)从AlCl3溶液得到氯化铝固体时要加入适量的盐酸,结合化学用语解释原因___________ 。
(6)在步骤Ⅱ时,小组成员用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是___________ 。 对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和
对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和 的质量浓度)为___________。
的质量浓度)为___________。
(8)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为___________ 。
(9)高铁酸钾(K2FeO4)是一种环保、高效的水处理剂,它能氧化杀菌并能吸附水中悬浮的杂质,有关说法不正确的是___________。
(10)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体20.0g,该废料中铜的质量分数约为___________ 。
 )和水处理剂高铁酸钾(K2FeO4)。
)和水处理剂高铁酸钾(K2FeO4)。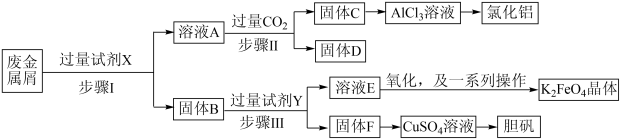
(1)试剂X可以是___________。(填编号)
| A.氨水 | B.氢氧化钠溶液 | C.盐酸 | D.硫酸 |
(2)试剂Y可以是___________。
| A.氨水 | B.氢氧化钠溶液 | C.盐酸 | D.硫酸 |
(3)关于溶液D的说法正确的是___________。
| A.含有碳酸氢钠溶质 |
| B.一定显碱性 |
C.存在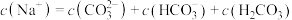 |
D.存在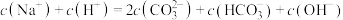 |
(4)从CuSO4溶液中获取胆矾晶体的操作是
(5)从AlCl3溶液得到氯化铝固体时要加入适量的盐酸,结合化学用语解释原因
(6)在步骤Ⅱ时,小组成员用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是
 对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和
对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和 的质量浓度)为___________。
的质量浓度)为___________。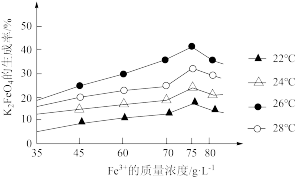
A.22℃, | B.24℃, |
C.26℃, | D.28℃, |
(8)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为
(9)高铁酸钾(K2FeO4)是一种环保、高效的水处理剂,它能氧化杀菌并能吸附水中悬浮的杂质,有关说法不正确的是___________。
| A.高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降 |
| B.高铁酸钾中含有离子键、极性共价键 |
C.1mol高铁酸钾生成胶粒数等于 |
| D.高铁酸钾中铁元素为+6价 |
(10)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体20.0g,该废料中铜的质量分数约为
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐1】已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有_______ 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为_________ ,E的基态电子排布式为________ ,E3+与E2+的稳定性大小为____________ 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为__________ ,电负性由小到大的顺序为_________ 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的σ键和π键的数目之比为__________ ;F、G对应的氢化物中键能大小为F—H键_________ G—H键。
(4)等浓度、等体积的盐酸和氢氧化钠溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为_________ ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为____________ 。
(5)由A、C、F可形成两种酸类化合物,用离子方程式说明它们的酸性强弱________ 。由A、C、F与钠四种元素按原子个数比为1∶3∶1∶1组成一种化合物,其水溶液显酸性,则该溶液中各种离子的浓度由大到小的顺序为________ ,向该溶液中滴入少量的氢氧化钡溶液时发生反应的离子方程式为___________ 。
(1)A、B、C形成的此化合物中存在的化学键的类型有
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的σ键和π键的数目之比为
(4)等浓度、等体积的盐酸和氢氧化钠溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为
(5)由A、C、F可形成两种酸类化合物,用离子方程式说明它们的酸性强弱
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】M、Q、R、X、Y、Z是前36号元素,它们的原子序数依次增大,其中M、R原子的3p轨道都有2个未成对电子,X、Y和Z原子的最外层都只有1个电子。回答下列问题:
(1)Y元素的基态原子价层电子排布式为_______ 。
(2)在周期表的五个分区中,Z在_______ 区,其正一价离子的电子排布式是_______ 。
(3)M、Q、R的电负性由小到大的顺序为_______ (用元素符号表示)
(4)氮化镓(GaN)是新型的半导体材料。基态Ga原子的价层电子排布图为_______ ;
(5)第四周期内层电子全排满,最外层只有两个电子的元素是_______ 它在周期表上的位置为_______ 。
(1)Y元素的基态原子价层电子排布式为
(2)在周期表的五个分区中,Z在
(3)M、Q、R的电负性由小到大的顺序为
(4)氮化镓(GaN)是新型的半导体材料。基态Ga原子的价层电子排布图为
(5)第四周期内层电子全排满,最外层只有两个电子的元素是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】X、Y、Z、W、M、R是原子半径依次增大的前四周期元素,X只有1个s轨道且含有单电子;Y电负性最大;Z和M同主族且Z的p轨道半充满,W和Y同主族;R的d轨道上有两个单电子且价电子数为10.回答下列问题:
(1)基态R原子价电子排布式为___________ ,同周期中未成对电子数与R相同的元素有___________ 种。
(2) 中心原子的杂化方式为
中心原子的杂化方式为___________ , 中心原子的杂化方式为
中心原子的杂化方式为___________ ,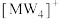 的空间结构为
的空间结构为___________ 。
(3)键角:
___________  (填“>”或“<”,下同),沸点:
(填“>”或“<”,下同),沸点:
___________  。
。
(4)Y的气态氢化物水溶液中存在___________ 种氢键。
(5)向含1mol八面体的配合物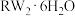 中加足量
中加足量 溶液,无白色沉淀产生,则该配合物内界的化学式为
溶液,无白色沉淀产生,则该配合物内界的化学式为___________ 。
(1)基态R原子价电子排布式为
(2)
 中心原子的杂化方式为
中心原子的杂化方式为 中心原子的杂化方式为
中心原子的杂化方式为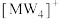 的空间结构为
的空间结构为(3)键角:

 (填“>”或“<”,下同),沸点:
(填“>”或“<”,下同),沸点:
 。
。(4)Y的气态氢化物水溶液中存在
(5)向含1mol八面体的配合物
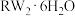 中加足量
中加足量 溶液,无白色沉淀产生,则该配合物内界的化学式为
溶液,无白色沉淀产生,则该配合物内界的化学式为
您最近一年使用:0次



