名校
解题方法
1 . (1)写出COS的电子式__________________ ,C与O形成共价键时,共用电子对会偏向__________ 原子,判断依据是___________ 。
(2)已知COS(g)+H2O(g) H2S(g)+CO2(g) △H1=-34kJ/mol
H2S(g)+CO2(g) △H1=-34kJ/mol
CO(g)+H2O(g) H2(g)+CO2(g) △H2=-41kJ/mol
H2(g)+CO2(g) △H2=-41kJ/mol
写出H2S与CO反应生成COS的热化学方程式__________________________________ 。
100℃时将CO与H2S按物质的量比为1∶1充入反应器中,达平衡后CO的转化率α=33.3%,此时反应的平衡常数k=________________________ 。
(3)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。
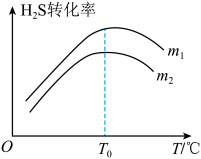
①m1________ m2(填>、<或=)
②温度高于T0时,H2S转化率减小的可能原因为_________
a.反应停止了 b.反应的△H变大
c.反应达到平衡 d.催化剂活性降低
(2)已知COS(g)+H2O(g)
 H2S(g)+CO2(g) △H1=-34kJ/mol
H2S(g)+CO2(g) △H1=-34kJ/molCO(g)+H2O(g)
 H2(g)+CO2(g) △H2=-41kJ/mol
H2(g)+CO2(g) △H2=-41kJ/mol 写出H2S与CO反应生成COS的热化学方程式
100℃时将CO与H2S按物质的量比为1∶1充入反应器中,达平衡后CO的转化率α=33.3%,此时反应的平衡常数k=
(3)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。

①m1
②温度高于T0时,H2S转化率减小的可能原因为
a.反应停止了 b.反应的△H变大
c.反应达到平衡 d.催化剂活性降低
您最近一年使用:0次
2020-03-28更新
|
804次组卷
|
2卷引用:北京市平谷区2020届高三第一次模拟考试化学试题
2 . 下图是碳的正常循环,但由于过度燃烧化石燃料,造成二氧化碳浓度不断上升。研究和解决二氧化碳捕集、存储和转化问题成为当前化学工作者的重要使命。
(1)有关碳循环的说法中正确的是________
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:
2CO2(g) = 2CO(g)+O2(g),该反应的△H___ 0,(选填:>、<、=)。
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质。
2H2O(l) = 2H2(g) + O2(g) △H= + 571.5 kJ·mol-1
3H2(g) + CO2(g) = CH3OH(l) + H2O(l) △H= —137.8 kJ·mol-1
则反应:4H2O(l)+ 2CO2(g) = 2CH3OH(l)+3O2(g) △H=_______ kJ·mol-1。
你认为该方法需要解决的技术问题有:____ 。
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化。
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s) 2NH3(g) + CO2(g)。实验测得的有关数据见下表。( t1<t2<t3)
2NH3(g) + CO2(g)。实验测得的有关数据见下表。( t1<t2<t3)
氨基甲酸铵分解反应是_______ 反应( “放热”、“吸热”)。在15℃,此反应的化学平衡常数为:_____ 。
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图)。在阴极上产生乙烯的电极反应方程式为:___________________________ 。


(1)有关碳循环的说法中正确的是
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:
2CO2(g) = 2CO(g)+O2(g),该反应的△H
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质。
2H2O(l) = 2H2(g) + O2(g) △H= + 571.5 kJ·mol-1
3H2(g) + CO2(g) = CH3OH(l) + H2O(l) △H= —137.8 kJ·mol-1
则反应:4H2O(l)+ 2CO2(g) = 2CH3OH(l)+3O2(g) △H=
你认为该方法需要解决的技术问题有:
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化。
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)
 2NH3(g) + CO2(g)。实验测得的有关数据见下表。( t1<t2<t3)
2NH3(g) + CO2(g)。实验测得的有关数据见下表。( t1<t2<t3)  温度(℃) 温度(℃)气体总浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9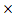 10-3 10-3 | 2.7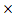 10-2 10-2 | 8.1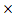 10-2 10-2 |
| t2 | 3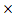 10-2 10-2 | 4.8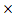 10-2 10-2 | 9.4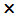 10-2 10-2 |
| t3 | 3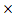 10-2 10-2 | 4.8 10-2 10-2 | 9.4 10-2 10-2 |
氨基甲酸铵分解反应是
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图)。在阴极上产生乙烯的电极反应方程式为:

您最近一年使用:0次
2016-12-09更新
|
347次组卷
|
2卷引用:2016届北京市平谷区高三第一次统练理综化学试卷
3 . 人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g) 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g) 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。
(1)上述反应的平衡常数表达式为_______________。
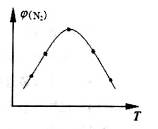
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
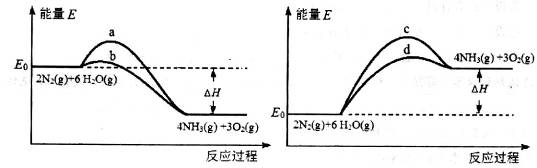
(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(选填字母代号),图中△H的绝对值为1530kJ·mol-1。
III.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。
回答下列问题:
(1)结合II中的数据,则O2(g)+2H2(g)=2H2O(g)的△H=______________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率α1=______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)=_____________mol。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g)
 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g)
 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数
 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(选填字母代号),图中△H的绝对值为1530kJ·mol-1。

III.目前工业合成氨的原理是:N2(g)+3H2(g)
 2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。回答下列问题:
(1)结合II中的数据,则O2(g)+2H2(g)=2H2O(g)的△H=______________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率α1=______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)=_____________mol。
您最近一年使用:0次



