1 . 已知: 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式:
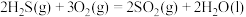
 ①
①

 ②
②

 ③
③
 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是
 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式: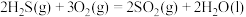
 ①
①
 ②
②
 ③
③ 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是A.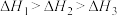 | B.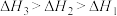 |
C.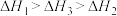 | D.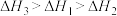 |
您最近一年使用:0次
2023-12-03更新
|
460次组卷
|
24卷引用:贵州省部分学校2022-2023学年高二上学期10月联考化学试题
贵州省部分学校2022-2023学年高二上学期10月联考化学试题贵州省“三新”改革联盟校联考2022-2023学年高二上学期期中考试化学试题广西钦州市2021-2022学年高二上学期期末考试化学试题第二节 反应热的计算 第2课时 反应热的计算河南省濮阳市元龙高级中学2021-2022学年高二上学期期中考试化学试题湖南省怀化市雅礼实验学校2022-2023学年高二上学期第一次月考化学试题江西省上饶县中学2017-2018学年高二上学期补考化学试题重庆市第三十中学2018-2019学年高二上学期第三次月考化学试题甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题江苏省淮安市涟水县第一中学2020届高三上学期第二次月考化学试题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)山西省怀仁市2021-2022学年高二上学期期中化学试题甘肃省甘南藏族自治州合作第一中学2021-2022学年高二上学期期中考试化学试题(理)陕西省咸阳市实验中学2021-2022学年高二上学期第三次月考化学试题河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题章末检测卷(一) 化学反应的热效应广东省广州市执信中学2023-2024学年高二上学期10月选考化学试题安徽省无为襄安中学2022-2023学年高二下学期开学考试化学试题山东省聊城市2023-2024学年高二上学期11月期中考试化学试题天津市南开区2023-2024学年高二上学期11月期中考试化学试题陕西省咸阳市兴平市西郊高级中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)江西省抚州市资溪县第一中学2023-2024学年高二上学期11月期中化学试题安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题
名校
2 . 回答下列问题
(1)甲醇是一种可再生能源,由 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:
反应Ⅰ: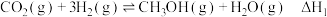
反应Ⅱ: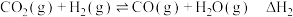
反应Ⅲ: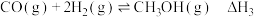
反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为 ,则
,则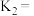
___________ (用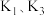 表示)。
表示)。
(2)某探究小组用 与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用
与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用 浓度为
浓度为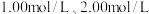 ,大理石有细颗粒和粗颗粒两种规格,实验温度为
,大理石有细颗粒和粗颗粒两种规格,实验温度为 、
、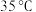 ,每次实验
,每次实验 的用量为
的用量为 ,大理石用量为
,大理石用量为 。
。
请完成实验设计表,其中a为___________ ,e为___________ 。
(3)①氯气是制备系列含氯化合物的主要原料,可采用如图A所示的装置来制取氯气。装置中的离子膜只允许___________ (填“ ”或“
”或“ ”)通过,氯气的逸出口是
”)通过,氯气的逸出口是___________ (填标号“ ”或“b”)。
”或“b”)。

② 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为___________ 。

(1)甲醇是一种可再生能源,由
 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:反应Ⅰ:
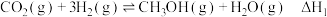
反应Ⅱ:
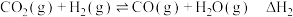
反应Ⅲ:
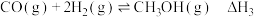
反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为
 ,则
,则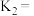
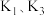 表示)。
表示)。(2)某探究小组用
 与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用
与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用 浓度为
浓度为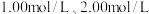 ,大理石有细颗粒和粗颗粒两种规格,实验温度为
,大理石有细颗粒和粗颗粒两种规格,实验温度为 、
、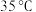 ,每次实验
,每次实验 的用量为
的用量为 ,大理石用量为
,大理石用量为 。
。| 实验编号 | 温度( ) ) | 大理石规格 |  (浓度) (浓度)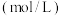 | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e___________对反应速率的影响 |
| ② | 25 | 粗颗粒 | a___________ | |
| ③ | b___________ | 粗颗粒 | 2.00 | |
| ④ | c___________ | 细颗粒 | d___________ |
(3)①氯气是制备系列含氯化合物的主要原料,可采用如图A所示的装置来制取氯气。装置中的离子膜只允许
 ”或“
”或“ ”)通过,氯气的逸出口是
”)通过,氯气的逸出口是 ”或“b”)。
”或“b”)。
②
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题
(1)已知:

则
___________ (填“>”或“<”) 。
。
(2)已知在 时:
时:
①
②
写出 与
与 反应生成
反应生成 的热化学方程式
的热化学方程式___________ 。
(3)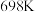 时,向VL的密闭容器中充入
时,向VL的密闭容器中充入 和
和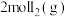 ,发生反应:
,发生反应: ,测得各物质的物质的量浓度与时间变化的关系如图所示。
,测得各物质的物质的量浓度与时间变化的关系如图所示。
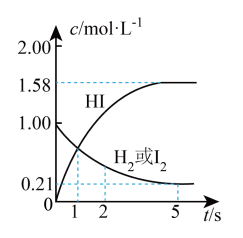
请回答下列问题:
①
___________ 。
②该反应达到最大限度的时间是___________ ,该时间内平均反应速率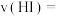
___________ 。
③该反应达到平衡状态时,放出的热量为___________ 。
(1)已知:


则

 。
。(2)已知在
 时:
时:①

②

写出
 与
与 反应生成
反应生成 的热化学方程式
的热化学方程式(3)
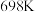 时,向VL的密闭容器中充入
时,向VL的密闭容器中充入 和
和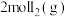 ,发生反应:
,发生反应: ,测得各物质的物质的量浓度与时间变化的关系如图所示。
,测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
①

②该反应达到最大限度的时间是
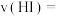
③该反应达到平衡状态时,放出的热量为
您最近一年使用:0次
名校
4 . 我国提出努力争取2060年前实现碳中和目标,通过反应将 转化为
转化为 是实现该目标的一种方式。回答下列问题:
是实现该目标的一种方式。回答下列问题:
(1)向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生反应
,发生反应 测定不同温度下
测定不同温度下 的平衡转化率如表所示。
的平衡转化率如表所示。
①该反应的
___________ (填“>”或“<”)0
已知: ,
,
则反应

___________ (用 和
和 表示)。
表示)。
②下列有利于增大 的平衡转化率的措施为
的平衡转化率的措施为___________ (填标号)。
a.增大反应体系的压强 b.增大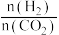
c.降低反应温度 d.移出
(3)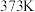 下,该反应的平衡常数
下,该反应的平衡常数
___________ (用含 的代数式表示)。
的代数式表示)。
(2)浙江大学某实验室用水热法还原 转化为
转化为 ,探究了不同条件下
,探究了不同条件下 的转化率,数据如图所示。
的转化率,数据如图所示。
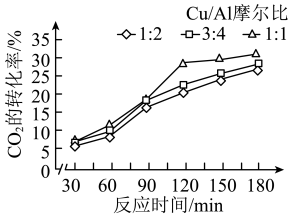
根据以上数据,最佳的Cu/Al摩尔比和反应时间分别是___________ 、___________ 。
 转化为
转化为 是实现该目标的一种方式。回答下列问题:
是实现该目标的一种方式。回答下列问题:(1)向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生反应
,发生反应 测定不同温度下
测定不同温度下 的平衡转化率如表所示。
的平衡转化率如表所示。 | 373 | 473 | 573 | 673 |
 的平衡转化率 的平衡转化率 |  | 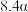 | 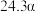 | 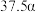 |

已知:
 ,
,则反应


 和
和 表示)。
表示)。②下列有利于增大
 的平衡转化率的措施为
的平衡转化率的措施为a.增大反应体系的压强 b.增大
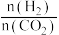
c.降低反应温度 d.移出

(3)
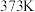 下,该反应的平衡常数
下,该反应的平衡常数
 的代数式表示)。
的代数式表示)。(2)浙江大学某实验室用水热法还原
 转化为
转化为 ,探究了不同条件下
,探究了不同条件下 的转化率,数据如图所示。
的转化率,数据如图所示。
根据以上数据,最佳的Cu/Al摩尔比和反应时间分别是
您最近一年使用:0次
名校
解题方法
5 . 依据下列含硫物质转化的热化学方程式,得出的相关结论正确的是
①S(g)+O2(g) SO2(g) ΔH1
SO2(g) ΔH1
②S(s)+O2(g) SO2(g) ΔH2
SO2(g) ΔH2
③2H2S(g)+ O2(g) 2S(s)+ 2H2O(1) ΔH3
2S(s)+ 2H2O(1) ΔH3
④2H2S(g)+3O2(g) 2SO2(g)+ 2H2O(1) ΔH4
2SO2(g)+ 2H2O(1) ΔH4
⑤2H2S(g)+SO2(g) 3S(s)+ 2H2O(1) ΔH5
3S(s)+ 2H2O(1) ΔH5
①S(g)+O2(g)
 SO2(g) ΔH1
SO2(g) ΔH1②S(s)+O2(g)
 SO2(g) ΔH2
SO2(g) ΔH2③2H2S(g)+ O2(g)
 2S(s)+ 2H2O(1) ΔH3
2S(s)+ 2H2O(1) ΔH3④2H2S(g)+3O2(g)
 2SO2(g)+ 2H2O(1) ΔH4
2SO2(g)+ 2H2O(1) ΔH4⑤2H2S(g)+SO2(g)
 3S(s)+ 2H2O(1) ΔH5
3S(s)+ 2H2O(1) ΔH5| A.ΔH1>ΔH2 | B.ΔH3<ΔH4 |
| C.ΔH4=ΔH2+ΔH3 | D.2ΔH5=3ΔH3-ΔH4 |
您最近一年使用:0次
2023-08-19更新
|
1023次组卷
|
5卷引用:贵州省铜仁市第二中学2022-2023学年高三上学期第二次月考化学试题
贵州省铜仁市第二中学2022-2023学年高三上学期第二次月考化学试题(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题02 盖斯定律、反应热的计算【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)河南省宜阳县第一高级中学2023-2024学年高二上学期能力达标测试化学试题河北省唐县第一中学2023-2024学年高二上学期9月月考化学试题
解题方法
6 .  重整技术对温室气体的减排具有重要意义,有助于我国早日实现碳达峰。
重整技术对温室气体的减排具有重要意义,有助于我国早日实现碳达峰。
 催化重整反应为
催化重整反应为
 kJ·mol
kJ·mol 。
。
已知:①

②
 kJ⋅mol
kJ⋅mol
③
 kJ⋅mol
kJ⋅mol
请回答下列问题:
(1)若在25℃、101kPa时,4g 燃烧放出222.5kJ热量,则
燃烧放出222.5kJ热量,则
_____ kJ⋅mol 。
。
(2) 的燃烧热
的燃烧热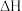 为
为_____ kJ⋅mol 。
。
(3)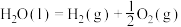 的
的
_____ kJ⋅mol ,若6.72L(标准状况)由
,若6.72L(标准状况)由 和
和 组成的混合气体在足量氧气中完全燃烧,恢复至室温后,放出85.5kJ热量,则
组成的混合气体在足量氧气中完全燃烧,恢复至室温后,放出85.5kJ热量,则
_____ 。
(4)反应 的
的 与
与 、
、 、
、 的关系为
的关系为_____ ,下列能加快该反应的反应速率的措施为_____ (填标号,下同),有利于提高 的平衡转化率的措施为
的平衡转化率的措施为_____ 。
A.扩大容器体积
B.降低温度
C.增大 的反应浓度
的反应浓度
D.及时移除部分
E.使用高效催化剂
 重整技术对温室气体的减排具有重要意义,有助于我国早日实现碳达峰。
重整技术对温室气体的减排具有重要意义,有助于我国早日实现碳达峰。 催化重整反应为
催化重整反应为
 kJ·mol
kJ·mol 。
。已知:①


②

 kJ⋅mol
kJ⋅mol
③

 kJ⋅mol
kJ⋅mol
请回答下列问题:
(1)若在25℃、101kPa时,4g
 燃烧放出222.5kJ热量,则
燃烧放出222.5kJ热量,则
 。
。(2)
 的燃烧热
的燃烧热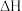 为
为 。
。(3)
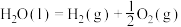 的
的
 ,若6.72L(标准状况)由
,若6.72L(标准状况)由 和
和 组成的混合气体在足量氧气中完全燃烧,恢复至室温后,放出85.5kJ热量,则
组成的混合气体在足量氧气中完全燃烧,恢复至室温后,放出85.5kJ热量,则
(4)反应
 的
的 与
与 、
、 、
、 的关系为
的关系为 的平衡转化率的措施为
的平衡转化率的措施为A.扩大容器体积
B.降低温度
C.增大
 的反应浓度
的反应浓度D.及时移除部分

E.使用高效催化剂
您最近一年使用:0次
7 . 尿素 是含氮量很高的氮肥,工业中利用
是含氮量很高的氮肥,工业中利用 和
和 在一定条件下分两步反应合成:①
在一定条件下分两步反应合成:①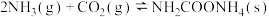
 kJ·mol
kJ·mol ;②
;②
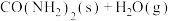
 kJ·mol
kJ·mol 。下列说法正确的是
。下列说法正确的是

 是含氮量很高的氮肥,工业中利用
是含氮量很高的氮肥,工业中利用 和
和 在一定条件下分两步反应合成:①
在一定条件下分两步反应合成:①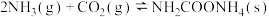
 kJ·mol
kJ·mol ;②
;②
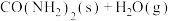
 kJ·mol
kJ·mol 。下列说法正确的是
。下列说法正确的是
A.反应①的 |
| B.合成尿素的总反应是吸热反应 |
| C.合成尿素的反应历程的能量变化如图所示 |
D.当 时,合成尿素的总反应达到平衡状态 时,合成尿素的总反应达到平衡状态 |
您最近一年使用:0次
2023-07-23更新
|
100次组卷
|
2卷引用:贵州省毕节市金沙县2022-2023学年高二上学期12月月考化学试题
名校
8 . 氮的氧化物既是空气的主要污染物,也是重要的化工原料。回答下列问题:
(1)已知
Ⅰ、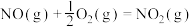 ,
,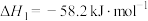 ;
;
Ⅱ、 ,
,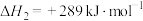 。
。
则反应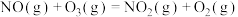 的△H=
的△H=___________ 。又知 ,反应机理为
,反应机理为 (快反应),
(快反应), (慢反应),则活化能较小的是反应是
(慢反应),则活化能较小的是反应是___________ (填“快反应”或“慢反应”)。
(2)若用 、
、 分别表示正、逆反应的速率常数(只受温度影响),反应
分别表示正、逆反应的速率常数(只受温度影响),反应 △H<0的
△H<0的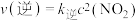 ,
, ,则该反应的正反应速率v(正)、
,则该反应的正反应速率v(正)、 、反应物浓度之间的关系式为
、反应物浓度之间的关系式为___________ 。
(3)在不同压强下,向某恒容密闭容器中通入初始浓度为2
 、6
、6 NO,使其发生反应
NO,使其发生反应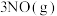
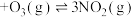 ,
,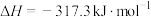 ,测得平衡时
,测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:
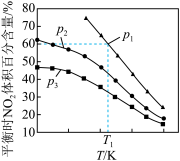
① 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,为提高NO的转化率,可采取的措施是___________ (写两点)。
②若 、
、 时,反应开始到达到平衡的时间为10s,则此阶段中
时,反应开始到达到平衡的时间为10s,则此阶段中
___________ (用分数表示),平衡常数
___________ 。
(1)已知
Ⅰ、
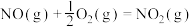 ,
,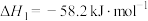 ;
;Ⅱ、
 ,
,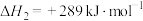 。
。则反应
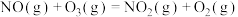 的△H=
的△H= ,反应机理为
,反应机理为 (快反应),
(快反应), (慢反应),则活化能较小的是反应是
(慢反应),则活化能较小的是反应是(2)若用
 、
、 分别表示正、逆反应的速率常数(只受温度影响),反应
分别表示正、逆反应的速率常数(只受温度影响),反应 △H<0的
△H<0的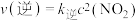 ,
, ,则该反应的正反应速率v(正)、
,则该反应的正反应速率v(正)、 、反应物浓度之间的关系式为
、反应物浓度之间的关系式为(3)在不同压强下,向某恒容密闭容器中通入初始浓度为2

 、6
、6 NO,使其发生反应
NO,使其发生反应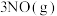
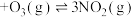 ,
,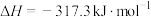 ,测得平衡时
,测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:
①
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②若
 、
、 时,反应开始到达到平衡的时间为10s,则此阶段中
时,反应开始到达到平衡的时间为10s,则此阶段中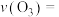

您最近一年使用:0次
名校
解题方法
9 . Ⅰ.已知在25℃、101kPa时:
a.
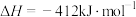
b.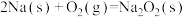
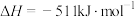
(1)写出 与Na反应生成
与Na反应生成 的热化学方程式
的热化学方程式_______ 。
Ⅱ.铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应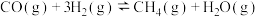
 。在T℃,压强为p时将1 mol CO和3 mol
。在T℃,压强为p时将1 mol CO和3 mol  加入容积为1 L的密闭容器中。实验测得CO的体积分数
加入容积为1 L的密闭容器中。实验测得CO的体积分数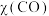 如表:
如表:
(2)达到平衡时,体系的总压强p与初始压强p0之比为_______ ;
(3)如图是该反应CO的平衡转化率与温度、压强的关系。

图中温度 、
、 、
、 由高到低的顺序是
由高到低的顺序是_______ ,理由是_______ 。
(4)45 min时,保持容器的温度和体积不变,再加入1 mol CO和3 mol ,再次达到平衡时,CO的平衡转化率
,再次达到平衡时,CO的平衡转化率_______ (填“不变”、“增大”或“减小”)。
a.

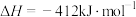
b.
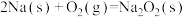
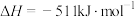
(1)写出
 与Na反应生成
与Na反应生成 的热化学方程式
的热化学方程式Ⅱ.铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应
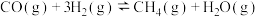
 。在T℃,压强为p时将1 mol CO和3 mol
。在T℃,压强为p时将1 mol CO和3 mol  加入容积为1 L的密闭容器中。实验测得CO的体积分数
加入容积为1 L的密闭容器中。实验测得CO的体积分数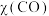 如表:
如表: | 0 | 10 | 20 | 30 | 35 |
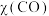 | 0.25 | 0.20 | 0.17 | 0.15 | 0.15 |
(3)如图是该反应CO的平衡转化率与温度、压强的关系。

图中温度
 、
、 、
、 由高到低的顺序是
由高到低的顺序是(4)45 min时,保持容器的温度和体积不变,再加入1 mol CO和3 mol
 ,再次达到平衡时,CO的平衡转化率
,再次达到平衡时,CO的平衡转化率
您最近一年使用:0次
解题方法
10 .  是高效光催化剂,可用四氯化钛(
是高效光催化剂,可用四氯化钛( )来制备
)来制备 。
。
已知:Ⅰ.
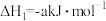
Ⅱ.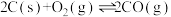
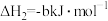
请回答下列问题:
(1) 与
与 反应生成
反应生成 、
、 和氧气的热化学方程式为
和氧气的热化学方程式为_______ 。
(2)若反应Ⅰ的逆反应活化能表示为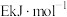 ,则E_______(填选项字母)。
,则E_______(填选项字母)。
(3)t℃时,向1L恒容密闭容器中充入0.1mol 和0.2mol
和0.2mol ,发生反应Ⅰ,经过4min达到平衡状态,平衡时测得容器中
,发生反应Ⅰ,经过4min达到平衡状态,平衡时测得容器中 的物质的量为0.02mol。
的物质的量为0.02mol。
①0~4min内 的反应速率
的反应速率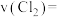
_______ 。
② 的平衡转化率
的平衡转化率
_______ 。
③下列措施即可加快反应速率,又能增大 平衡转化率的是
平衡转化率的是_______ (填选项字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分 D.增大
D.增大 浓度
浓度
④t℃时,向10L恒容密闭容器中充入4mol 和一定量
和一定量 的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比(
的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比( )的关系如图所示:
)的关系如图所示:
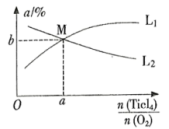
能表示 平衡转化率的曲线为
平衡转化率的曲线为_______ (填“ ”或“
”或“ ”);M点的坐标为
”);M点的坐标为_______ 。
(4)也可以利用四氯化钛( )水解制备
)水解制备 ,该反应的方程式为:
,该反应的方程式为:_______ 。
 是高效光催化剂,可用四氯化钛(
是高效光催化剂,可用四氯化钛( )来制备
)来制备 。
。已知:Ⅰ.

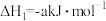
Ⅱ.
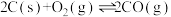
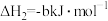
请回答下列问题:
(1)
 与
与 反应生成
反应生成 、
、 和氧气的热化学方程式为
和氧气的热化学方程式为(2)若反应Ⅰ的逆反应活化能表示为
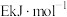 ,则E_______(填选项字母)。
,则E_______(填选项字母)。| A.大于a | B.小于a | C.等于a | D.无法确定 |
 和0.2mol
和0.2mol ,发生反应Ⅰ,经过4min达到平衡状态,平衡时测得容器中
,发生反应Ⅰ,经过4min达到平衡状态,平衡时测得容器中 的物质的量为0.02mol。
的物质的量为0.02mol。①0~4min内
 的反应速率
的反应速率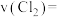
②
 的平衡转化率
的平衡转化率
③下列措施即可加快反应速率,又能增大
 平衡转化率的是
平衡转化率的是A.缩小容器容积 B.加入催化剂 C.分离出部分
 D.增大
D.增大 浓度
浓度④t℃时,向10L恒容密闭容器中充入4mol
 和一定量
和一定量 的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比(
的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比( )的关系如图所示:
)的关系如图所示:
能表示
 平衡转化率的曲线为
平衡转化率的曲线为 ”或“
”或“ ”);M点的坐标为
”);M点的坐标为(4)也可以利用四氯化钛(
 )水解制备
)水解制备 ,该反应的方程式为:
,该反应的方程式为:
您最近一年使用:0次



