名校
解题方法
1 . AlH3是一种储氢材料,可作为固体火箭推进剂。通过激光加热引发AlH3的燃烧反应,燃烧时温度随时间变化关系如右图所示。燃烧不同阶段发生的主要变化如下:
2AlH3(s)=2Al(s)+3H2(g) △H1
H2(g)+ O2(g)=H2O(g) △H2
O2(g)=H2O(g) △H2
Al(s)=Al(g) △H3
Al(g)+ O2(g)=
O2(g)= (s) △H4
(s) △H4

下列分析正确的是
2AlH3(s)=2Al(s)+3H2(g) △H1
H2(g)+
 O2(g)=H2O(g) △H2
O2(g)=H2O(g) △H2Al(s)=Al(g) △H3
Al(g)+
 O2(g)=
O2(g)= (s) △H4
(s) △H4
下列分析正确的是
| A.AlH3燃烧需要激光加热引发,所以AlH3燃烧是吸热反应 |
| B.其他条件相同时,等物质的量的Al(s)燃烧放热大于Al(g)燃烧放热 |
| C.在反应过程中,a点时物质所具有的总能量最大 |
| D.2AlH3(s)+3O2(g)=Al2O3(s)+3H2O(g) △H=△H1+3△H2+2△H3+2△H4 |
您最近一年使用:0次
2020-05-22更新
|
399次组卷
|
8卷引用:北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
2 . 已知:①C2H6(g) C2H4(g)+H2(g) H1 >0。
C2H4(g)+H2(g) H1 >0。
②C2H6(g)+ =2CO2(g)+3H2O(l) H 2 =-1559.8 kJ·mol-1
=2CO2(g)+3H2O(l) H 2 =-1559.8 kJ·mol-1
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) H 3=-1411.0 kJ·mol-1
下列叙述正确的是
 C2H4(g)+H2(g) H1 >0。
C2H4(g)+H2(g) H1 >0。②C2H6(g)+
 =2CO2(g)+3H2O(l) H 2 =-1559.8 kJ·mol-1
=2CO2(g)+3H2O(l) H 2 =-1559.8 kJ·mol-1③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) H 3=-1411.0 kJ·mol-1
下列叙述正确的是
| A.升温或加压均能提高①中乙烷的转化率 |
| B.①中断键吸收的能量少于成键放出的能量 |
| C.用H 2和H 3可计算出①中的H |
| D.推测1 mol C2H2(g)完全燃烧放出的热量小于1411.0 kJ |
您最近一年使用:0次
2020-05-16更新
|
180次组卷
|
4卷引用:北京师范大学附属中学2020-2021学年高二上学期期中考试化学试题
北京师范大学附属中学2020-2021学年高二上学期期中考试化学试题北京市第四十三中学2021-2022学年高三上学期12月月考化学试题北京市东城区2020届高三第一次模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:热化学 电化学
3 . 页岩气中含有较多的乙烷,可将其转化为更有工业价值的乙烯。
(1) 二氧化碳氧化乙烷制乙烯。
将C2H6和CO2按物质的量之比为1∶1通入反应器中,发生如下反应:
ⅰ.C2H6(g) C2H4(g) + H2(g) ΔH1=+136.4 kJ·mol− 1
C2H4(g) + H2(g) ΔH1=+136.4 kJ·mol− 1
ⅱ.CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+41.2 kJ·mol− 1
CO(g) + H2O(g) ΔH2=+41.2 kJ·mol− 1
ⅲ.C2H6(g) +CO2(g) C2H4(g) +CO(g) +H2O(g) ΔH3
C2H4(g) +CO(g) +H2O(g) ΔH3
①用ΔH1、ΔH2计算ΔH3=______ kJ·mol−1。
②反应ⅳ:C2H6(g) 2C(s)+3H2(g)为积碳反应,生成的碳附着在催化剂表面, 降低催化剂的活性,适当通入过量 CO2 可以有效缓解积碳,结合方程式解释其原因:
2C(s)+3H2(g)为积碳反应,生成的碳附着在催化剂表面, 降低催化剂的活性,适当通入过量 CO2 可以有效缓解积碳,结合方程式解释其原因:__ 。
③二氧化碳氧化乙烷制乙烯的研究热点之一是选择催化剂,相同反应时间,不同温度、不同催化剂的数据如下表(均未达到平衡状态):
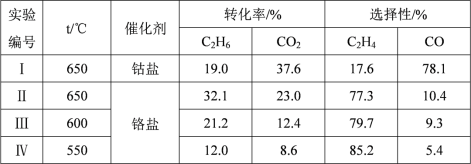
【注】C2H4 选择性:转化的乙烷中生成乙烯的百分比。
CO 选择性:转化的 CO2 中生成 CO 的百分比。
对比Ⅰ和Ⅱ,该反应应该选择的催化剂为__ ,理由是__ 。实验条件下,铬盐作催化剂时,随温度升高,C2H6 的转化率升高,但 C2H4 的选择性降低,原因是__ 。
(2) 利用质子传导型固体氧化物电解池将乙烷转化为乙烯,示意图如图:
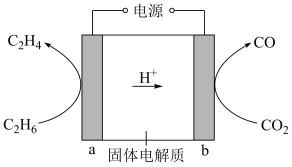
①电极 a 与电源的______ 极相连。
②电极 b 的电极反应式是______ 。
(1) 二氧化碳氧化乙烷制乙烯。
将C2H6和CO2按物质的量之比为1∶1通入反应器中,发生如下反应:
ⅰ.C2H6(g)
 C2H4(g) + H2(g) ΔH1=+136.4 kJ·mol− 1
C2H4(g) + H2(g) ΔH1=+136.4 kJ·mol− 1 ⅱ.CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH2=+41.2 kJ·mol− 1
CO(g) + H2O(g) ΔH2=+41.2 kJ·mol− 1 ⅲ.C2H6(g) +CO2(g)
 C2H4(g) +CO(g) +H2O(g) ΔH3
C2H4(g) +CO(g) +H2O(g) ΔH3①用ΔH1、ΔH2计算ΔH3=
②反应ⅳ:C2H6(g)
 2C(s)+3H2(g)为积碳反应,生成的碳附着在催化剂表面, 降低催化剂的活性,适当通入过量 CO2 可以有效缓解积碳,结合方程式解释其原因:
2C(s)+3H2(g)为积碳反应,生成的碳附着在催化剂表面, 降低催化剂的活性,适当通入过量 CO2 可以有效缓解积碳,结合方程式解释其原因:③二氧化碳氧化乙烷制乙烯的研究热点之一是选择催化剂,相同反应时间,不同温度、不同催化剂的数据如下表(均未达到平衡状态):
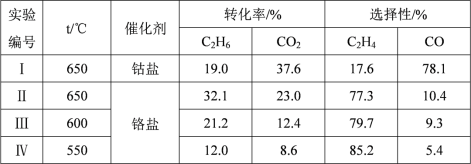
【注】C2H4 选择性:转化的乙烷中生成乙烯的百分比。
CO 选择性:转化的 CO2 中生成 CO 的百分比。
对比Ⅰ和Ⅱ,该反应应该选择的催化剂为
(2) 利用质子传导型固体氧化物电解池将乙烷转化为乙烯,示意图如图:

①电极 a 与电源的
②电极 b 的电极反应式是
您最近一年使用:0次
2020-04-08更新
|
554次组卷
|
5卷引用:北京市西城区2020届高三一模化学试题
北京市西城区2020届高三一模化学试题北京市第十五中学2023-2024学年高三上学期期中考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:化学反应原理北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题北京市第一0一中学2022-2023学年高二下学期3月统练化学试题
名校
解题方法
4 . 将TiO2转化为TiCl4是工业冶炼金属Ti的主要反应之一。已知:
TiO2(s)+2Cl2(g)=TiCl4(1)+O2(g) ∆H=+140.5kJ/mol
2CO(g)=2C(s,石墨)+O2(g) ∆H=+221.0 kJ/mol
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(1)+2CO(g)的∆H为
TiO2(s)+2Cl2(g)=TiCl4(1)+O2(g) ∆H=+140.5kJ/mol
2CO(g)=2C(s,石墨)+O2(g) ∆H=+221.0 kJ/mol
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(1)+2CO(g)的∆H为
| A.-30.0kJ/mol | B.+30.0 kJ/mol | C.-80.5kJ/mol | D.+80.5kJ/mol |
您最近一年使用:0次
2020-04-03更新
|
627次组卷
|
24卷引用:北京师大附中2019-2020学年上学期高二年级期末考试化学试题
北京师大附中2019-2020学年上学期高二年级期末考试化学试题2016届四川省巴中市普通高中高三10月诊断性测试理综化学试卷2015-2016学年福建省漳州市龙海市程溪中学高二上学期期末化学试卷2015-2016学年福建省四地六校高二上学期第三次联考化学试卷2015-2016学年黑龙江省海林林业局一中高二上期末考试化学试卷2015-2016学年吉林省松原油田高中高一下期初考试化学卷2015-2016学年吉林长春外国语高一下期末理科化学试卷2016-2017学年陕西西安中学高二实验班上期中化学卷【校级联考】福建省“华安一中、长泰一中、南靖一中、平和一中、龙海二中”五校2018-2019学年高二上学期第二次联考化学试题福建省平和一中、南靖一中等五校2018-2019学年高二上学期第二次联考化学试题【校级联考】甘肃省宁县2019届高三上学期期末联考化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题河北省张家口市宣化一中、张北一中2019-2020学年高二上学期期中联考化学试题河北省张家口市怀来县新保安第二中学2019-2020学年高二上学期11月月考化学试题甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题甘肃省永昌四中2020届高三上学期期末考试化学试题贵州省惠水县第一高级中学2019-2020学年高三上学期期末考试化学试题海南省琼山中学2019-2020学年高二上学期期中考试化学试题广东省珠海市北京师范大学珠海分校附属外国语学校2020-2021学年高二上学期期中考试化学试题(A卷)辽宁省葫芦岛市2020-2021学年高二上学期期末考试化学试题福建省南安市柳城中学2020-2021学年高二上学期期中考试化学试题新疆生产建设兵团第二师八一中学2021-2022学年高二上学期期中考试化学试题河南省濮阳市元龙高级中学2021-2022学年高二上学期期中考试化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期第一次质量检测化学试题
2019·福建莆田·二模
名校
解题方法
5 . 下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)( )
| A | B | C | D | |
| 定律或原理 | 勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 |
| 实验方案 | 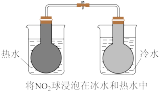 | 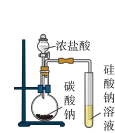 | 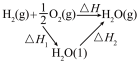 | 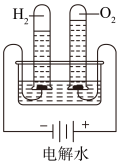 |
| 结果 | 左球气体颜色加深,右球气体颜色变浅 | 烧瓶中冒气泡,试管中出现浑浊 | 测得ΔH为ΔH1、ΔH2的和 | H2与O2的体积比约为2∶1 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-03-30更新
|
1343次组卷
|
37卷引用:北京市第四中学2022-2023学年高三下学期零模化学试题
(已下线)北京市第四中学2022-2023学年高三下学期零模化学试题【市级联考】福建省莆田市2019届高三下学期(5月)第二次质量检测(A卷) 化学试题天津市耀华中学2019届高三第二次校模拟考试化学试题天津市新华中学2019届高三下学期模拟考试理科综合化学试题安徽省肥东县第二中学2019-2020学年高二上学期期中考试化学试题河北省衡水市衡水中学2019-2020学年高三上学期期中考试化学试题(已下线)考点21 定量探究实验设计综合——《备战2020年高考精选考点专项突破题集》江西省吉安市五校2019-2020学年高二上学期第二次联考化学试题江西省宜春市上高二中2020届高三上学期第四次月考理综化学试题山东省济南市济北中学2019-2020学年高三第三次月考化学试题(已下线)【新东方】2020-18福建省泉州第十六中学2020届高三第五次能力测试理科综合化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题01-2020年北京新高考化学模拟试题云南省昆明市官渡区第一中学2020届高三上学期开学考试化学试题四川省成都石室中学2021届高三上学期开学考试化学试题四川省彭州市濛阳中学2021届高三上学期10月月考理综化学试题黑龙江省哈尔滨师范大学附属中学2021届高三10月月考化学试题湖南省中方一中2020-2021学年高二上学期期中考试化学试题湖北省新高考联考协作体2020-2021学年高二上学期期中考试化学试题河南省南阳市2021届高三期中质量评估化学试题江苏省启东市2021届高三上学期期中考试化学试题湖南省常德市第二中学2020-2021学年高二12月联考化学试题北京市2021届高三上学期期末考试(新高考模拟)化学试题湖南师范大学附属中学2019-2020学年高一下学期期末考试化学试题青海省西宁市普通高中五校2020-2021学年高三上学期期末联考化学试题四川省成都实验中学2021届高三3月月考理综化学试题河南省南阳市2021届高三上期期中考试化学试题广东省深圳市红岭中学2021-2022学年高二上学期期中考试化学试题江西省宜春市2020-2021学年高二年级上学期期末质量监测化学试题安徽省舒城中学2021-2022学年高二上学期第四次月考化学试题山东省泰安市2022届高三二轮验收考试化学试题湖南省益阳市第一中学2021-2022学年高三下学期第三次模拟考试化学试题湖北省襄阳市第五中学2022届高三适应性考试(四模)化学试题2022年山东省第三届学科素养知识竞赛(高中组)化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第三次月考化学试题云南师范大学附属中学2022-2023学年高二下学期期中考试化学试题北京市顺义区第二中学2023-2024学年高三下学期3月月考化学试题
6 . 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如方程式①②所示:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H=+49.0kJ•mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g);△H=-192.9kJ•mol-1
O2(g)=CO2(g)+2H2(g);△H=-192.9kJ•mol-1
③H2(g)+ O2(g)=H2O(g);△H=-241.8kJ•mol-1
O2(g)=H2O(g);△H=-241.8kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H=+49.0kJ•mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g);△H=-192.9kJ•mol-1
O2(g)=CO2(g)+2H2(g);△H=-192.9kJ•mol-1③H2(g)+
 O2(g)=H2O(g);△H=-241.8kJ•mol-1
O2(g)=H2O(g);△H=-241.8kJ•mol-1下列说法正确的是( )
| A.CH3OH的燃烧热为192.9kJ•mol-1 |
B.反应①中的能量变化如图所示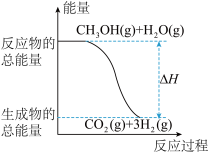 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据以上反应可知:CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)的△H=-676.5kJ•mol-1 O2(g)=CO2(g)+2H2O(g)的△H=-676.5kJ•mol-1 |
您最近一年使用:0次
2020-01-24更新
|
143次组卷
|
2卷引用:北京市第四十三中学2021-2022学年高二上学期期中考试化学试题
7 . 用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是_______________________________________________ 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______ (填字母)。
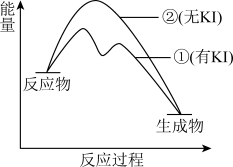
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I = H2O + IO
= H2O + IO 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________ ,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________ 。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________ 。
(4)资料4:I + I
+ I
 I
I K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
① a =____________________ 。
② 该平衡体系中除了含有I 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是_____________________ 。
(1)资料1:KI在该反应中的作用:H2O2 + I
 = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是

a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I
 = H2O + IO
= H2O + IO 是放热反应
是放热反应(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ.
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是
(4)资料4:I
 + I
+ I
 I
I K= 640。
K= 640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
| 微粒 | I | I | I |
| 浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
② 该平衡体系中除了含有I
 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是
您最近一年使用:0次
2020-01-23更新
|
358次组卷
|
11卷引用:北京师范大学附中2019-2020学年高二上学期期中考试化学试题
北京师范大学附中2019-2020学年高二上学期期中考试化学试题北京市第十四中学2021-2022学年高二上学期期中考试化学试题2020年北京新高考试测化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练北京市海淀区清华大学附属中学2020届高三下学期统一测试化学试题北京市2020普通高中学业水平考试等级性抽样测试化学试题(已下线)易错11 影响化学反应速率的因素-备战2021年高考化学一轮复习易错题内蒙古赤峰二中2021-2022学年高三上学期第一次月考化学试题(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题(已下线)第七章 化学反应速率与化学平衡 第40练 化学反应速率
8 . 我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料。
(1)制备碳酸钠。将饱和硫酸钠溶液和饱和碳酸氢铵溶液混合,结晶得NaHCO3晶体,再经加热分解制得碳酸钠。生成NaHCO3晶体的化学方程式是________ 。
已知:I.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol−1
II.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol−1
则:2NaHCO3(s) == Na2CO3(s) + CO2(g) + H2O(g) ΔH=________ kJ·mol−1。
(2)制备烧碱和硫酸。用如图所示装置,以惰性电极进行电解,a、b均为离子交换膜。
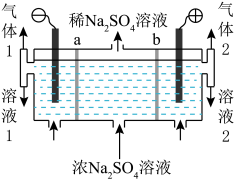
① Na+迁移方向是________ 。
② 气体1是________ ;溶液2是________ 。
(1)制备碳酸钠。将饱和硫酸钠溶液和饱和碳酸氢铵溶液混合,结晶得NaHCO3晶体,再经加热分解制得碳酸钠。生成NaHCO3晶体的化学方程式是
已知:I.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol−1
II.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol−1
则:2NaHCO3(s) == Na2CO3(s) + CO2(g) + H2O(g) ΔH=
(2)制备烧碱和硫酸。用如图所示装置,以惰性电极进行电解,a、b均为离子交换膜。

① Na+迁移方向是
② 气体1是
您最近一年使用:0次
9 . 通过以下反应均可获取H2。
① C(s) + H2O (g) =CO(g)+H2(g) ΔH1 = + 131.3 kJ·mol-1
② CH4 (g)+H2O(g) = CO(g)+3H2 (g) ΔH2 = + 206.1 kJ·mol-1
③ CO(g)+H2O(g) = CO2(g)+H2(g) ΔH3
下列说法正确的是
① C(s) + H2O (g) =CO(g)+H2(g) ΔH1 = + 131.3 kJ·mol-1
② CH4 (g)+H2O(g) = CO(g)+3H2 (g) ΔH2 = + 206.1 kJ·mol-1
③ CO(g)+H2O(g) = CO2(g)+H2(g) ΔH3
下列说法正确的是
| A.①中反应物的总能量大于生成物的总能量 |
| B.②中使用适当催化剂,可以使ΔH2减小 |
| C.由①、②计算反应CH4 (g) = C (s) + 2H2 (g) 的ΔH =-74.8 kJ·mol-1 |
| D.若知反应C (s) + CO2 (g) = 2CO (g) 的ΔH,结合ΔH1可计算出ΔH3 |
您最近一年使用:0次
2020-01-13更新
|
362次组卷
|
3卷引用:北京师范大学附属实验中学2020-2021学年高一下学期期中考试化学测试A卷
10 . 直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。

已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。


(1)Na2CO3溶液显碱性,用离子方程式解释其原因:______________ 。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为______________ 。
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:____________ 。
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l)
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l)
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l)
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是______________ 。
④吸收塔中的温度不宣过高,可能的原因是______________ (写出1种即可)。
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液______________ (填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。

已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。


(1)Na2CO3溶液显碱性,用离子方程式解释其原因:
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l)

CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l)

2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l)

吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是
④吸收塔中的温度不宣过高,可能的原因是
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液
您最近一年使用:0次
2019-12-21更新
|
323次组卷
|
3卷引用:【区级联考】北京市西城区2019届高三上学期期末考试化学试题



