解题方法
1 . 甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。
(1)已知一定条件下,发生反应: ,
,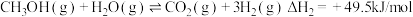 ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是________ 。
(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。
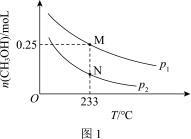
①p1____ p2(填“<”或“>”)。
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=_______ ,H2的转化率为______ (保留1位小数)。
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是_______ (填字母)。
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯: 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
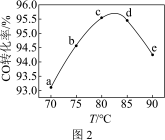
①b、c、d三点中,尚未达到化学平衡状态的点是________ 。
②该反应是_______ (填“放热”或“吸热”)反应。
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:________ 。
(1)已知一定条件下,发生反应:
 ,
,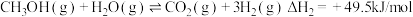 ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。

①p1
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯:
 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
①b、c、d三点中,尚未达到化学平衡状态的点是
②该反应是
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:
您最近一年使用:0次
名校
解题方法
2 . 已知H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-1,则反应HCl(g)=  H2(g)+
H2(g)+ Cl2(g)的ΔH为
Cl2(g)的ΔH为
 H2(g)+
H2(g)+ Cl2(g)的ΔH为
Cl2(g)的ΔH为| A.+184.6 kJ·mol-1 | B.-92.3 kJ·mol-1 |
| C.-369.2 kJ·mol-1 | D.+92.3 kJ·mol-1 |
您最近一年使用:0次
2023-08-26更新
|
1495次组卷
|
86卷引用:【区级联考】北京市西城区2018-2019学年高二上学期期末考试化学试题
【区级联考】北京市西城区2018-2019学年高二上学期期末考试化学试题北京市第四十三中学2020-2021学年高二上学期12月月考化学试题北京市第七中学2022-2023学年高二上学期期中化学试题(已下线)09-10年福州格致中学高一下学期第三学段质量检查化学卷(已下线)2010年内蒙古赤峰市田家炳中学高二上学期期中考试化学试卷(已下线)2010-2011学年广东省中山市桂山中学高二下期中考试化学试卷(已下线)2010—2011学年吉林省长春外国语学校高一下学期期末考试化学试卷理(已下线)2011-2012年河南省长葛市第三实验高中高二上学期第一次月考化学试卷(已下线)2011-2012年广东省广雅中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012学年福建泉州晋江市季延中学高二下学期期中化学试卷(已下线)2012-2013学年福建省晋江市季延中学高二下学期期中考试化学试卷(已下线)2013届江苏省淮阴中学高一下学期期初考试化学试卷2014-2015学年内蒙古巴市一中高二10月月考化学试卷2014-2015学年甘肃省民乐一中高二上学期第一次月考化学试卷2015-2016学年青海省高级中学高二上9月质检化学试卷2015-2016学年贵州省遵义航天中学高二上期末化学试卷2015-2016学年浙江省温州市瑞安市龙翔中学高二上第三次月考化学卷2016-2017学年北大附中河南分校高二上第一次月考化学卷2016-2017学年贵州省贵阳六中高二上10月月考化学卷(已下线)1.3.1 盖斯定律吉林省汪清县第六中学2017-2018学年高二9月月考化学试题陕西省西安市电子科技中学2017-2018学年高二上学期第一次月考化学试题广东省阳东广雅学校2017-2018学年高二9月月考化学试题河北省邢台第三中学2017-2018学年高二9月月考化学试题天津市杨柳青一中2017-2018第一学期高二第一次化学月考高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第一课时(盖斯定律)安徽省滁州市(九校)2017-2018学年高二上学期期末考试化学试题四川省成都七中实验学校2018-2019学年高二上学期10月月考化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题陕西省黄陵中学2018-2019学年高二(普通班)上学期期末考试化学试题【校级联考】河北省鸡泽县第一中学2018-2019学年高一下学期3月月考化学试题江苏省东台市创新高级中学2018-2019学年高二下学期3月月考化学试题步步为赢 高二化学暑假作业:作业七 化学反应与能量江苏省沭阳县2018-2019学年高二下学期期中调研测试化学试题陕西省吴起高级中学2018-2019学年高一下学期第二次月考基础卷化学试题吉林省吉林地区普通高中友好学校联合体第三十一届2019-2020学年高二上学期期中考试化学试题河北省邢台市第八中学2019-2020学年高二上学期第一次月考化学试题甘肃省白银市会宁县第四中学2019-2020学年高二上学期期中考试化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题湖南省永州市双牌县第二中学2019-2020学年高二上学期期中考试化学试题(选考)安徽省黄山市“八校联盟”2019-2020学年高二上学期期中考试化学试题河北省保定市易县中学2019-2020学年高一(B部)下学期3月月考化学试题辽宁省大连市普兰店市第一中学2019-2020学年高二上学期期末考试化学试题湖南省长沙市雨花区2018-2019学年高二上学期期末考试化学(理)试题福建省永安市第三中学2020-2021学年高二10月月考化学(学考班)试题吉林省松原市乾安县第七中学2020-2021学年高二上学期第一次教学质量检测化学试题吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题甘肃省兰州市第四片区2020-2021学年高二上学期期中考试化学(理)试题宁夏长庆高级中学2020-2021学年高二上学期第一次月考化学试题福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题河南正阳县高级中学2020-2021学年高二上学期第三次素质检测化学试题陕西省咸阳百灵中学2020-2021学年高二上学期期中考试化学试题广东省东莞市二中2020-2021学年上学期高二10月考试化学试题海南省海南鑫源高级中学2019-2020学年高二上学期期末考试化学试题安徽省安庆市九一六学校2020-2021学年高二下学期开学考试化学试题山西省沁源县第一中学2020-2021学年高二下学期开学考试化学试题河北省石家庄市2019~2020学年高二上学期期末考试化学试题贵州省龙里县九八五实验学校2020-2021学年高二上学期1月月考化学试题辽宁省恒仁满族自治县第二高级中学2020-2021学年高二上学期期末考试化学试题(已下线)1.1.2 反应热的测量与计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)云南省玉溪第一中学2021-2022学年高二上学期第一次月考化学试题湖南省郴州市湘南中学2019-2020学年高二上学期期中考试化学试题(高考班)吉林省通化县综合高级中学2021-2022学年高二上学期期中考试化学试题安徽省宣城市六校2021-2022学年高二上学期期中联考化学试题河南省中原名校2021-2022学年高二上学期12月联考化学试题江苏省盐城市实验高级中学(新洋高级中学)2020-2021学年高二下学期期中考试化学试题福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题云南省曲靖市宣威市第七中学2021-2022学年高二下学期2月考试化学试题河南省温县第一高级中学2021-2022学年高二上学期1月月考化学试题福建省莆田华侨中学2021-2022学年高二上学期期中考试化学试题福建省莆田华侨中学2021-2022学年高二上学期期中考试化学试题海南省白沙中学2021-2022学年高二上学期第一次月考化学试题广东省广州市从化区从化中学2022-2023学年高二上学期期中考试化学试题第3课时 反应焓变的计算【定心卷】1.1.3 热化学方程式随堂练习-人教版2023-2024学年选择性必修1江西省抚州市乐安县第二中学2023-2024学年高二上学期11月期中化学试题(已下线)BBWYhjhx1102陕西省西安市鄠邑区2023-2024学年高二上学期期中质量检测化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题四川省泸州市泸县第五中学2023-2024学年高二上学期12月月考化学试题云南省宣威市第三中学2023-2024学年高二上学期第四次月考化学试题江西省金溪县第一中学、广昌一中、南丰一中2023-2024学年高二上学期第一次月考化学试题新疆乌鲁木齐市六校联考2023-2024学年高二上学期期末考试化学试题河北省石家庄康福外国语学校2023-2024学年高二上学期期中考试化学试题宁夏开元学校2023-2024学年高二学年下学期开学收心测试化学试题
名校
3 . 二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s) MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
ii.2MnO(s)+O2(g) 2MnO2(s) ΔH2=+b kJ·mol−1
2MnO2(s) ΔH2=+b kJ·mol−1
①反应i的化学平衡常数表达式K=_________ 。
②焙烧MnCO3制取MnO2的热化学方程式是_________ 。
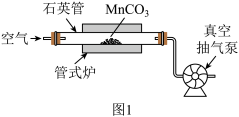
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是_________ 。
(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图2、图3所示。
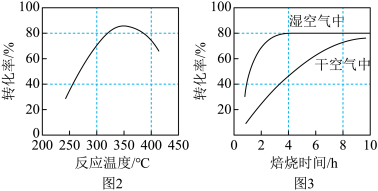
①图2是在常压(0.1 MPa)下的研究结果,请在图2中用虚线画出10 MPa下MnCO3转化率与反应温度的关系图_________ 。
②常压下,要提高MnCO3的转化率,应选择的生产条件是_________ 焙烧6~8h。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)
 MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
MnO(s)+CO2(g) ΔH1=+a kJ·mol−1ii.2MnO(s)+O2(g)
 2MnO2(s) ΔH2=+b kJ·mol−1
2MnO2(s) ΔH2=+b kJ·mol−1①反应i的化学平衡常数表达式K=
②焙烧MnCO3制取MnO2的热化学方程式是
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是

(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图2、图3所示。

①图2是在常压(0.1 MPa)下的研究结果,请在图2中用虚线画出10 MPa下MnCO3转化率与反应温度的关系图
②常压下,要提高MnCO3的转化率,应选择的生产条件是
您最近一年使用:0次
2022-12-05更新
|
99次组卷
|
3卷引用:北京市第四十三中学2021-2022学年高二上学期12月月考化学试题
4 .  (s)与CO(g)主要发生如下反应。
(s)与CO(g)主要发生如下反应。
①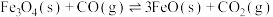
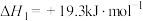
②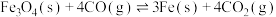

反应的还原产物与温度密切相关。其他条件一定, (s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
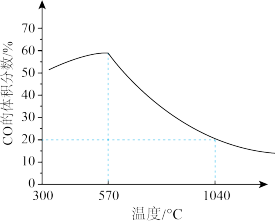
 (s)与CO(g)主要发生如下反应。
(s)与CO(g)主要发生如下反应。①
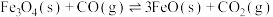
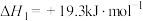
②
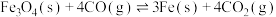

反应的还原产物与温度密切相关。其他条件一定,
 (s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
A.反应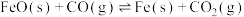 的焓变为 的焓变为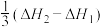 |
B.根据图象推测, 应当小于0 应当小于0 |
C.反应温度越高, 主要还原产物中铁元素的价态越低 主要还原产物中铁元素的价态越低 |
D.温度高于1040℃时, (s)和CO(g)发生的主要反应的化学平衡常数 (s)和CO(g)发生的主要反应的化学平衡常数 |
您最近一年使用:0次
2022-09-01更新
|
962次组卷
|
11卷引用:北京市育才学校2023-2024学年高三上学期11月期中考试化学试题
北京市育才学校2023-2024学年高三上学期11月期中考试化学试题北京市海淀区2021-2022学年高三上学期期末考试化学试题四川省成都市第七中学2023届高三上学期零诊模拟考试化学试题河南省豫北名校2022-2023学年高二上学期10月教学质量检测化学试题北京市第二十中学2022-2023学年高二上学期期末考试化学试题广东省华南师范大学附属中学2022届高三下学期押题预测(一)化学试题安徽省六安第一中学2023-2024学年高二上学期期中考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第八十中学2024届高三上学期10月月考化学试题北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市密云二中2023-2024学年高二上学期10月月考化学试卷
名校
解题方法
5 . 已知:(1)Zn(s)+ O2(g)=ZnO(s),△H=﹣348.3 kJ/mol
O2(g)=ZnO(s),△H=﹣348.3 kJ/mol
(2)2Ag(s)+ O2(g)=Ag2O(s),△H=﹣31.0 kJ/mol
O2(g)=Ag2O(s),△H=﹣31.0 kJ/mol
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
 O2(g)=ZnO(s),△H=﹣348.3 kJ/mol
O2(g)=ZnO(s),△H=﹣348.3 kJ/mol(2)2Ag(s)+
 O2(g)=Ag2O(s),△H=﹣31.0 kJ/mol
O2(g)=Ag2O(s),△H=﹣31.0 kJ/mol则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
| A.﹣317.3 kJ/mol | B.﹣379.3 kJ/mol |
| C.﹣332.8 kJ/mol | D.+317.3 kJ/mol |
您最近一年使用:0次
2021-10-22更新
|
1343次组卷
|
102卷引用:北京师范大学附属实验中学2020-2021学年高一下学期期中考试化学测试A卷
北京师范大学附属实验中学2020-2021学年高一下学期期中考试化学测试A卷北京市北师大附属实验中学2021-2022学年高二上学期期中考试化学试题(已下线)2010年广东省执信中学高二上学期期中考试化学卷(已下线)2010年广东省东莞市光明、常平、厚街、万江四校高二上学期期中考试化学试卷(已下线)2010-2011年福建省福州八中高二下学期期末考试化学试卷(已下线)2011-2012年广东省广雅中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年山东临清三中高二上学期学分认定测试化学(理)试卷(已下线)2011-2012学年陕西省三原县北城中学高二上学期期中考试化学试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期末考试化学试卷(已下线)2011-2012学年山东省泰安市宁阳二中高二上学期期中考试化学试卷(已下线)2012-2013学年天津市天津一中高二上学期期中考试化学试卷2015-2016学年黑龙江哈尔滨六中高二上期中测试化学试卷2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷2015-2016学年四川省彭州中学高二下2月月考化学试卷2015-2016学年四川省阆中中学高一下第二次段考化学卷(已下线)同步君 人教版 选修4 第1章 第3节 反应热的计算2016-2017学年浙江省温州中学高二上10月月考化学试卷甘肃省临夏中学2016-2017学年高二上学期期末考试化学试题吉林省汪清县第六中学2017-2018学年高二9月月考化学试题广东省阳东广雅学校2017-2018学年高二9月月考化学试题西藏日喀则市第二高级中学2017-2018学年高二上学期期中考试化学试题河南省豫北重点中学2017-2018学年高二12月联考化学试题高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第二课时(反应热的计算)山东省新汶中学2017-2018学年高二上学期第一次月考化学试题江西省临川实验学校2017-2018学年高二上学期期末质量检测化学试题山东省济南市第一中学2017-2018学年高二上学期期末考试化学试题山东省临沂市第十九中学2017-2018学年高二下学期开学考试化学试题【全国省级联考】广东省蓝精灵中学2017-2018 学年度高二上学期期末联考化学试题山西省朔州市应县第一中学2018-2019学年高二上学期9月月考化学试题山西省汾阳市第二高级中学2018-2019学年高二上学期第二次半月考化学试题陕西省蓝田县焦岱中学2018-2019学年高二上学期第一次月考化学试题【校级联考】湖南省浏阳市六校联考2018-2019学年高二上学期期中考试化学试题【全国百强校】内蒙古杭锦后旗奋斗中学2018-2019学年高二上学期第二次(12月)月考化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题山东省微山县第二中学2018-2019学年高二上学期第三学段教学质量监测化学试题海南省海口第四中学2018-2019学年高二下学期第一次月考化学试题吉林省长春市汽车经济开发区第三中学2018-2019学年高二下学期期中考试化学试题新疆自治区生产建设兵团第一师高级中学2018-2019学年高二上学期第二次月考化学试题云南省保山市第一中学2018-2019学年高二下学期期末化学试题天津市静海区四校2019-2020学年高二上学期9月联考化学试题甘肃省武威市第六中学2019-2020学年高二上学期第一次学段考试化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期第一次月考化学试题河北省唐山市第十一中学2019-2020学年高二上学期期中考试化学(理)试题河北省石家庄市六校2019-2020学年高二上学期期中考试化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题河北省临漳县第一中学2019-2020学年高二上学期期中考试化学试题云南省福贡县一中2019-2020学年高二上学期期末考试化学试题湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题2020届高三化学知识点强化训练—化学能与热能广西壮族自治区贺州市桂梧高中2019-2020学年高二上学期第一次月考化学试题内蒙古集宁一中西校区2019-2020学年高一下学期期中考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第1节 化学反应的热效应湖南省娄底市第一中学2020-2021学年高二上学期9月月考化学试题黑龙江省哈尔滨市延寿县第二中学2020-2021学年高二上学期9月月考化学试题宁夏回族自治区青铜峡市高级中学2020-2021学年高二上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期实验班第一次月考化学试题河南省周口市中英文学校2020-2021学年高二上学期第一次月考化学试题内蒙古赤峰学院附属中学2020-2021学年高二上学期期中考试化学试题吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题宁夏回族自治区海原县第一中学2020-2021学年高二上学期第一次月考化学试题甘肃省武威第十八中学2020-2021学年高二上学期期中考试化学试题河南省新乡市长垣县第十中学2020-2021学年高二上学期期中考试化学试题青海省西宁市海湖中学2021届高三上学期第二阶段考试化学试题浙江省磐安县第二中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】98黑龙江省哈尔滨市第三十二中学2021届高三上学期期末考试化学试题 吉林省公主岭市范家屯镇第一中学2020-2021学年高二上学期期末两校联考化学试题海南华侨中学观澜湖学校2019-2020学年高一下学期期末考试化学试题甘肃省白银市会宁县2020-2021学年高二上学期期末考试化学试题山西省汾阳市汾阳中学2020-2021学年高二下学期开学考试化学试题宁夏大学附属中学2020-2021学年高二下学期第一次月考化学试题(已下线)1.1.2 反应热的测量与计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)山西省大同市浑源县第七中学2020-2021学年高二上学期第一次月考化学试题吉林省吉林市第二中学2020-2021学年高一下学期期末考试化学试题江苏省海安市南莫中学2021-2022学年高二上学期第一次月考备考金卷B卷化学试题湖南省益阳市箴言中学2021-2022学年高二上学期10月月考化学试题安徽省亳州市第二中学2021-2022学年高二上学期第一次月考化学试题辽宁省渤海大学附属高级中学2021-2022学年高二上学期第一次月考化学试题天津市第十四中学2021-2022学年高二上学期第一次月考化学试题福建省福州市文博中学2020-2021学年高一下学期期中考试化学试题海南省北京师范大学万宁附属中学2021-2022学年高二上学期第一次月考化学试题 安徽省皖北县中联盟2021-2022学年 高二上学期10月第一次联考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题河南省平顶山九校联盟2021-2022学年高二上学期期中考试化学试题湖南省怀化市第五中学2021-2022学年高二上学期期中考试化学试题(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)吉林省辉南县第一中学2021-2022学年高二上学期第三次月考化学试题辽宁省重点高中沈阳市郊联体2021-2022学年高一下学期4月联考化学试题天津市南开区2021-2022学年高一下学期期末阶段性质量检测化学试题河南省中原名校2022-2023学年高二上学期第一次联考化学试题浙江省金华市江南中学2021-2022学年高二上学期期中考试化学试题安徽省青阳县第一中学2021-2022学年高二下学期3月月考化学试卷云南省昆明市寻甸县第二中学2022-2023学年高二上学期10月月考 化学试卷贵州省晴隆县第三中学2022-2023学年高二上学期第一次月考化学试题陕西省西安市鄠邑区第二中学2021-2022学年高二上学期第一次月考化学试题内蒙古赤峰市松山区第二地质中学2020-2021学年高一下学期第二次阶段检测化学试题贵州省贵阳市花溪第六中学2021-2022学年高二上学期月考化学试题陕西省渭南市尚德中学2021-2022学年高二上学期第二次质量检测化学试题云南省昆明市昆明行知中学2021-2022学年高二上学期第一次质量检测(10月)化学试题第一章 化学反应的热效应 第二节 反应热的计算福建省厦门市松柏中学2023-2024学年高二上学期10月月考化学试题海南省省直辖县级行政单位澄迈县澄迈中学2023-2024学年高二上学期11月期中化学试题
名校
6 . 燃煤电厂锅炉尾气中含有氮氧化物(主要成分NO),可通过主反应4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)ΔH=-1627.7kJ·mol−1除去。温度高于300℃时会发生副反应:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=-904.74kJ·mol−1.在恒压、反应物起始物质的量之比一定的条件下,反应相同时间,NO的转化率在不同催化剂作用下随温度变化的曲线如图所示。下列有关说法一定正确的是

| A.升高温度、增大压强均可提高主反应中NO的平衡转化率 |
| B.N2(g)+O2(g)=2NO(g)ΔH=-180.74kJ·mol−1 |
| C.图中X点所示条件下,反应时间足够长,NO的转化率能达到Y点的值 |
| D.图中Z点到W点NO的转化率降低的原因是主反应的平衡逆向移动 |
您最近一年使用:0次
2021-05-24更新
|
709次组卷
|
10卷引用:北京师范大学附属实验中学2023-2024学年高二上学期10月月考化学试题
北京师范大学附属实验中学2023-2024学年高二上学期10月月考化学试题江苏省扬州市2021届高三考前调研测试化学试题江苏省苏州八校联盟2021-2022学年高三上学期第一次适应性检化学试题(已下线)2020年江苏卷化学高考真题变式题11-15(已下线)专题12 化学反应速率与化学平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)易错点6化学平衡状态判断错误江苏省南京市第二十九中学2022-2023学年高二下学期期中考试化学试题(已下线)不定项选择题江苏省扬州中学2023-2024学年高二上学期11月期中化学试题江苏省徐州市第七中学2023-2024学年高二下学期3月考试化学试题
名校
解题方法
7 . 工业上处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为S和CO2。已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol; S(s)+O2(g)=SO2(g) ΔH=-296 kJ/mol;则该条件下2CO(g)+SO2(g)=S(s)+2CO2(g)的ΔH等于
| A.- 270 kJ/mol | B.+26 kJ/mol | C.-582 kJ/mol | D.+270 kJ/mol |
您最近一年使用:0次
2021-01-24更新
|
1509次组卷
|
29卷引用:北京市西城区2020-2021学年高二上学期期末考试化学试题
北京市西城区2020-2021学年高二上学期期末考试化学试题北京市第十五中学2021-2022学年高二上学期期中考试化学试题北京十四中2022-2023学年高二上学期期中检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京师范大学第二附属中学2022-2023学年高二上学期期中考试化学试题北京市育才学校2023-2024学年高二上学期10月月考化学试题北京市西城区2022-2023学年育才学校高二上学期化学期中考试北京市八十中2020-2021学年高二下学期开学考试化学试题北京市回民学校2021-2022学年高二上学期期中考试化学试题北京市清华附中2021-2022学年高一下学期期末考试化学试题第一章化学反应的热效应北京市师范大学亚太实验学校2021-2022学年高二上学期期中考试化学试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题北京市顺义区顺义第一中学2022-2023学年高二上学期期中考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题广西百色民族高级中学2022-2023学年高二上学期10月阶段检测化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题新疆阿勒泰地区2022-2023学年高一下学期期末考试化学试题(已下线)专题02 盖斯定律、反应热的计算【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)北京市东直门中学2022-2023学年高二上学期期中考试化学试题北京市北京医学院附属中学2022-2023学年高二上学期期中考试化学试题江西省抚州市临川第一中学2023-2024学年高二上学期期中考试 化学试卷北京市顺义区2023-2024学年第九中学高二上学期化学期中试题北京市中国人民大学附属中学通州校区2023-2024学年高二上学期10月月考化学试题北京市通州区2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高二上学期期中考试化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题北京师范大学附属昌平学校2023-2024学年高二上学期12月月考化学试题
8 . 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在钢基催化剂上的反应机理相能量图如下:
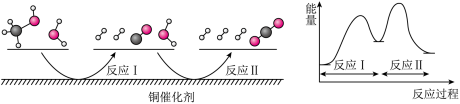
下列说法正确的是( )

下列说法正确的是( )
| A.反应II的热化学方程式为:CO(g)+H2O(g)→H2(g)+CO2(g) -Q kJ(Q>0) |
| B.1 mol CH3OH(g)和l mol H2O(g)的总能量大于l mol CO2(g)和3 mol H2(g)的总能量 |
| C.选择优良的催化剂降低反应I和II的活化能,有利于减少过程中的能耗 |
| D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂 |
您最近一年使用:0次
2020-10-23更新
|
513次组卷
|
22卷引用:北京市西城区第一六一中学2022届高三考前热身测试化学试题
北京市西城区第一六一中学2022届高三考前热身测试化学试题北京市石景山区2020届高三第一次模拟化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:热化学 电化学天津市红桥区2020届高三第二次模拟考试化学试题北京市北京师范大学燕化附属中学2019-2020 学年高二下学期期末考试化学试题北京市延庆区2019-2020学年高二下学期期末考试化学试题广州市天河中学2019—2020学年高二下学期期末测试化学试卷山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题上海市复旦大学附属中学2021届高三上学期第一次教学质量检测化学试题吉林省长春市第一五一中学2020-2021学年高二上学期第一次月考化学试题(希望班)江西省赣州市十五县市十六校2020-2021学年高二上学期期中联考化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)专题1.1.2 热化学方程式的书写(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)福建省武平县第一中学2021-2022学年高二上学期10月月考化学试题江西省赣州市2021-2022学高三上学期期末考试化学试题北京市日坛中学2021-2022学年高二上学期期中考试化学试题(已下线)第15讲 化学反应的热效应 (练)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省武汉市青山区2021-2022学年高二上学期期末考试化学试题上海行知中学2022-2023学年高三上学期第一次月考化学试题广东省广州市玉岩中学2022-2023学年高二上学期10月月考化学试题河南省鹤壁市高中2022-2023学年高三上学期第三次模拟考试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题16-20)
名校
解题方法
9 . 以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程如图所示。
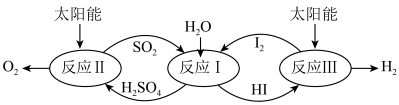
相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-213kJ•mol-1
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+ O2(g) H2=+327kJ•mol-1
O2(g) H2=+327kJ•mol-1
反应Ⅲ:2HI(aq)=H2(g)+I2(g) H3=+172kJ•mol-1
下列说法不正确的是

相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-213kJ•mol-1
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+
 O2(g) H2=+327kJ•mol-1
O2(g) H2=+327kJ•mol-1反应Ⅲ:2HI(aq)=H2(g)+I2(g) H3=+172kJ•mol-1
下列说法不正确的是
| A.该过程实现了太阳能到化学能的转化 |
| B.SO2和I2对总反应起到了催化作用 |
| C.总反应的热化学方程式为2H2O(l)=2H2(g)+O2(g) H=+286kJ•mol-1 |
| D.该过程降低了水分解制氢的活化能,但总反应的H不变 |
您最近一年使用:0次
2020-10-12更新
|
2802次组卷
|
28卷引用:北京市第三十一中学2021-2022学年高二上学期期中考试化学试题
北京市第三十一中学2021-2022学年高二上学期期中考试化学试题【区级联考】北京市海淀区2019届高三第一学期上学期期末考试化学试题【全国百强校】浙江省学军中学2019届高三下学期4月选考模拟冲刺化学试题【全国百强校】内蒙古自治区赤峰二中2018-2019学年高一下学期第二次月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》2019年秋高三化学复习强化练习—— 盖斯定律及其应用河南省实验中学2020届高三12月月考化学试题北京市2020届高三12月月考(新高考选考模式)化学试题北京市2020届高三质量监测化学试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编山东省济南市历城第二中学2021届高三10月份学情检测化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过模拟 2年模拟精编精练湖北省部分省重点中学2020-2021学年高二上学期期中联考化学试题湖北省部分重点中学2020-2021学年高二上学期期中考试化学试题(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题(已下线)高中化学《新教材变化解读与考法剖析》第一章 化学反应的热效应(人教版2019选择性必修1)山东省聊城第三中学2021-2022学年高二上学期第三次质量检测化学试题山东省聊城市第二中学2022-2023学年高二上学期第一次月考化学试题北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题山东省临沂市平邑县第一中学2022-2023学年高二上学期10月月考化学试题 湖北省仙桃中学2022-2023学年高一上学期10月月考化学试题湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题(已下线)2023年北京卷高考真题变式题(选择题11-14)湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题江西省宜春市上高二中2023-2024学年高二上学期第一次月考化学试题河北省唐山市丰润区2023-2024学年高二上学期期中考试化学试题福建省厦门市集美中学2023-2024学年高二上学期10月第一次月考化学试题
解题方法
10 . 载人航天器中,利用萨巴蒂尔反应将航天员呼出的 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。已知:
的再生。已知:
①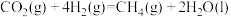 △H= -252.9kJ/mol
△H= -252.9kJ/mol
②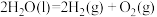 △H= 571.6.kJ/mol
△H= 571.6.kJ/mol
请回答下列问题:
(1)反应①属于______ (填“吸热”或“放热”)反应。
(2)反应①消耗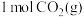 时,热量变化为
时,热量变化为______  。
。
(3)反应②的热量变化为吸热571.6.kJ时,生成 的质量是
的质量是_______ g。
(4)反应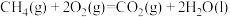 ,△H=
,△H=______  。
。
 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。已知:
的再生。已知:①
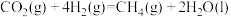 △H= -252.9kJ/mol
△H= -252.9kJ/mol②
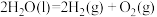 △H= 571.6.kJ/mol
△H= 571.6.kJ/mol请回答下列问题:
(1)反应①属于
(2)反应①消耗
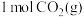 时,热量变化为
时,热量变化为 。
。(3)反应②的热量变化为吸热571.6.kJ时,生成
 的质量是
的质量是(4)反应
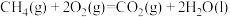 ,△H=
,△H= 。
。
您最近一年使用:0次
2020-09-16更新
|
204次组卷
|
3卷引用:北京市西城职业学校2021-2021学年高二上学期期中测试化学试题



