名校
解题方法
1 . 完成下列问题
(1)0.1mol 完全燃烧生成液态水和
完全燃烧生成液态水和 ,放出88.96kJ热量,
,放出88.96kJ热量, 的燃烧热为
的燃烧热为
___________ kJ/mol。
(2)单斜硫和正交硫转化为 的能量变化图如图。
的能量变化图如图。
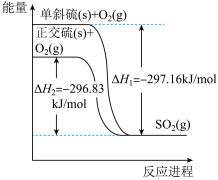
32g单斜硫转化为正交硫的反应热为
___________ kJ/mol,单斜硫比正交硫的稳定性___________ (填“强”或“弱”)。
(3) 和
和 在一定条件下能发生反应:
在一定条件下能发生反应: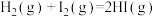
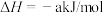
已知:
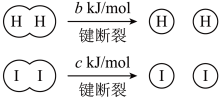 a、b、c均大于零
a、b、c均大于零
断开1mol H-I键所需能量为___________ kJ/mol。
(1)0.1mol
 完全燃烧生成液态水和
完全燃烧生成液态水和 ,放出88.96kJ热量,
,放出88.96kJ热量, 的燃烧热为
的燃烧热为
(2)单斜硫和正交硫转化为
 的能量变化图如图。
的能量变化图如图。
32g单斜硫转化为正交硫的反应热为

(3)
 和
和 在一定条件下能发生反应:
在一定条件下能发生反应: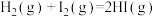
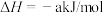
已知:
 a、b、c均大于零
a、b、c均大于零断开1mol H-I键所需能量为
您最近一年使用:0次
2 . 二氧化碳捕获技术用于去除气流中的二氧化碳或者分离出二氧化碳作为气体产物,其中CO2催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有催化剂时的能量变化。

(1)从图可知,有催化剂存在的是过程_______ (填“Ⅰ”或“Ⅱ”)。
(2)写出图中CO2催化合成甲醇的热化学方程式:_______ 。
(3)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由CO2合成1mol液态甲醇和1mol液态水将_______ (填“吸收”或“放出”)_______ kJ热量。
(4)关于CO2催化合成甲醇的反应,下列说法中,合理的是_______(填字母序号)。

(1)从图可知,有催化剂存在的是过程
(2)写出图中CO2催化合成甲醇的热化学方程式:
(3)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由CO2合成1mol液态甲醇和1mol液态水将
(4)关于CO2催化合成甲醇的反应,下列说法中,合理的是_______(填字母序号)。
| A.该反应中所有原子都被用于合成甲醇 |
| B.该反应可用于CO2的转化,有助于缓解温室效应 |
| C.使用催化剂可以降低该反应的ΔH,从而使反应放出更多热量 |
| D.降温分离出液态甲醇和水,将剩余气体重新通入反应器,可以提高CO2与H2的利用率 |
您最近一年使用:0次
解题方法
3 . 填空。
(1)已知:I.2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4kJ·mol−1
II.NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ·mol−1
则NaHCO3晶体可制备碳酸钠的热化学方程式为:_______ 。
(2)NOx是汽车尾气中的主要污染物之一、汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

写出该反应的△H=_______ kJ·mol−1,随温度升高,该反应化学平衡常数的变化趋势是_______ 。(填“变大”“变小”或“不变”)。
(1)已知:I.2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4kJ·mol−1
II.NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ·mol−1
则NaHCO3晶体可制备碳酸钠的热化学方程式为:
(2)NOx是汽车尾气中的主要污染物之一、汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

写出该反应的△H=
您最近一年使用:0次
名校
4 . 书写下列化学方程式
(1)下图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式___________ 。

(2)已知:C(s) + O2(g) = CO2(g) ΔH=-437.3 kJ•mol-1
H2(g) +1/2O2(g) = H2O(g) ΔH=-285.8 kJ•mol-1
CO(g) +1/2O2(g) = CO2(g) ΔH=-283.0 kJ•mol-1
则固态碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是___________ 。
(3)已知拆开1mol H-H键、1molN≡N和1mol N—H键分别需要的能量是436kJ、948kJ、391 kJ。则N2、H2合成NH3的热化学方程式为:___________ 。
(4)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。已知存在如下反应:
i.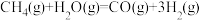

ii.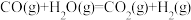

iii.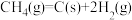

……
iii为积炭反应,利用 和
和 计算
计算 时,还需要利用
时,还需要利用___________ 反应的 。
。
(1)下图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式

(2)已知:C(s) + O2(g) = CO2(g) ΔH=-437.3 kJ•mol-1
H2(g) +1/2O2(g) = H2O(g) ΔH=-285.8 kJ•mol-1
CO(g) +1/2O2(g) = CO2(g) ΔH=-283.0 kJ•mol-1
则固态碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是
(3)已知拆开1mol H-H键、1molN≡N和1mol N—H键分别需要的能量是436kJ、948kJ、391 kJ。则N2、H2合成NH3的热化学方程式为:
(4)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。已知存在如下反应:
i.
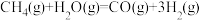

ii.
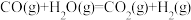

iii.
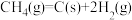

……
iii为积炭反应,利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。
您最近一年使用:0次
解题方法
5 . 载人航天器中,利用萨巴蒂尔反应将航天员呼出的 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。已知:
的再生。已知:
①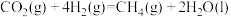 △H= -252.9kJ/mol
△H= -252.9kJ/mol
②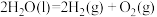 △H= 571.6.kJ/mol
△H= 571.6.kJ/mol
请回答下列问题:
(1)反应①属于______ (填“吸热”或“放热”)反应。
(2)反应①消耗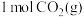 时,热量变化为
时,热量变化为______  。
。
(3)反应②的热量变化为吸热571.6.kJ时,生成 的质量是
的质量是_______ g。
(4)反应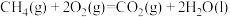 ,△H=
,△H=______  。
。
 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。已知:
的再生。已知:①
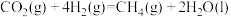 △H= -252.9kJ/mol
△H= -252.9kJ/mol②
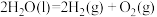 △H= 571.6.kJ/mol
△H= 571.6.kJ/mol请回答下列问题:
(1)反应①属于
(2)反应①消耗
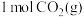 时,热量变化为
时,热量变化为 。
。(3)反应②的热量变化为吸热571.6.kJ时,生成
 的质量是
的质量是(4)反应
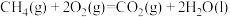 ,△H=
,△H= 。
。
您最近一年使用:0次
2020-09-16更新
|
204次组卷
|
3卷引用:北京市西城职业学校2021-2021学年高二上学期期中测试化学试题
6 . 我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料。
(1)制备碳酸钠。将饱和硫酸钠溶液和饱和碳酸氢铵溶液混合,结晶得NaHCO3晶体,再经加热分解制得碳酸钠。生成NaHCO3晶体的化学方程式是________ 。
已知:I.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol−1
II.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol−1
则:2NaHCO3(s) == Na2CO3(s) + CO2(g) + H2O(g) ΔH=________ kJ·mol−1。
(2)制备烧碱和硫酸。用如图所示装置,以惰性电极进行电解,a、b均为离子交换膜。
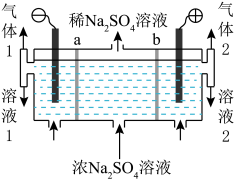
① Na+迁移方向是________ 。
② 气体1是________ ;溶液2是________ 。
(1)制备碳酸钠。将饱和硫酸钠溶液和饱和碳酸氢铵溶液混合,结晶得NaHCO3晶体,再经加热分解制得碳酸钠。生成NaHCO3晶体的化学方程式是
已知:I.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol−1
II.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol−1
则:2NaHCO3(s) == Na2CO3(s) + CO2(g) + H2O(g) ΔH=
(2)制备烧碱和硫酸。用如图所示装置,以惰性电极进行电解,a、b均为离子交换膜。

① Na+迁移方向是
② 气体1是
您最近一年使用:0次
名校
7 . 2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)⇌H2O(g) +CO(g) ΔH1 = + 41.1 kJ•mol-1
CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.0 kJ•mol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______ 。
(2)为提高CH3OH产率,理论上应采用的条件是_______ (填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。

① 反应物X是_______ (填“CO2”或“H2”)。
② 判断依据是_______ 。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K =_______ 。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
根据上表所给数据,用CO2生产甲醇的最优选项为_______ (填字母)。
(1)已知:CO2(g)+H2(g)⇌H2O(g) +CO(g) ΔH1 = + 41.1 kJ•mol-1
CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.0 kJ•mol-1
写出CO2催化氢化合成甲醇的热化学方程式:
(2)为提高CH3OH产率,理论上应采用的条件是
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。

① 反应物X是
② 判断依据是
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=
② 化学平衡常数K =
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
| 实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
| C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为
您最近一年使用:0次
2019-07-30更新
|
548次组卷
|
4卷引用:北京市第四十三中学2021-2022学年高二上学期期中考试化学试题
11-12高三上·北京西城·期末
8 . 氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
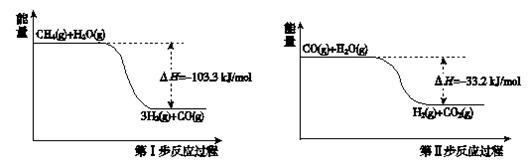
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是______ 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为______ ,CO的平衡转化率为______ 。

(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为
您最近一年使用:0次



